X
Код презентации скопируйте его
Окислительно-восстановительные равновесия в аналитической химии
Скачать эту презентациюПрезентация на тему Окислительно-восстановительные равновесия в аналитической химии
Скачать эту презентациюCлайд 2
 План лекции: Использование ОВР в аналитической химии. Типы ОВР. Количественное описание ОВР. Константа равновесия ОВР. Устойчивость водных растворов окислителей и восстановителей.
План лекции: Использование ОВР в аналитической химии. Типы ОВР. Количественное описание ОВР. Константа равновесия ОВР. Устойчивость водных растворов окислителей и восстановителей.
Cлайд 3
 Использование ОВР в аналитической химии При пробоподготовке для переведения в раствор пробы. Для разделения смеси ионов. Для маскирования. Для проведения реакций обнаружения катионов и анионов в качественном химическом анализе. В титриметрическом анализе. В электрохимических методах анализа.
Использование ОВР в аналитической химии При пробоподготовке для переведения в раствор пробы. Для разделения смеси ионов. Для маскирования. Для проведения реакций обнаружения катионов и анионов в качественном химическом анализе. В титриметрическом анализе. В электрохимических методах анализа.
Cлайд 4
 Например, при гипоксии (состояние кислородного голодания) происходит замедление транспорта Н+ и е – в дыхательной цепи и накопление восстановленных форм соединений. Этот сдвиг сопровождается снижением ОВ потенциала (ОВП) ткани и по мере углубления ишемии (местное малокровие, недостаточное содержание крови в органе или ткани) ОВП снижается. Это связано как с угнетением процессов окисления вследствие недостатка кислорода и нарушения каталитической способности окислительно-восстановительных ферментов, так и с активацией процессов восстановления в ходе гликолиза.
Например, при гипоксии (состояние кислородного голодания) происходит замедление транспорта Н+ и е – в дыхательной цепи и накопление восстановленных форм соединений. Этот сдвиг сопровождается снижением ОВ потенциала (ОВП) ткани и по мере углубления ишемии (местное малокровие, недостаточное содержание крови в органе или ткани) ОВП снижается. Это связано как с угнетением процессов окисления вследствие недостатка кислорода и нарушения каталитической способности окислительно-восстановительных ферментов, так и с активацией процессов восстановления в ходе гликолиза.
Cлайд 5
 Типы ОВР 1. Межмолекулярные – изменяются степени окисления (С.О.) атомов элементов, входящих в состав разных веществ:
Типы ОВР 1. Межмолекулярные – изменяются степени окисления (С.О.) атомов элементов, входящих в состав разных веществ:
Cлайд 7
 3. Самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент повышает и понижает С.О. Cl2 - является окислителем и восстановителем.
3. Самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент повышает и понижает С.О. Cl2 - является окислителем и восстановителем.
Cлайд 8
 Количественное описание ОВР Например, чем сильнее основание, тем больше его сродство в протону. Также и сильный окислитель обладает большим сродством к электрону. Например, в кислотно-основных реакциях участвует растворитель (вода), отдавая и принимая протон, а в ОВР вода тоже может терять или присоединять электрон. Например, для проведения кислотно-основных реакций необходимы как кислота, так и основание, а в ОВР – и окислитель и восстановитель.
Количественное описание ОВР Например, чем сильнее основание, тем больше его сродство в протону. Также и сильный окислитель обладает большим сродством к электрону. Например, в кислотно-основных реакциях участвует растворитель (вода), отдавая и принимая протон, а в ОВР вода тоже может терять или присоединять электрон. Например, для проведения кислотно-основных реакций необходимы как кислота, так и основание, а в ОВР – и окислитель и восстановитель.
Cлайд 9
 Рассматривая ОВ пару в целом, можно записать схематичное уравнение реакции: Ox + nē = Red Равновесие в растворе можно описать с помощью равновесного потенциала, который зависит от состава раствора по уравнению Нернста:
Рассматривая ОВ пару в целом, можно записать схематичное уравнение реакции: Ox + nē = Red Равновесие в растворе можно описать с помощью равновесного потенциала, который зависит от состава раствора по уравнению Нернста:
Cлайд 11
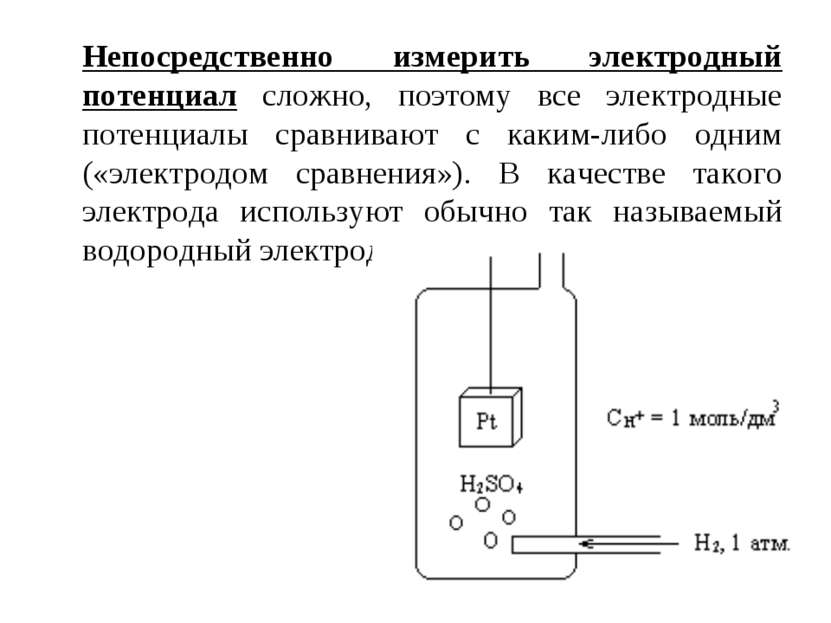
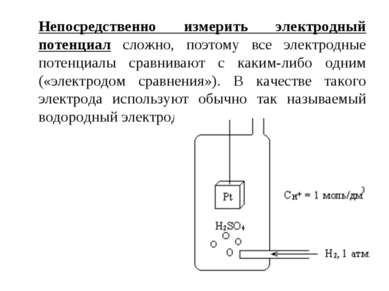 Непосредственно измерить электродный потенциал сложно, поэтому все электродные потенциалы сравнивают с каким-либо одним («электродом сравнения»). В качестве такого электрода используют обычно так называемый водородный электрод.
Непосредственно измерить электродный потенциал сложно, поэтому все электродные потенциалы сравнивают с каким-либо одним («электродом сравнения»). В качестве такого электрода используют обычно так называемый водородный электрод.
Cлайд 12
 В уравнении Нернста можно использовать вместо активностей ионов их концентрации, но тогда необходимо знать коэффициенты активностей ионов:
В уравнении Нернста можно использовать вместо активностей ионов их концентрации, но тогда необходимо знать коэффициенты активностей ионов:
Cлайд 13
 На силу окислителя и восстановителя могут влиять: значение рН, реакции осаждения реакции комплексообразования. Тогда свойства редокс-пары будут описываться реальным потенциалом.
На силу окислителя и восстановителя могут влиять: значение рН, реакции осаждения реакции комплексообразования. Тогда свойства редокс-пары будут описываться реальным потенциалом.
Cлайд 14
 Для расчета реального потенциала полуреакций, получаемых сочетанием ОВР и реакций осаждения, используются формулы: если окисленная форма представляет собой малорастворимое соединение:
Для расчета реального потенциала полуреакций, получаемых сочетанием ОВР и реакций осаждения, используются формулы: если окисленная форма представляет собой малорастворимое соединение:
Cлайд 23
 Константа равновесия ОВР Расчет константы равновесия для реакции: Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+ Константа равновесия рассчитывается:
Константа равновесия ОВР Расчет константы равновесия для реакции: Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+ Константа равновесия рассчитывается:
Cлайд 24
 Выражения для реальных ОВ потенциалов каждой редокс-пары будут выглядеть следующим образом:
Выражения для реальных ОВ потенциалов каждой редокс-пары будут выглядеть следующим образом:
Cлайд 27
 Используя приведенное вычисление константы равновесия, получим для любого обратимого ОВ процесса при 20 0С следующее уравнение:
Используя приведенное вычисление константы равновесия, получим для любого обратимого ОВ процесса при 20 0С следующее уравнение: