X
Код презентации скопируйте его
Оксиды
Скачать эту презентациюПрезентация на тему Оксиды
Скачать эту презентациюCлайд 1
 Тема урока: Оксиды Презентацию разработала Носенко Е.М. учитель химии МОУ СОШ № 9 с. Подлужное Изобильненского района
Тема урока: Оксиды Презентацию разработала Носенко Е.М. учитель химии МОУ СОШ № 9 с. Подлужное Изобильненского района
Cлайд 2
 Цель урока. Обобщить знания о составе оксидов, рассмотреть их классификацию и свойства основных и кислотных оксидов.
Цель урока. Обобщить знания о составе оксидов, рассмотреть их классификацию и свойства основных и кислотных оксидов.
Cлайд 3
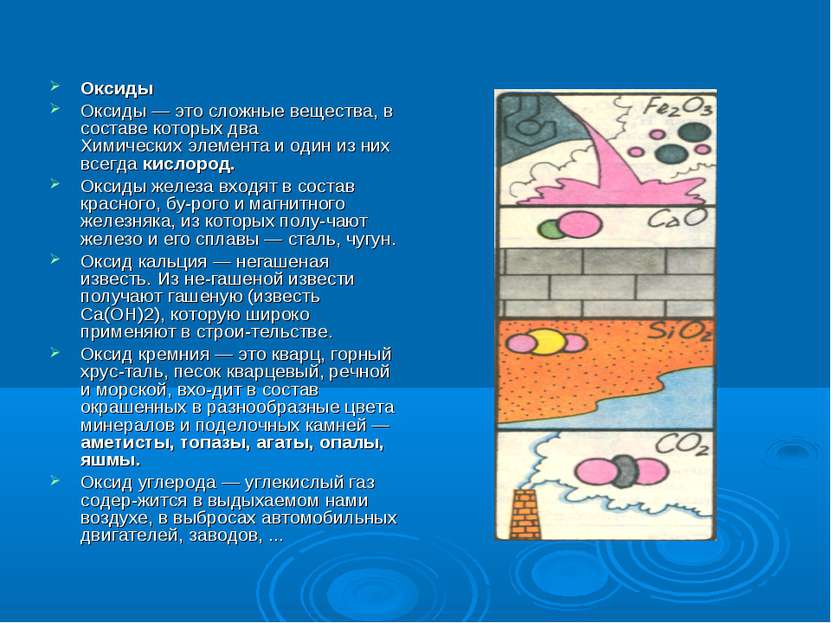
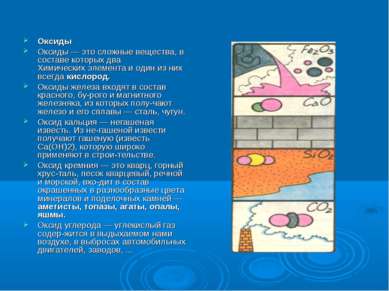 Оксиды Оксиды — это сложные вещества, в составе которых два Химических элемента и один из них всегда кислород. Оксиды железа входят в состав красного, бу рого и магнитного железняка, из которых полу чают железо и его сплавы — сталь, чугун. Оксид кальция — негашеная известь. Из не гашеной извести получают гашеную (известь Са(ОН)2), которую широко применяют в строи тельстве. Оксид кремния — это кварц, горный хрус таль, песок кварцевый, речной и морской, вхо дит в состав окрашенных в разнообразные цвета минералов и поделочных камней — аметисты, топазы, агаты, опалы, яшмы. Оксид углерода — углекислый газ содер жится в выдыхаемом нами воздухе, в выбросах автомобильных двигателей, заводов, ...
Оксиды Оксиды — это сложные вещества, в составе которых два Химических элемента и один из них всегда кислород. Оксиды железа входят в состав красного, бу рого и магнитного железняка, из которых полу чают железо и его сплавы — сталь, чугун. Оксид кальция — негашеная известь. Из не гашеной извести получают гашеную (известь Са(ОН)2), которую широко применяют в строи тельстве. Оксид кремния — это кварц, горный хрус таль, песок кварцевый, речной и морской, вхо дит в состав окрашенных в разнообразные цвета минералов и поделочных камней — аметисты, топазы, агаты, опалы, яшмы. Оксид углерода — углекислый газ содер жится в выдыхаемом нами воздухе, в выбросах автомобильных двигателей, заводов, ...
Cлайд 4
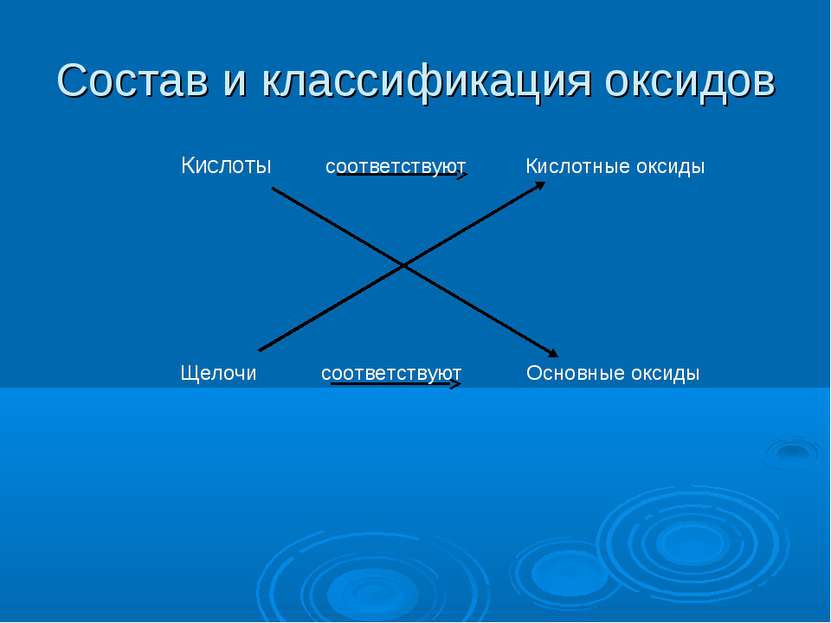
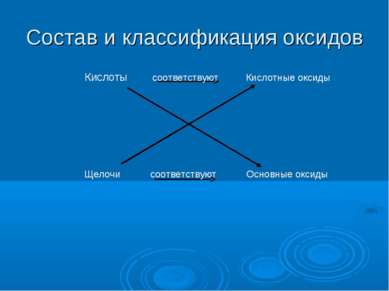 Состав и классификация оксидов Кислоты соответствуют Кислотные оксиды Щелочи соответствуют Основные оксиды
Состав и классификация оксидов Кислоты соответствуют Кислотные оксиды Щелочи соответствуют Основные оксиды
Cлайд 5
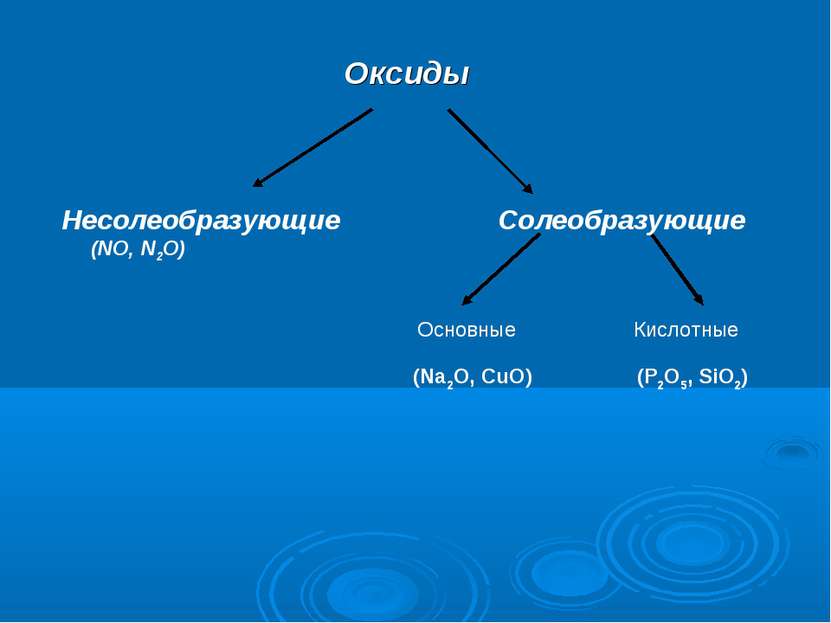
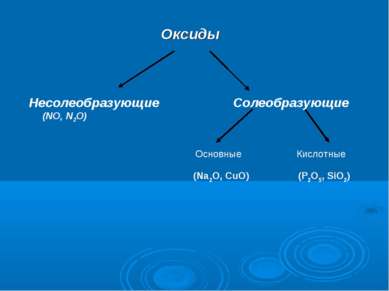 Оксиды Несолеобразующие Солеобразующие (NO, N2O) (Na2O, CuO) (P2O5, SiO2) Основные Кислотные
Оксиды Несолеобразующие Солеобразующие (NO, N2O) (Na2O, CuO) (P2O5, SiO2) Основные Кислотные
Cлайд 6
 Лабораторная работа 1) получить углекислый газ взаимодействием мрамора и соляной кислоты в пробирке с газоотводной трубкой, а затем пропустить его во вторую пробирку с «известковой водой» 2) взаимодействие серной кислоты с оксидом меди (II) при нагревании.
Лабораторная работа 1) получить углекислый газ взаимодействием мрамора и соляной кислоты в пробирке с газоотводной трубкой, а затем пропустить его во вторую пробирку с «известковой водой» 2) взаимодействие серной кислоты с оксидом меди (II) при нагревании.
Cлайд 8
 Химические свойства Основных оксидов (оксидов металлов со с. о. +1, +2) Кислотных оксидов (оксидов неметаллов) 1. Взаимодействуют с образованием соли и воды с кислотами: CaO + 2H+ = Ca2+ + H2O или CaO + 2HCl = CaCl2 + H2O со щелочами: SO3 + 2OH- = SO42- + H2O или SO3 + 2NaOH = Na2SO4 + H2O 2. Взаимодействуют с водой, если образуется растворимый гидроксид, а именно Растворимое основание: Na2O + H2O = 2NaOH но CuO + H2O ≠ Cu(OH)2↓ Растворимая кислота: P2O5 + 3H2O = 2H3PO4 но SiO2 + 3H2O ≠ H2SiO3 3. Взаимодействуют друг с другом, образуя соли: BaO + N2O5 = Ba(NO3)2 CaO + SiO2 = CaSiO3
Химические свойства Основных оксидов (оксидов металлов со с. о. +1, +2) Кислотных оксидов (оксидов неметаллов) 1. Взаимодействуют с образованием соли и воды с кислотами: CaO + 2H+ = Ca2+ + H2O или CaO + 2HCl = CaCl2 + H2O со щелочами: SO3 + 2OH- = SO42- + H2O или SO3 + 2NaOH = Na2SO4 + H2O 2. Взаимодействуют с водой, если образуется растворимый гидроксид, а именно Растворимое основание: Na2O + H2O = 2NaOH но CuO + H2O ≠ Cu(OH)2↓ Растворимая кислота: P2O5 + 3H2O = 2H3PO4 но SiO2 + 3H2O ≠ H2SiO3 3. Взаимодействуют друг с другом, образуя соли: BaO + N2O5 = Ba(NO3)2 CaO + SiO2 = CaSiO3