X
Код презентации скопируйте его
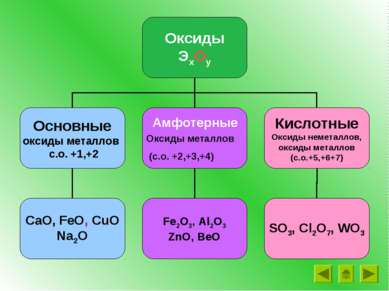
Амфотерные оксиды и гидроксиды
Скачать эту презентациюПрезентация на тему Амфотерные оксиды и гидроксиды
Скачать эту презентациюCлайд 2
 Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах; Повторить, закрепить и развить знания о классификации и свойствах гидроксидов (в том числе и в свете ТЭД) и о генетической связи между классами веществ
Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах; Повторить, закрепить и развить знания о классификации и свойствах гидроксидов (в том числе и в свете ТЭД) и о генетической связи между классами веществ
Cлайд 3
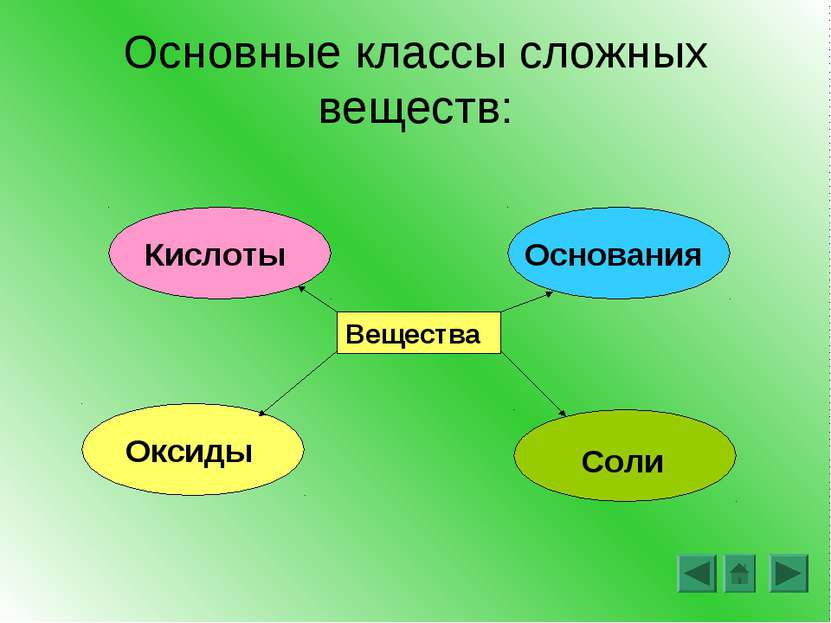
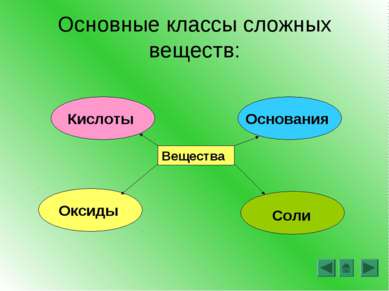
 Основные классы сложных веществ (повторение) Генетическая связь (повторение) Лабораторная работа Понятие амфотерности. Амфотерные оксиды и гидроксиды
Основные классы сложных веществ (повторение) Генетическая связь (повторение) Лабораторная работа Понятие амфотерности. Амфотерные оксиды и гидроксиды
Cлайд 5
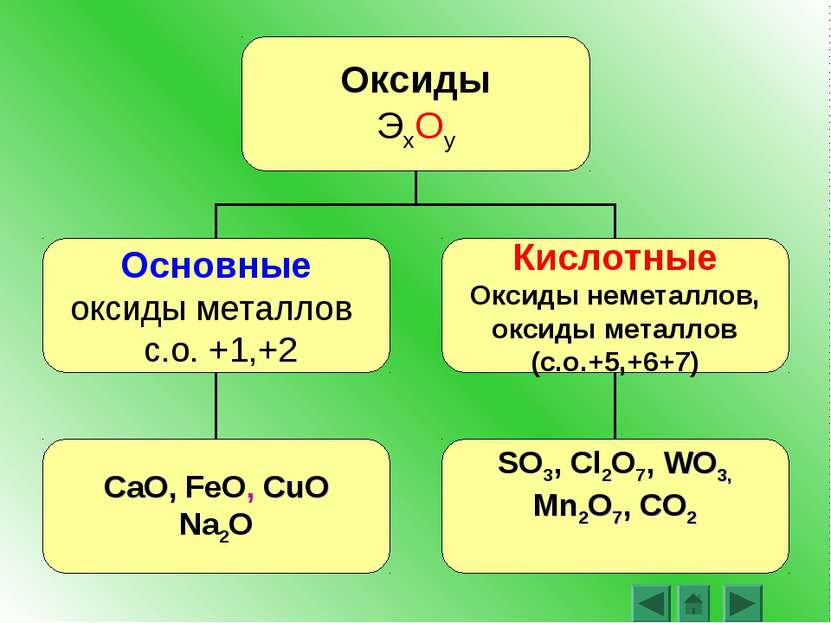
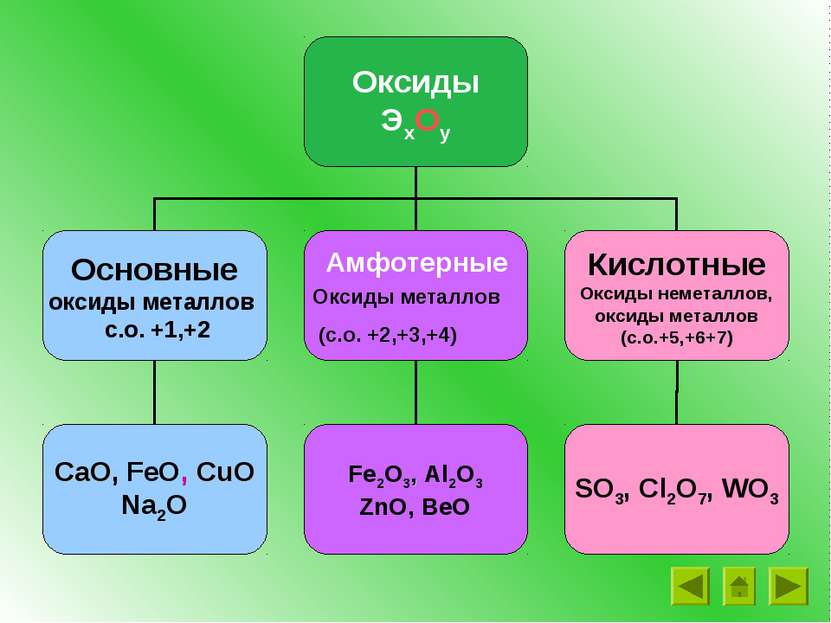
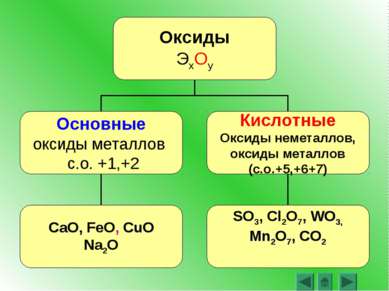
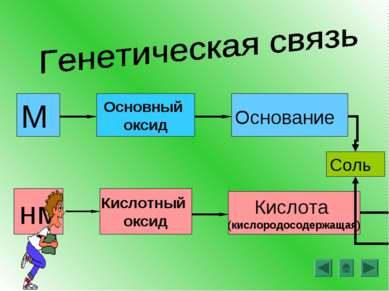
 Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2 SiO2 Cl2O7 CO2 H2O FeO
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со степенью окисления -2 SiO2 Cl2O7 CO2 H2O FeO
Cлайд 6
 Задание 1 Выберите из списка веществ оксиды: H2O, CO2, P2O5, WO3 Fe2O3 SO3, CaCl2, SCl6, CuO, H2SO4, NaOH,
Задание 1 Выберите из списка веществ оксиды: H2O, CO2, P2O5, WO3 Fe2O3 SO3, CaCl2, SCl6, CuO, H2SO4, NaOH,
Cлайд 8
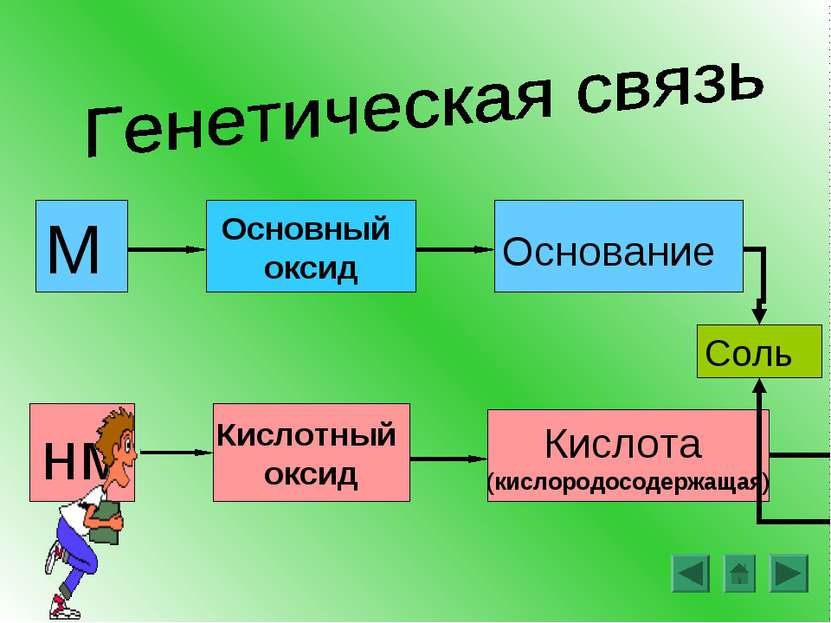
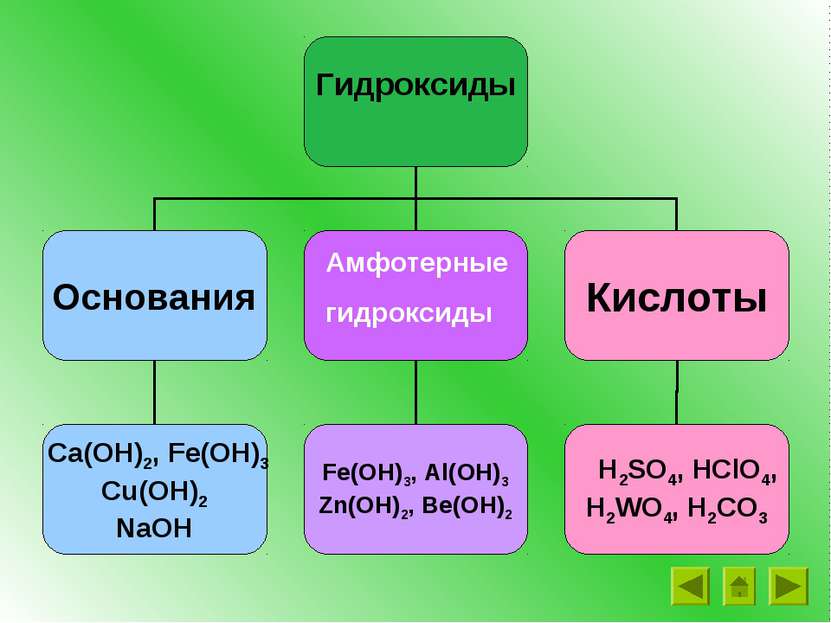
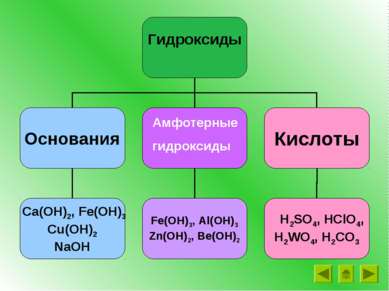
 Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов (ОН ) - М(ОН)n __ где М – металл, n – число групп ОН и в то же время заряд иона металла NaOH Ca(OH)2 Fe(OH)3 + +2 +3 Называем: гидроксид металла
Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких гидроксид-ионов (ОН ) - М(ОН)n __ где М – металл, n – число групп ОН и в то же время заряд иона металла NaOH Ca(OH)2 Fe(OH)3 + +2 +3 Называем: гидроксид металла
Cлайд 9
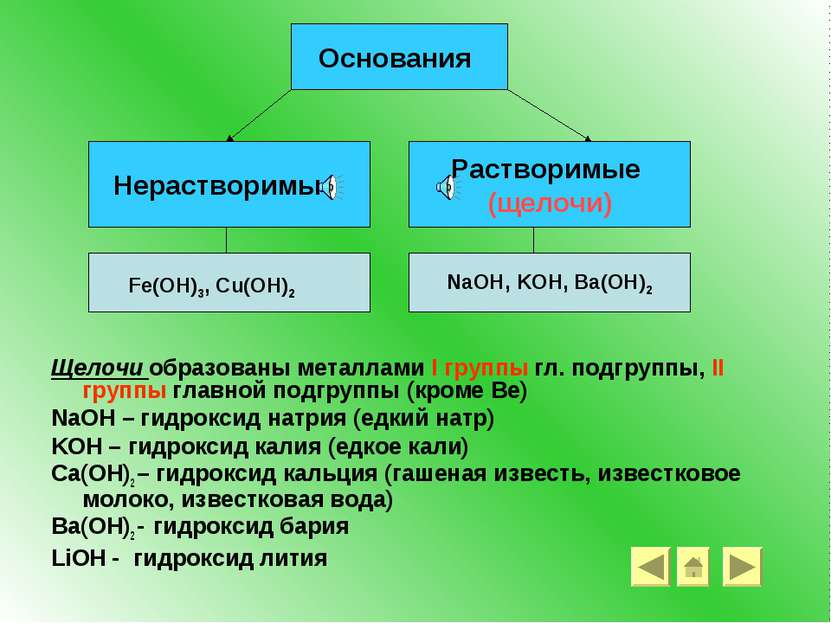
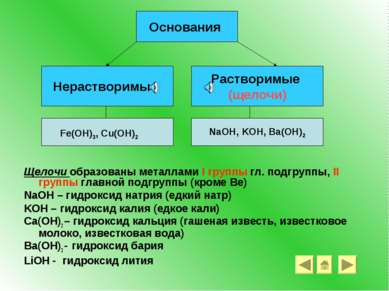 Щелочи образованы металлами I группы гл. подгруппы, II группы главной подгруппы (кроме Be) NaOH – гидроксид натрия (едкий натр) KOH – гидроксид калия (едкое кали) Ca(OH)2 – гидроксид кальция (гашеная известь, известковое молоко, известковая вода) Ba(OH)2 - гидроксид бария LiOH - гидроксид лития Основания Нерастворимые Растворимые (щелочи) NaOH, KOH, Ba(OH)2 Fe(OH)3, Cu(OH)2
Щелочи образованы металлами I группы гл. подгруппы, II группы главной подгруппы (кроме Be) NaOH – гидроксид натрия (едкий натр) KOH – гидроксид калия (едкое кали) Ca(OH)2 – гидроксид кальция (гашеная известь, известковое молоко, известковая вода) Ba(OH)2 - гидроксид бария LiOH - гидроксид лития Основания Нерастворимые Растворимые (щелочи) NaOH, KOH, Ba(OH)2 Fe(OH)3, Cu(OH)2
Cлайд 10
 Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Кислородосодержащие кислоты: Бескислородные Азотная кислота – HNO3 Соляная кислота - HCl Азотистая кислота – HNO2 Сероводородная – H2S Серная кислота – H2SO4 Бромоводородная - HBr Сернистая кислота – H2SO3 Угольная кислота – H2CO3 Фосфорная кислота – H3PO4
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Кислородосодержащие кислоты: Бескислородные Азотная кислота – HNO3 Соляная кислота - HCl Азотистая кислота – HNO2 Сероводородная – H2S Серная кислота – H2SO4 Бромоводородная - HBr Сернистая кислота – H2SO3 Угольная кислота – H2CO3 Фосфорная кислота – H3PO4
Cлайд 11
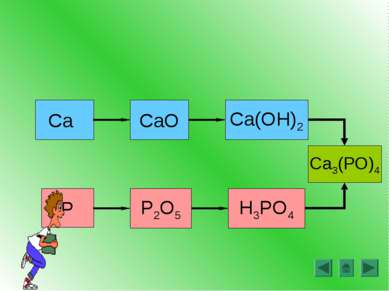
 Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков KNO3 NaCl CuSO4 FeS CaCO3 Ca3(PO4)2
Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков KNO3 NaCl CuSO4 FeS CaCO3 Ca3(PO4)2
Cлайд 13
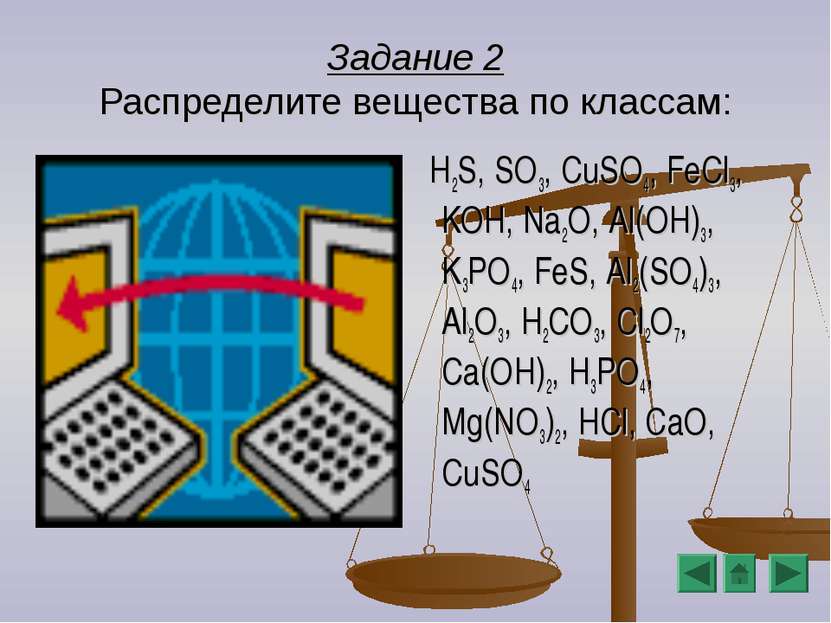
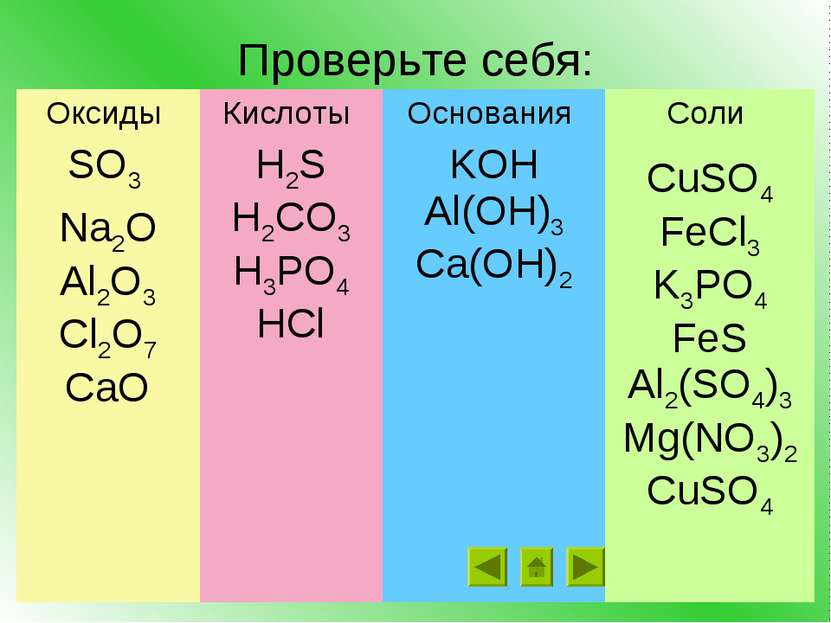
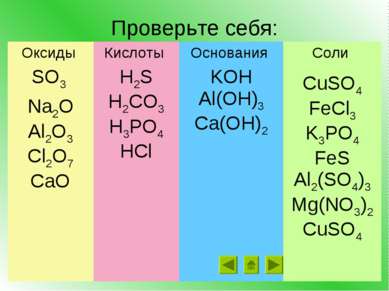
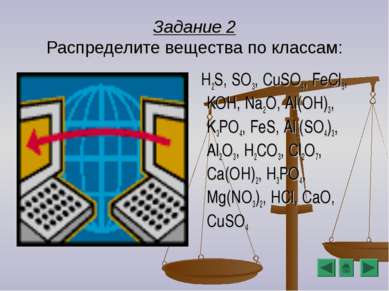 Задание 2 Распределите вещества по классам: H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3, Al2O3, H2CO3, Cl2O7, Ca(OH)2, H3PO4, Mg(NO3)2, HCl, CaO, CuSO4
Задание 2 Распределите вещества по классам: H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3, Al2O3, H2CO3, Cl2O7, Ca(OH)2, H3PO4, Mg(NO3)2, HCl, CaO, CuSO4
Cлайд 17
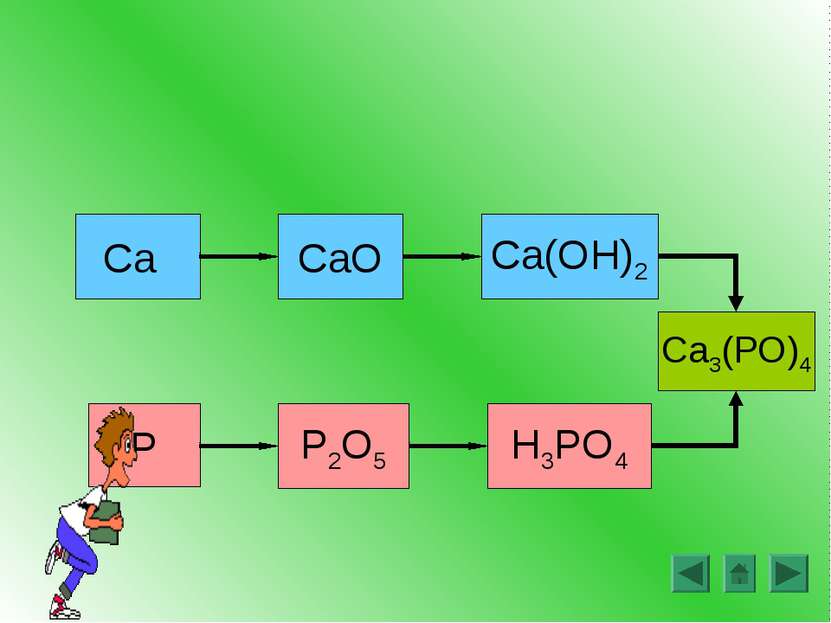
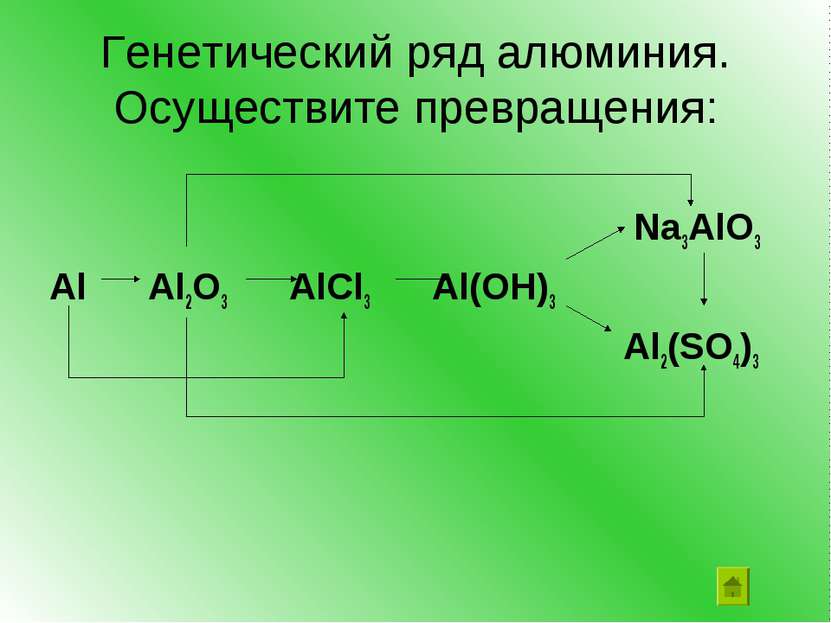
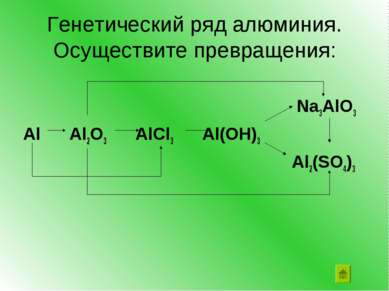
 Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия: AlCl3 + 3NaOH Al(OH)3 + 3NaCl
Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия: AlCl3 + 3NaOH Al(OH)3 + 3NaCl
Cлайд 18
 Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со щелочами В другую пробирку с осадком прилейте избыток раствора щелочи
Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со щелочами В другую пробирку с осадком прилейте избыток раствора щелочи
Cлайд 19
 Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства.
Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя с кислотой, но он также ведет себя и как нерастворимая кислота, взаимодействуя со щелочью. Он проявляет амфотерные свойства.
Cлайд 20
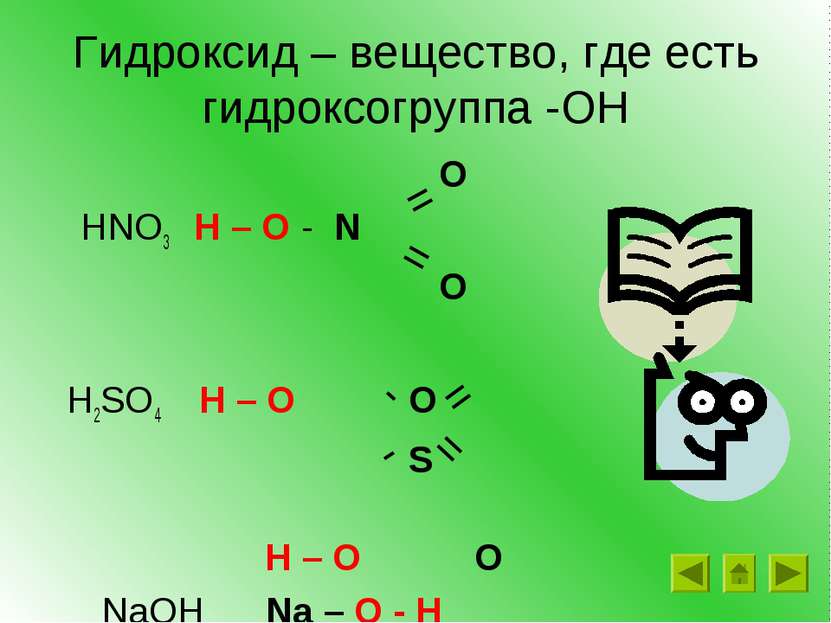
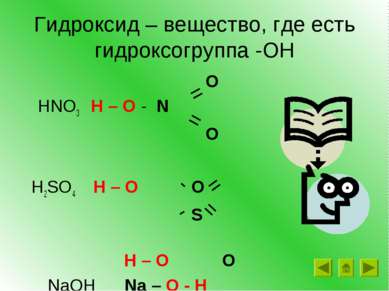 Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO3 H – O - N O H2SO4 H – O O S H – O O NaOH Na – O - H = = - - = =
Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO3 H – O - N O H2SO4 H – O O S H – O O NaOH Na – O - H = = - - = =
Cлайд 21
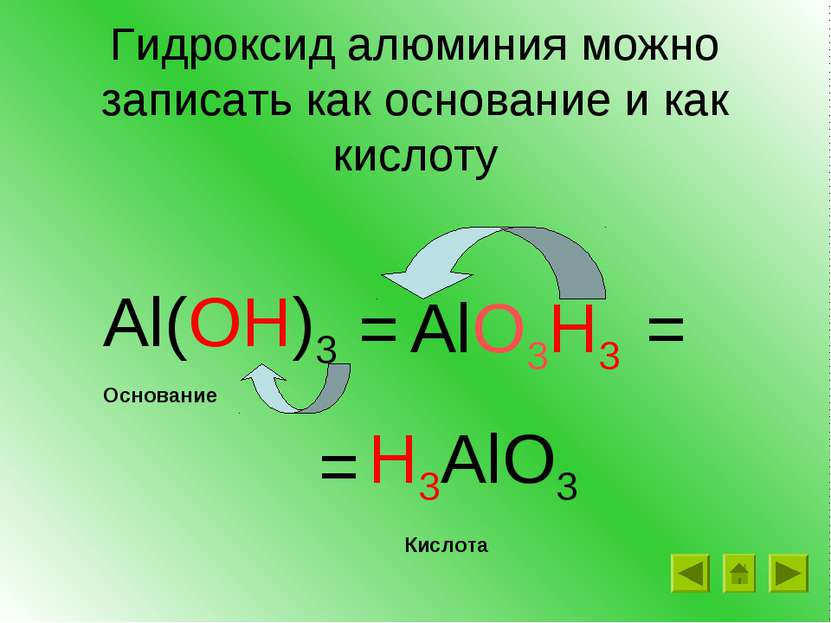
 Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота Основание
Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота Основание
Cлайд 26
 Какие из групп веществ проявляют амфотерные свойства? Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2 Fe2O3, Al2O3, Fe(OН)3 , ZnO, Be(OН)2 SO3, Cl2O7, WO3, Н2SO4, Н2CrO4
Какие из групп веществ проявляют амфотерные свойства? Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2 Fe2O3, Al2O3, Fe(OН)3 , ZnO, Be(OН)2 SO3, Cl2O7, WO3, Н2SO4, Н2CrO4