X
Код презентации скопируйте его
Классификация химических элементов
Скачать эту презентациюПрезентация на тему Классификация химических элементов
Скачать эту презентациюCлайд 1
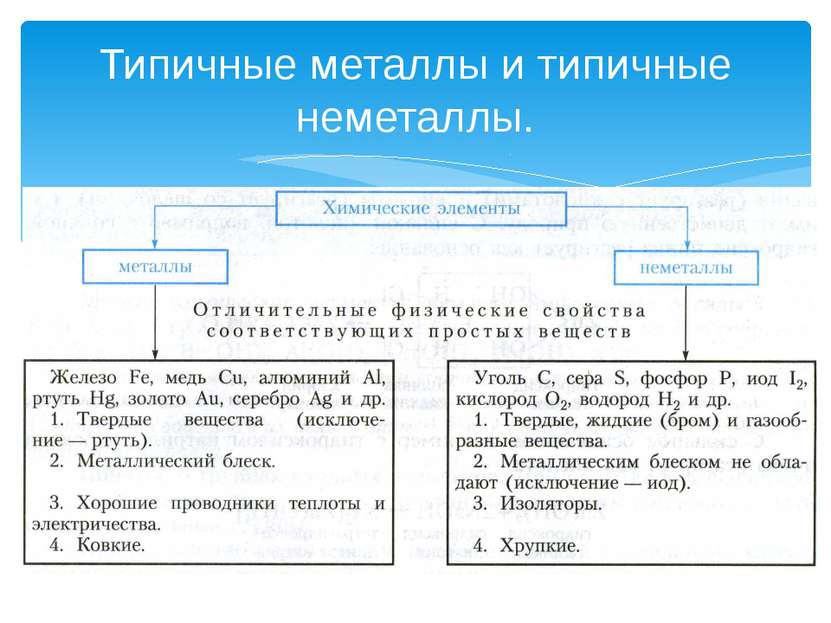
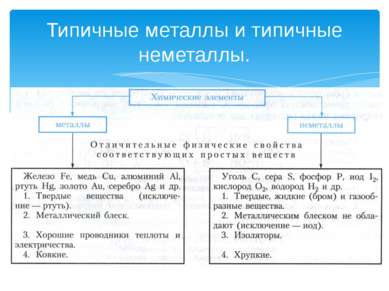
 Классификация химических элементов Й. Я. Берцелиус – выдающийся шведский ученый разделил все элементы на металлы и неметаллы.
Классификация химических элементов Й. Я. Берцелиус – выдающийся шведский ученый разделил все элементы на металлы и неметаллы.
Cлайд 4
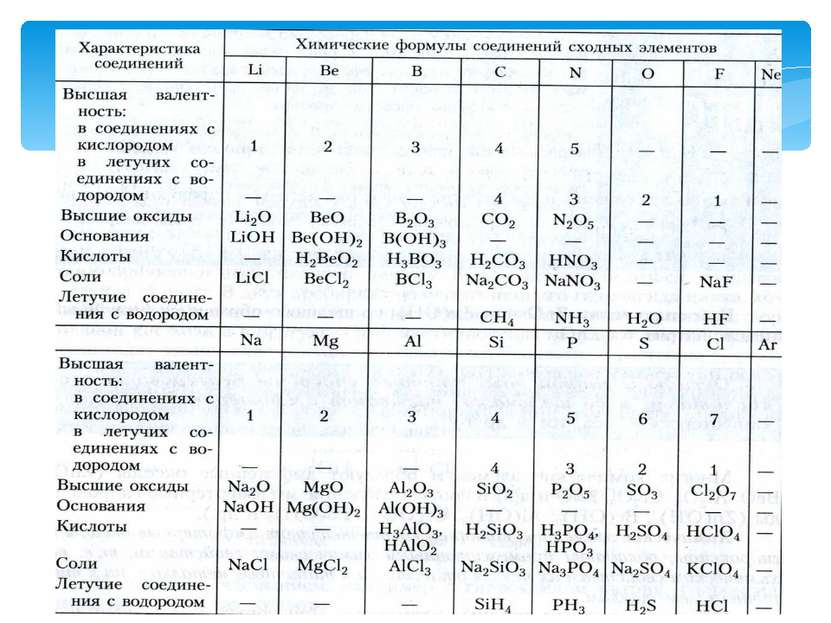
 Типичный металл взаимодействует с кислородом и образует основный оксид: Na2O, MgO, CaO, BaO, K2O. 2Ca + O2 = 2CaO оксид кальция которому соответствует основание СaO + H2O = Ca(OH)2 гидроксид кальция Основание реагирует с кислотой, образуя соль и воду: Ca(OH)2 + 2HCl = CaCl2 + 2H2O хлорид кальция Металл вытесняет из кислот водород: Mg + H2SO4 = MgSO4 + H2↑. сульфат магния Типичный неметалл взаимодействует с кислородом и образует кислотный оксид: CO2, SO2, P2O5, SiO2, SO3. 4P + 5O2 = 2P2O5 Которому соответствует кислота P2O5 + 3H2O = 2H3PO4 Кислота реагирует с основанием, Образуя соль и воду: H3PO4 + 3NaOH = Na3PO4 + 3H2O Неметалл с кислотой не реагирует. Неметалл реагирует с водородом и образует летучее водородное соединение: S + H2 = H2S.
Типичный металл взаимодействует с кислородом и образует основный оксид: Na2O, MgO, CaO, BaO, K2O. 2Ca + O2 = 2CaO оксид кальция которому соответствует основание СaO + H2O = Ca(OH)2 гидроксид кальция Основание реагирует с кислотой, образуя соль и воду: Ca(OH)2 + 2HCl = CaCl2 + 2H2O хлорид кальция Металл вытесняет из кислот водород: Mg + H2SO4 = MgSO4 + H2↑. сульфат магния Типичный неметалл взаимодействует с кислородом и образует кислотный оксид: CO2, SO2, P2O5, SiO2, SO3. 4P + 5O2 = 2P2O5 Которому соответствует кислота P2O5 + 3H2O = 2H3PO4 Кислота реагирует с основанием, Образуя соль и воду: H3PO4 + 3NaOH = Na3PO4 + 3H2O Неметалл с кислотой не реагирует. Неметалл реагирует с водородом и образует летучее водородное соединение: S + H2 = H2S.
Cлайд 5
 Найди соответствие, для этого выбери каждому номеру букву верного утверждения: 1.Ртуть А. Твердое вещество 2.сера Б. Имеет металлический блеск Г. Ковкое вещество 3.золото Д. Хрупкое вещество 4.водород Ж. Проводит тепло и электричество В. Жидкое вещество Е. Газ
Найди соответствие, для этого выбери каждому номеру букву верного утверждения: 1.Ртуть А. Твердое вещество 2.сера Б. Имеет металлический блеск Г. Ковкое вещество 3.золото Д. Хрупкое вещество 4.водород Ж. Проводит тепло и электричество В. Жидкое вещество Е. Газ
Cлайд 7
 Есть элементы, которые образуют оксиды и гидроксиды, проявляющие амфотерные свойства. Амфотерными называют оксиды и гидроксиды, которые взаимодействуют и с кислотами и со щелочами, образуя соль и воду: ZnO – Zn(OH)2, Al2O3 – Al(OH)3, Cr2O3 – Cr(OH)3, BeO – Be(OH)2, PbO – Pb(OH)2. Классификация химических элементов на металлы и неметаллы оказалась неполной
Есть элементы, которые образуют оксиды и гидроксиды, проявляющие амфотерные свойства. Амфотерными называют оксиды и гидроксиды, которые взаимодействуют и с кислотами и со щелочами, образуя соль и воду: ZnO – Zn(OH)2, Al2O3 – Al(OH)3, Cr2O3 – Cr(OH)3, BeO – Be(OH)2, PbO – Pb(OH)2. Классификация химических элементов на металлы и неметаллы оказалась неполной
Cлайд 8
 Оксид цинка взаимодействует с кислотами образуя соль и воду: ZnO + H2SO4 = ZnSO4, следовательно, оксид цинка проявляет свойства основного оксида. Гидроксид цинка тоже реагирует с кислотой, образуя соль и воду: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O, т.е. проявляет свойства основания. 1.Амфотерные свойства оксида и гидроксида цинка.
Оксид цинка взаимодействует с кислотами образуя соль и воду: ZnO + H2SO4 = ZnSO4, следовательно, оксид цинка проявляет свойства основного оксида. Гидроксид цинка тоже реагирует с кислотой, образуя соль и воду: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O, т.е. проявляет свойства основания. 1.Амфотерные свойства оксида и гидроксида цинка.
Cлайд 9
 Оксид и гидроксид цинка взаимодействуют с сильными щелочами и образуют соль и воду: ZnO + 2NaOH = Na2ZnO2 + H2O оксид цинка проявляет свойства кислотного оксида H2ZnO2 цинкат натрия Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O гидроксид цинка проявляет свойства кислоты Эти реакции протекают при сплавлении твердых веществ. 2.Амфотерные свойства оксида и гидроксида цинка
Оксид и гидроксид цинка взаимодействуют с сильными щелочами и образуют соль и воду: ZnO + 2NaOH = Na2ZnO2 + H2O оксид цинка проявляет свойства кислотного оксида H2ZnO2 цинкат натрия Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O гидроксид цинка проявляет свойства кислоты Эти реакции протекают при сплавлении твердых веществ. 2.Амфотерные свойства оксида и гидроксида цинка
Cлайд 10
 Составьте уравнения реакций, доказывающих амфотерный характер оксида и гидроксида алюминия Al2O3 + 6HNO3 =2 Al(NO3)3 + 3H2O Al(OH)3 + 3HCl = AlCl3 + 3H2O Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O Al(OH)3 + 3NaOH = Na3AlO3 + 3H2O
Составьте уравнения реакций, доказывающих амфотерный характер оксида и гидроксида алюминия Al2O3 + 6HNO3 =2 Al(NO3)3 + 3H2O Al(OH)3 + 3HCl = AlCl3 + 3H2O Al2O3 + 6NaOH = 2Na3AlO3 + 3H2O Al(OH)3 + 3NaOH = Na3AlO3 + 3H2O
Cлайд 11
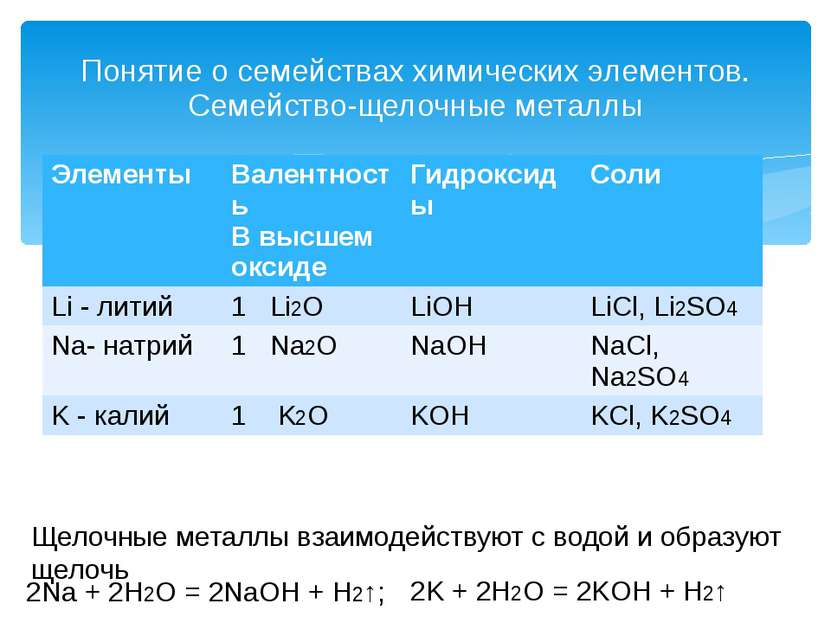
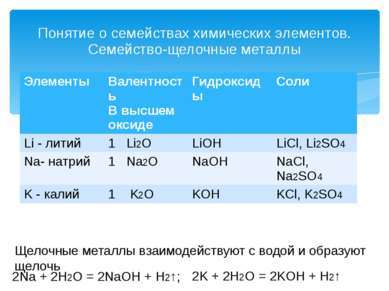 Понятие о семействах химических элементов. Семейство-щелочные металлы Щелочные металлы взаимодействуют с водой и образуют щелочь 2Na + 2H2O = 2NaOH + H2↑; 2K + 2H2O = 2KOH + H2↑ Элементы Валентность В высшем оксиде Гидроксиды Соли Li -литий 1Li2O LiOH LiCl, Li2SO4 Na- натрий 1Na2O NaOH NaCl, Na2SO4 K- калий 1K2O KOH KCl,K2SO4
Понятие о семействах химических элементов. Семейство-щелочные металлы Щелочные металлы взаимодействуют с водой и образуют щелочь 2Na + 2H2O = 2NaOH + H2↑; 2K + 2H2O = 2KOH + H2↑ Элементы Валентность В высшем оксиде Гидроксиды Соли Li -литий 1Li2O LiOH LiCl, Li2SO4 Na- натрий 1Na2O NaOH NaCl, Na2SO4 K- калий 1K2O KOH KCl,K2SO4
Cлайд 12
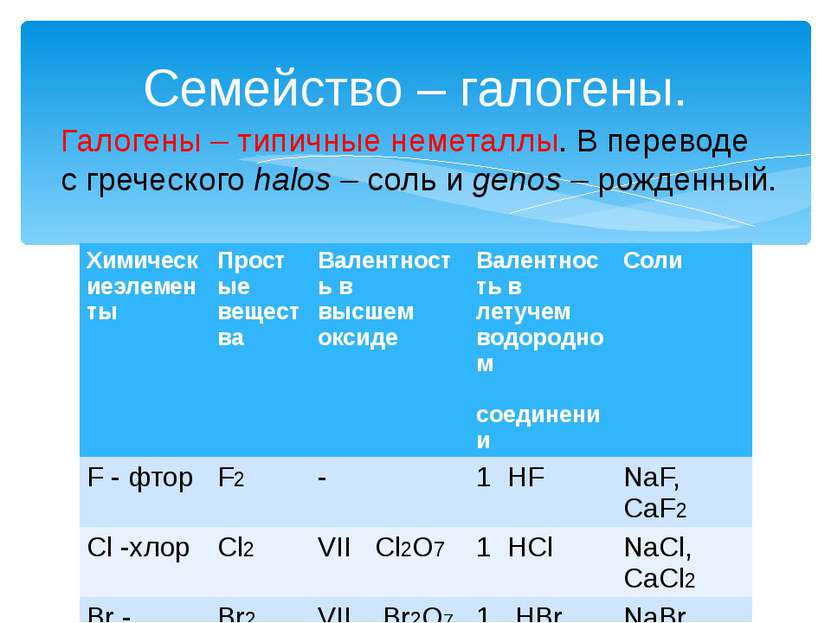
 Семейство – галогены. Галогены – типичные неметаллы. В переводе с греческого halos – соль и genos – рожденный. Химическиеэлементы Простые вещества Валентностьв высшем оксиде Валентность в летучем водородном соединении Соли F -фтор F2 - 1HF NaF,CaF2 Cl-хлор Cl2 VII Cl2O7 1HCl NaCl, CaCl2 Br -бром Br2 VII Br2O7 1HBr NaBr, CaBr2 I -иод I2 VII I2O7 1HI NaI, CaI2
Семейство – галогены. Галогены – типичные неметаллы. В переводе с греческого halos – соль и genos – рожденный. Химическиеэлементы Простые вещества Валентностьв высшем оксиде Валентность в летучем водородном соединении Соли F -фтор F2 - 1HF NaF,CaF2 Cl-хлор Cl2 VII Cl2O7 1HCl NaCl, CaCl2 Br -бром Br2 VII Br2O7 1HBr NaBr, CaBr2 I -иод I2 VII I2O7 1HI NaI, CaI2
Cлайд 13
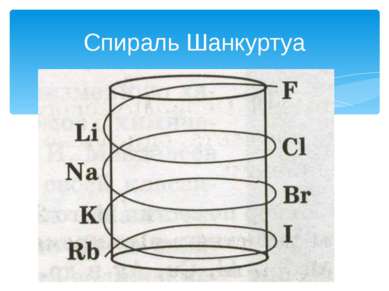
 Многие химики: немецкие ученые И. Деберейнер и Л. Мейер, англичанин Дж. Ньюлендс, француз А. Шанкуртуа и другие – предлагали различные варианты классификации химических элементов. Только открытие русским ученым Д. И. Менделеевым одного из фундаментальных законов природы – периодического закона химических элементов – позволило создать единую систему химических элементов. Открытие периодического закона
Многие химики: немецкие ученые И. Деберейнер и Л. Мейер, англичанин Дж. Ньюлендс, француз А. Шанкуртуа и другие – предлагали различные варианты классификации химических элементов. Только открытие русским ученым Д. И. Менделеевым одного из фундаментальных законов природы – периодического закона химических элементов – позволило создать единую систему химических элементов. Открытие периодического закона
Cлайд 16
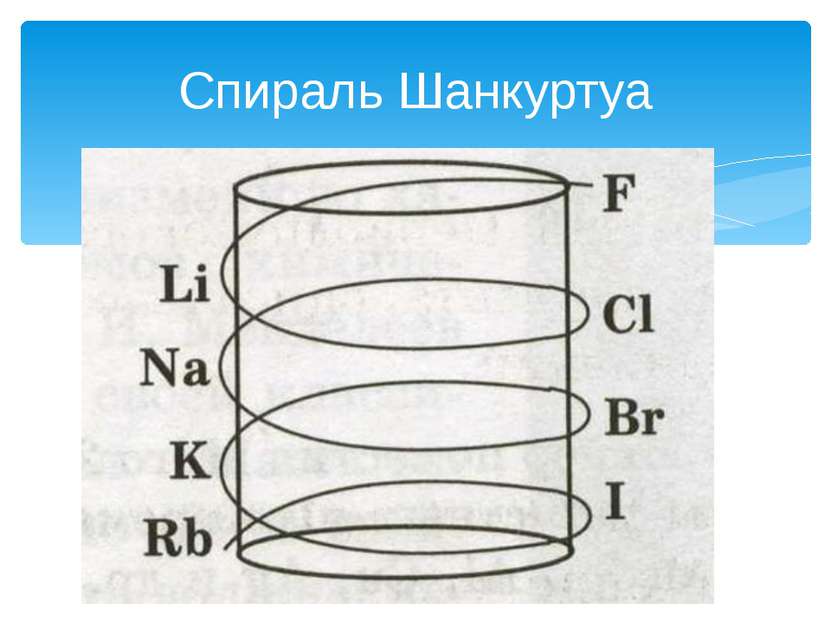
 Триады Дёберейнера Триады Деберейнера (1816 г.). Немецкий химик И. В. Деберейнер разделил элементы по три на основе сходства в свойствах образуемых им веществ и так, чтобы величина, которую мы сейчас понимаем как относительную атомную массу среднего элемента, была равна среднему арифметическому двух крайних. Пример триады: Li, Na, К. Ar(Na) = (7 + 39): 2 - 23. Примерами других триад могут служить: S, Se, Те; CI, Br, I.
Триады Дёберейнера Триады Деберейнера (1816 г.). Немецкий химик И. В. Деберейнер разделил элементы по три на основе сходства в свойствах образуемых им веществ и так, чтобы величина, которую мы сейчас понимаем как относительную атомную массу среднего элемента, была равна среднему арифметическому двух крайних. Пример триады: Li, Na, К. Ar(Na) = (7 + 39): 2 - 23. Примерами других триад могут служить: S, Se, Те; CI, Br, I.
Cлайд 21
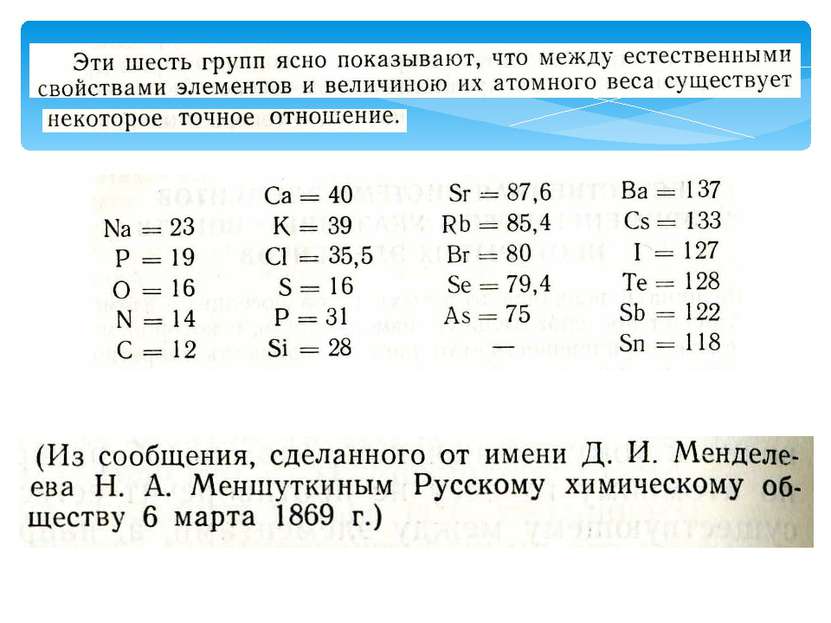
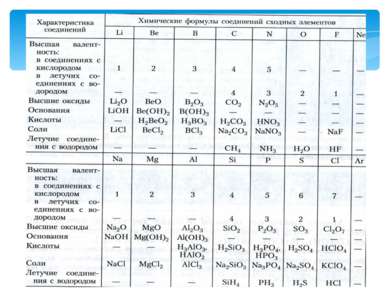
 С возрастанием атомного веса 1)металлические свойства постепенно ослабевают (Na Mg Al Si), а неметаллические усиливаются (Si, P, S, Cl) и обрываются у инертного газа (Ar); 2)валентность в высших оксидах возрастает от 1-го до 7-и; 3)валентность в летучих водородных соединениях уменьшается от 4-х до 1-го; 4)свойства химических элементов повторяются периодически (через 7 на 8-ой). В основу периодического закона Д. И. Менделеев взял коренное свойство химического элемента- его атомный вес.
С возрастанием атомного веса 1)металлические свойства постепенно ослабевают (Na Mg Al Si), а неметаллические усиливаются (Si, P, S, Cl) и обрываются у инертного газа (Ar); 2)валентность в высших оксидах возрастает от 1-го до 7-и; 3)валентность в летучих водородных соединениях уменьшается от 4-х до 1-го; 4)свойства химических элементов повторяются периодически (через 7 на 8-ой). В основу периодического закона Д. И. Менделеев взял коренное свойство химического элемента- его атомный вес.
Cлайд 22
 Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов Д. И. Менделеев сформулировал периодический закон так:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов Д. И. Менделеев сформулировал периодический закон так:
Cлайд 23
 Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически? Почему в некоторых случаях (Ar –K, Co-Ni, Te-I) расположены не по возрастанию Ar? Д. И. Менделеев предполагал, что вопросы будут решены при выявлении сложной структуры атома. Возникают вопросы:
Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически? Почему в некоторых случаях (Ar –K, Co-Ni, Te-I) расположены не по возрастанию Ar? Д. И. Менделеев предполагал, что вопросы будут решены при выявлении сложной структуры атома. Возникают вопросы: