X
Код презентации скопируйте его
Основания органические и неорганические
Скачать эту презентациюПрезентация на тему Основания органические и неорганические
Скачать эту презентациюCлайд 4
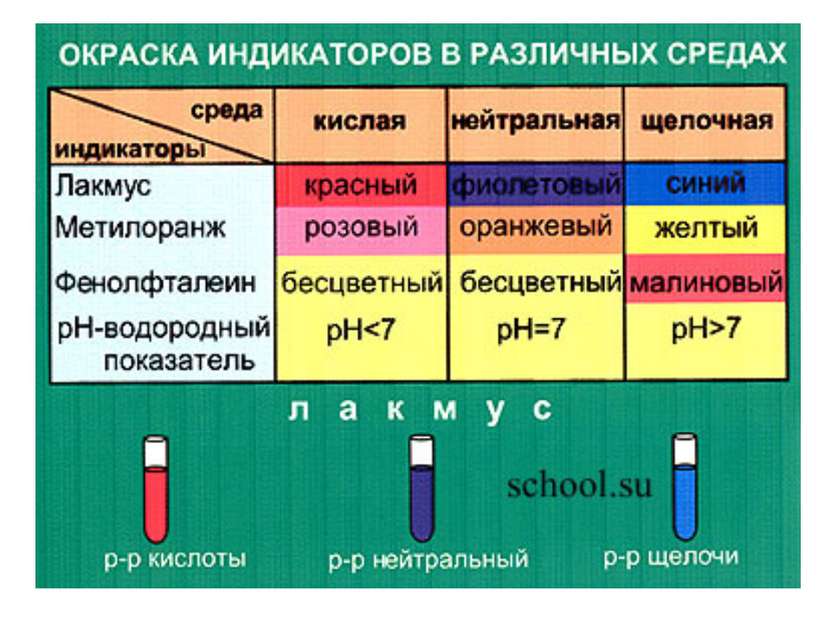
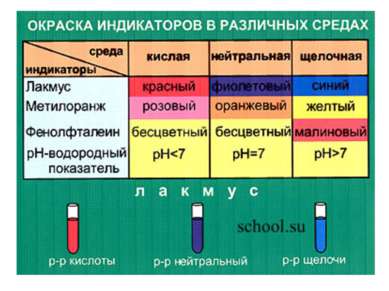
 Исследовательская работа Определите с помощью индикатора (лакмуса, фенолфталеина или метилового оранжевого) в какой пробирке находится основание. Для этого капните по 2 капли индикатора в каждую пробирку и по полученному цвету определите в какой пробирке основание
Исследовательская работа Определите с помощью индикатора (лакмуса, фенолфталеина или метилового оранжевого) в какой пробирке находится основание. Для этого капните по 2 капли индикатора в каждую пробирку и по полученному цвету определите в какой пробирке основание
Cлайд 6
 Определение Ba(OH)2 CH3NH2 NaOH Al(OH)3 NH3 Основания – это молекулы или ионы, которые служат акцепторами катионов водорода (Н+).
Определение Ba(OH)2 CH3NH2 NaOH Al(OH)3 NH3 Основания – это молекулы или ионы, которые служат акцепторами катионов водорода (Н+).
Cлайд 7
 Признаки классификации оснований Растворимость Наличие кислорода Кислотность Степень ЭД Летучесть Стабильность
Признаки классификации оснований Растворимость Наличие кислорода Кислотность Степень ЭД Летучесть Стабильность
Cлайд 8
 Свойства оснований Физические: Растворимые основания – бесцветный раствор Нерастворимые основания – цветные осадки Химические: Изменение окраски индикаторов Взаимодействие с кислотами Взаимодействие с кислотными оксидами Взаимодействие с солями Разложение нерастворимых оснований при нагревании
Свойства оснований Физические: Растворимые основания – бесцветный раствор Нерастворимые основания – цветные осадки Химические: Изменение окраски индикаторов Взаимодействие с кислотами Взаимодействие с кислотными оксидами Взаимодействие с солями Разложение нерастворимых оснований при нагревании
Cлайд 11
 Свойства оснований Физические: Растворимые основания – бесцветный раствор Нерастворимые основания – цветные осадки Химические: Изменение окраски индикаторов Взаимодействие с кислотами Взаимодействие с кислотными оксидами Взаимодействие с солями Разложение нерастворимых оснований при нагревании
Свойства оснований Физические: Растворимые основания – бесцветный раствор Нерастворимые основания – цветные осадки Химические: Изменение окраски индикаторов Взаимодействие с кислотами Взаимодействие с кислотными оксидами Взаимодействие с солями Разложение нерастворимых оснований при нагревании
Cлайд 12
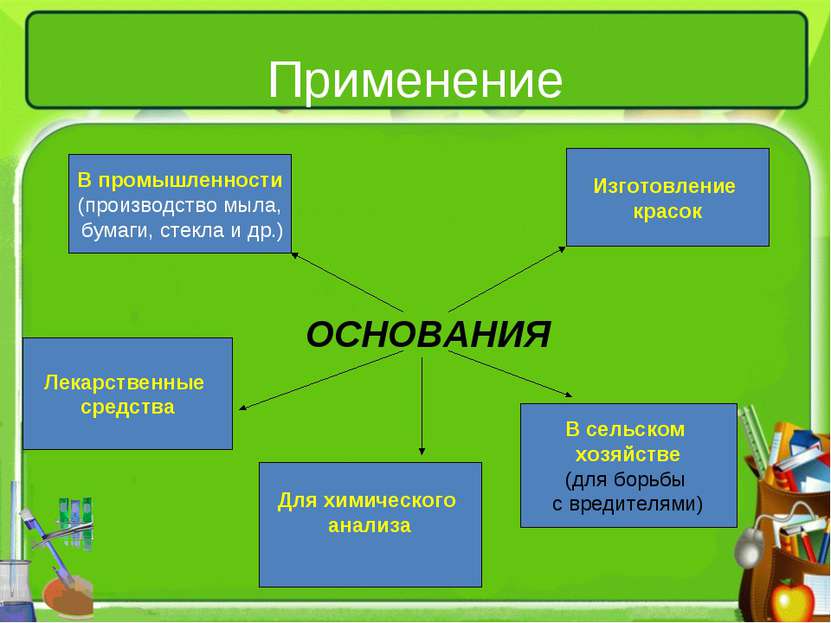
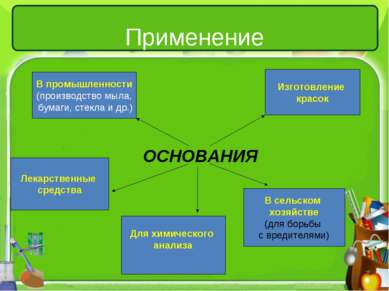 Применение ОСНОВАНИЯ В промышленности (производство мыла, бумаги, стекла и др.) Изготовление красок Лекарственные средства В сельском хозяйстве (для борьбы с вредителями) Для химического анализа
Применение ОСНОВАНИЯ В промышленности (производство мыла, бумаги, стекла и др.) Изготовление красок Лекарственные средства В сельском хозяйстве (для борьбы с вредителями) Для химического анализа
Cлайд 13
 Закрепление Задание №1. Дайте классификационную характеристику Ba(OH)2. Задание №2. Запишите уравнения реакций, подтверждающих его основные свойства. **Задача №7 (стр.258 учебника).
Закрепление Задание №1. Дайте классификационную характеристику Ba(OH)2. Задание №2. Запишите уравнения реакций, подтверждающих его основные свойства. **Задача №7 (стр.258 учебника).
Cлайд 14
 Домашнее задание стр.251-257 (п.21) Дайте классификационную характеристику и запишите уравнения реакций, подтверждающих основные свойства Со(ОН)2. * Напишите уравнения возможных реакций в молекулярном и ионном виде гидроксида натрия с: SO2, Zn(OH)2, FeO, Fe(NO3)2, CH3Cl, HI, BaCl2. ** Задача: При сжигании 1,4г органического вещества образовалось 1,8г воды, 4,4г оксида углерода(4). Выведите молекулярную формулу вещества, зная, что его относительная плотность по воздуху равна 0,97.
Домашнее задание стр.251-257 (п.21) Дайте классификационную характеристику и запишите уравнения реакций, подтверждающих основные свойства Со(ОН)2. * Напишите уравнения возможных реакций в молекулярном и ионном виде гидроксида натрия с: SO2, Zn(OH)2, FeO, Fe(NO3)2, CH3Cl, HI, BaCl2. ** Задача: При сжигании 1,4г органического вещества образовалось 1,8г воды, 4,4г оксида углерода(4). Выведите молекулярную формулу вещества, зная, что его относительная плотность по воздуху равна 0,97.