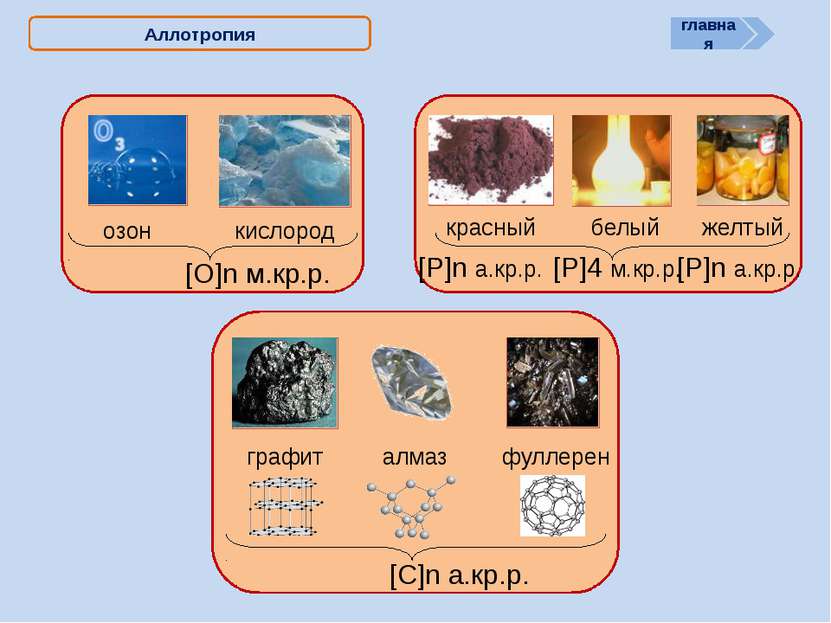
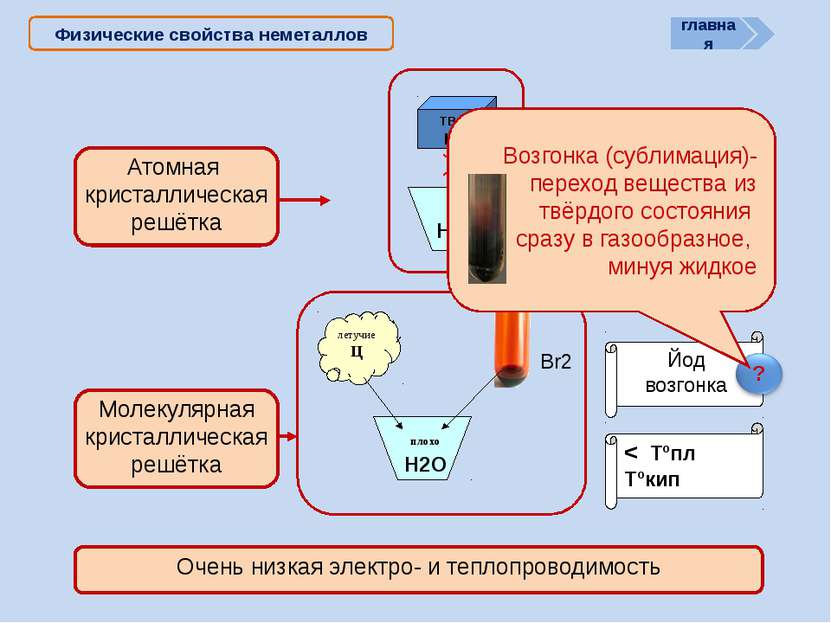
X
Код презентации скопируйте его
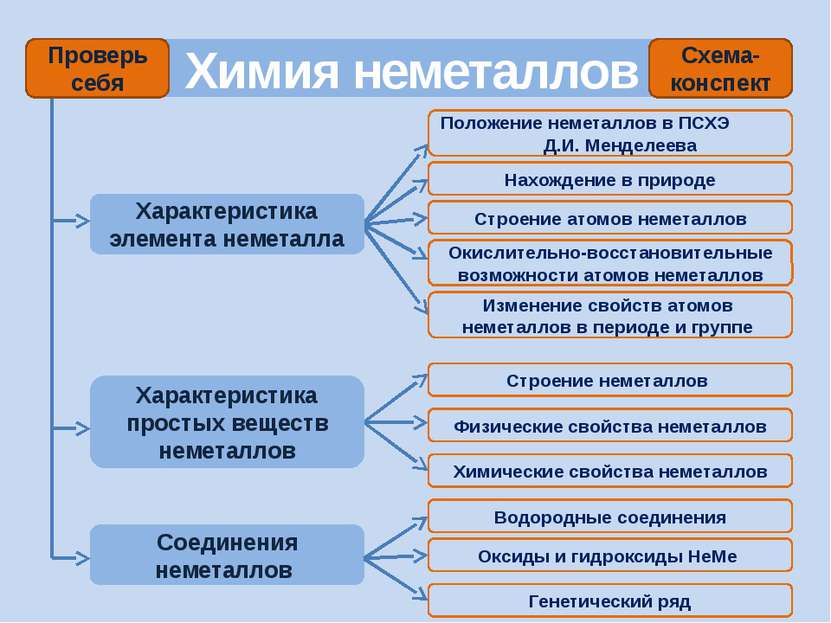
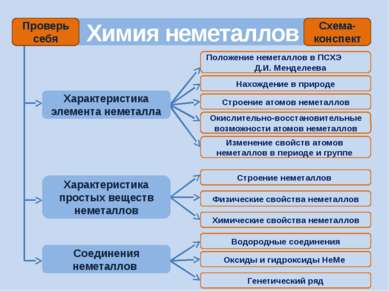
Химия неметаллов
Скачать эту презентациюПрезентация на тему Химия неметаллов
Скачать эту презентациюCлайд 2
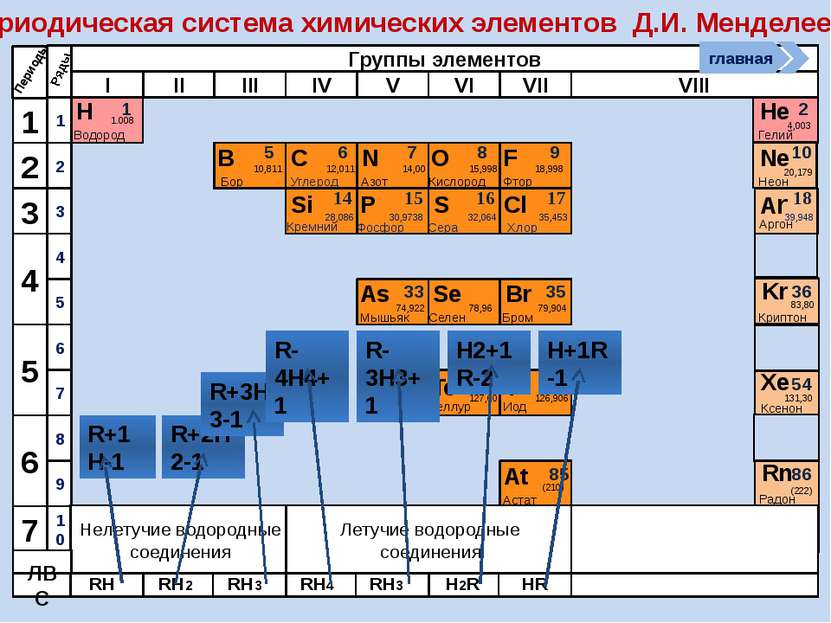
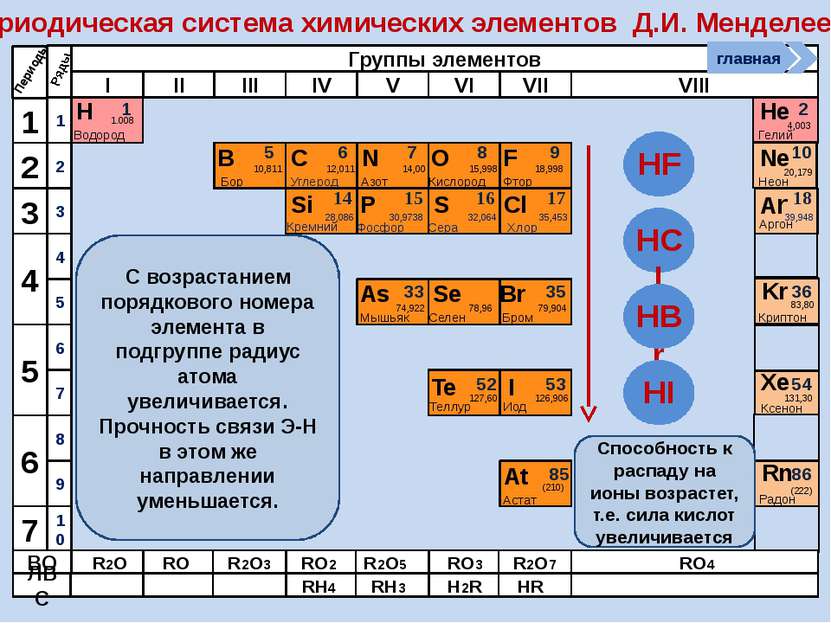
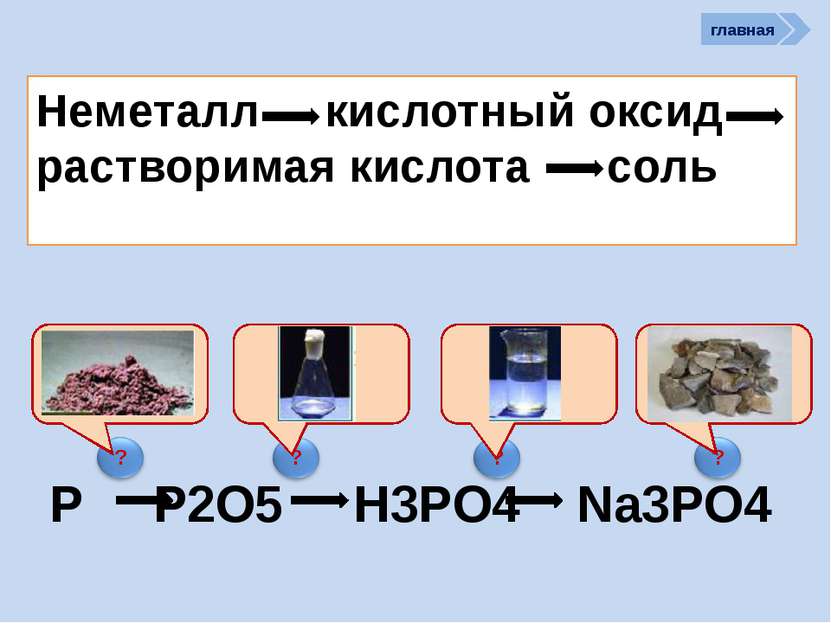
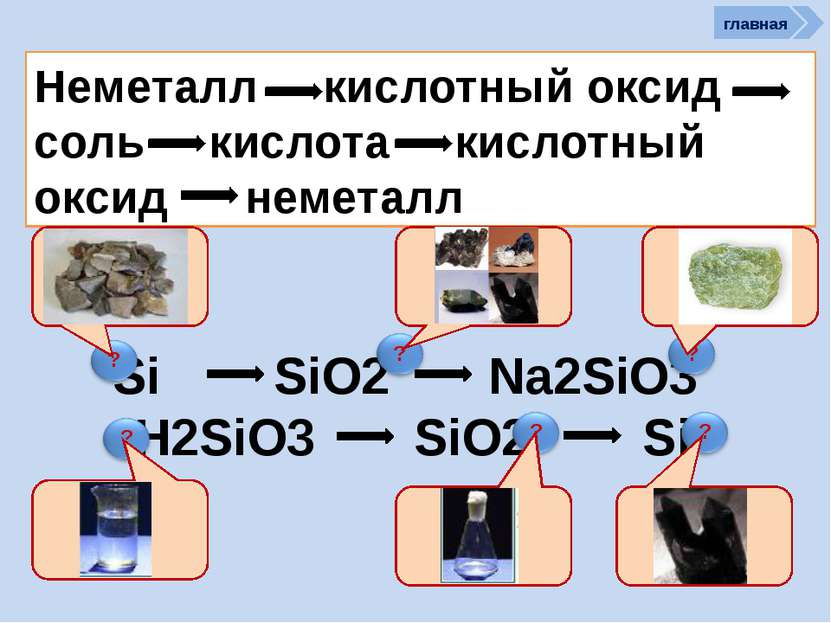
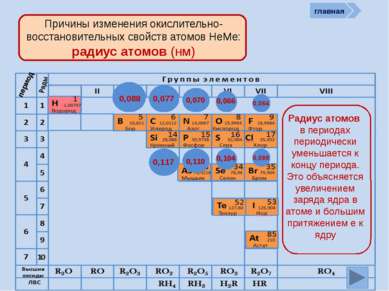
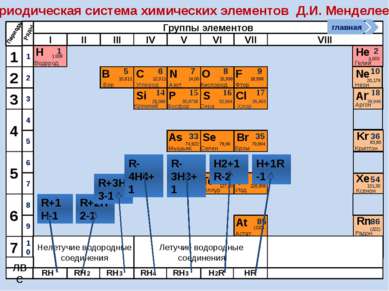
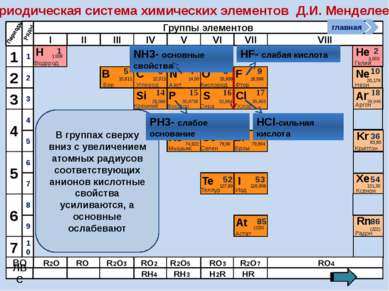
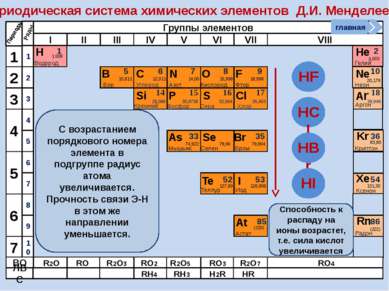
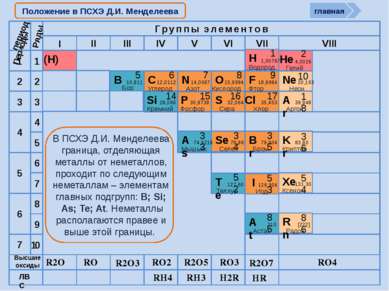
 R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Высшие оксиды ЛВС Положение в ПСХЭ Д.И. Менделеева период Периоды Kr 83,80 Криптон 36 Xe 131,30 Ксенон 54 Rn [222] Радон 86 Br 79,904 Бром 35 Н 1,00797 Водород 1 I 126,904 Иод 53 Se 78,96 Селен 34 At 210 Астат 85 Te 127,60 Теллур 52 As 74,9216 Мышьяк 33 В ПСХЭ Д.И. Менделеева граница, отделяющая металлы от неметаллов, проходит по следующим неметаллам – элементам главных подгрупп: B; Si; As; Te; At. Неметаллы располагаются правее и выше этой границы. главная
R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Высшие оксиды ЛВС Положение в ПСХЭ Д.И. Менделеева период Периоды Kr 83,80 Криптон 36 Xe 131,30 Ксенон 54 Rn [222] Радон 86 Br 79,904 Бром 35 Н 1,00797 Водород 1 I 126,904 Иод 53 Se 78,96 Селен 34 At 210 Астат 85 Te 127,60 Теллур 52 As 74,9216 Мышьяк 33 В ПСХЭ Д.И. Менделеева граница, отделяющая металлы от неметаллов, проходит по следующим неметаллам – элементам главных подгрупп: B; Si; As; Te; At. Неметаллы располагаются правее и выше этой границы. главная
Cлайд 3
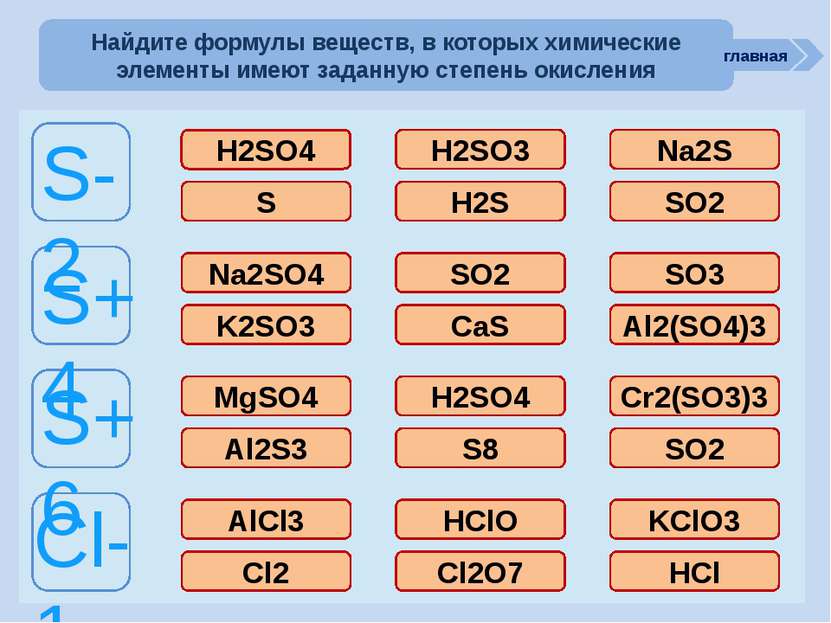
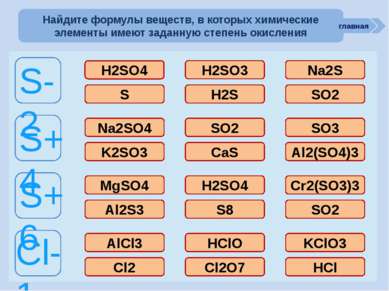
 ошибка ошибка ошибка молодец молодец ошибка ошибка молодец молодец ошибка ошибка ошибка молодец ошибка молодец ошибка ошибка ошибка молодец ошибка ошибка ошибка ошибка молодец S-2 S+4 S+6 Cl-1 H2SO4 H2SO3 Na2S S H2S SO2 Na2SO4 SO2 SO3 K2SO3 CaS Al2(SO4)3 MgSO4 H2SO4 Cr2(SO3)3 Al2S3 S8 SO2 AlCl3 HClO KClO3 Cl2 Cl2O7 HCl Найдите формулы веществ, в которых химические элементы имеют заданную степень окисления главная
ошибка ошибка ошибка молодец молодец ошибка ошибка молодец молодец ошибка ошибка ошибка молодец ошибка молодец ошибка ошибка ошибка молодец ошибка ошибка ошибка ошибка молодец S-2 S+4 S+6 Cl-1 H2SO4 H2SO3 Na2S S H2S SO2 Na2SO4 SO2 SO3 K2SO3 CaS Al2(SO4)3 MgSO4 H2SO4 Cr2(SO3)3 Al2S3 S8 SO2 AlCl3 HClO KClO3 Cl2 Cl2O7 HCl Найдите формулы веществ, в которых химические элементы имеют заданную степень окисления главная
Cлайд 4
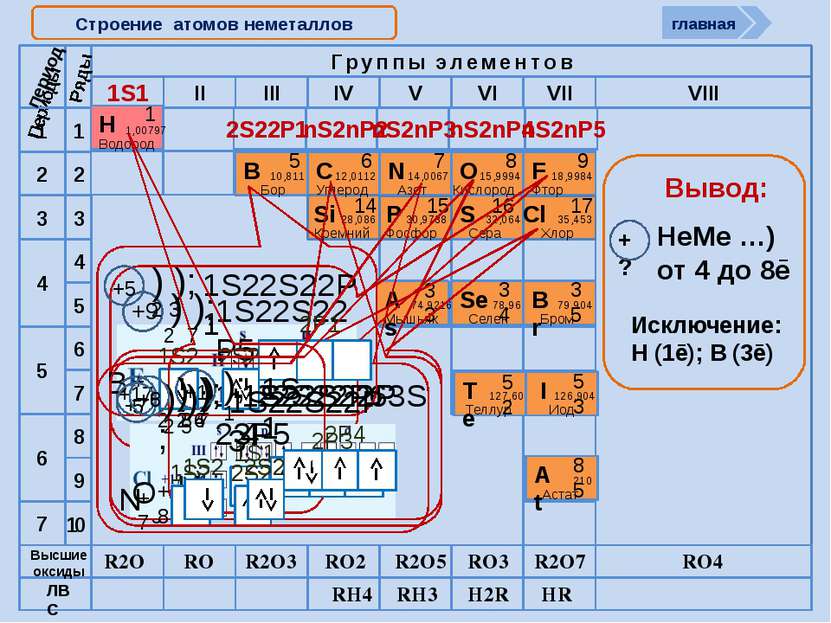
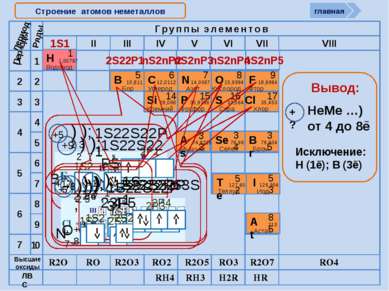
 Cтроение атомов неметаллов 1S1 2S22P1 nS2nP2 nS2nP3 nS2nP4 nS2nP5 период R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Высшие оксиды ЛВС +9 ) ); 2 7 1S22S22P5 +6 ) ); 1S22S22P2 C +6 2 4 +17 ) ) ); 1S22S22P63S23P5 2 8 7 +5 ) ); 1S22S22P1 В +5 2 3 +1 ); 1S1 Н +1 1 главная
Cтроение атомов неметаллов 1S1 2S22P1 nS2nP2 nS2nP3 nS2nP4 nS2nP5 период R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Высшие оксиды ЛВС +9 ) ); 2 7 1S22S22P5 +6 ) ); 1S22S22P2 C +6 2 4 +17 ) ) ); 1S22S22P63S23P5 2 8 7 +5 ) ); 1S22S22P1 В +5 2 3 +1 ); 1S1 Н +1 1 главная
Cлайд 5
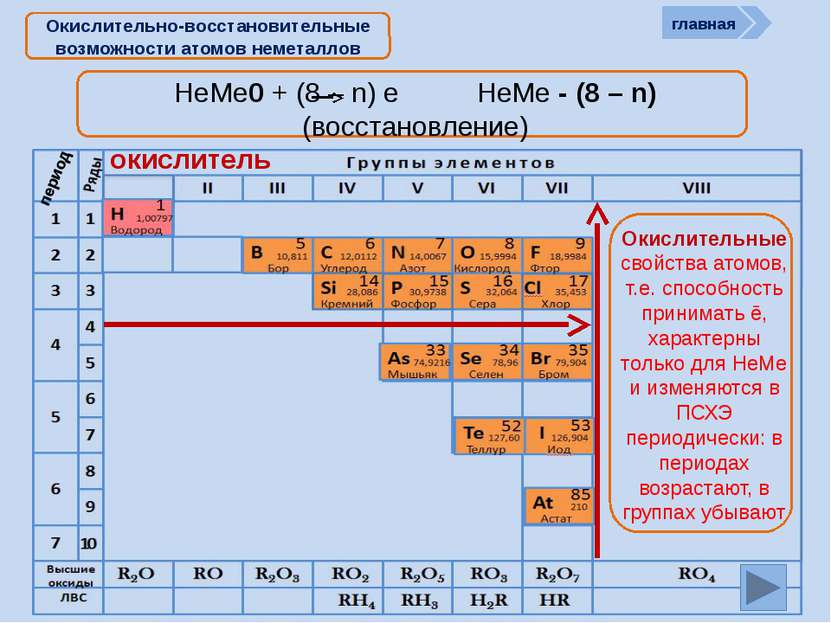
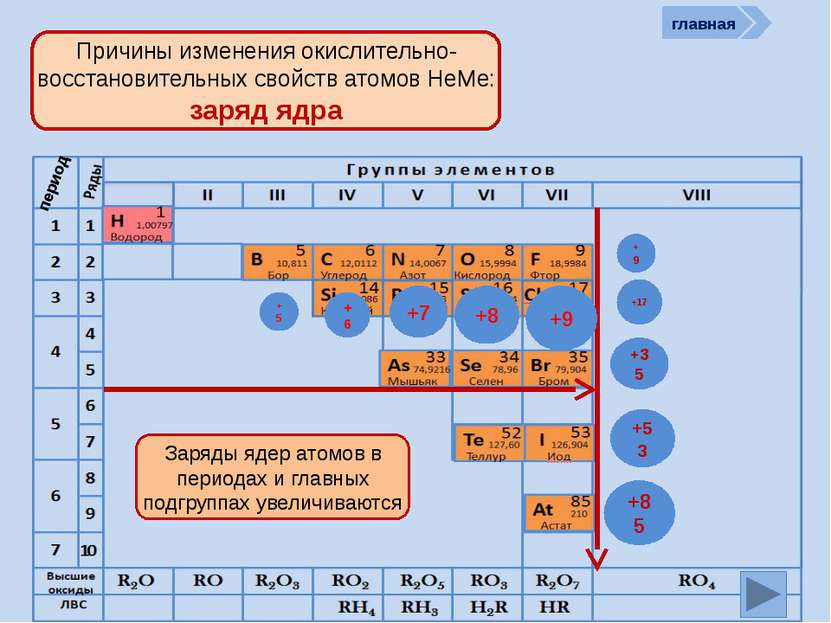
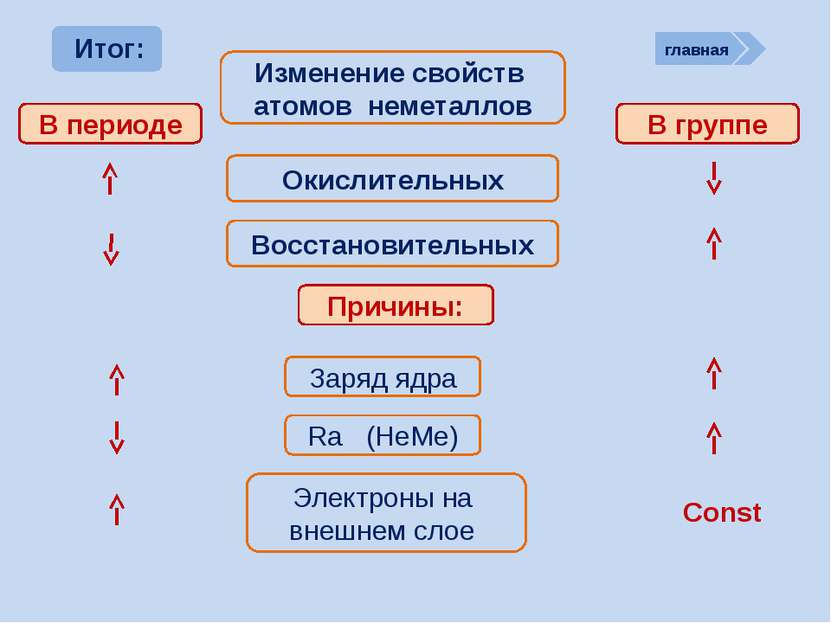
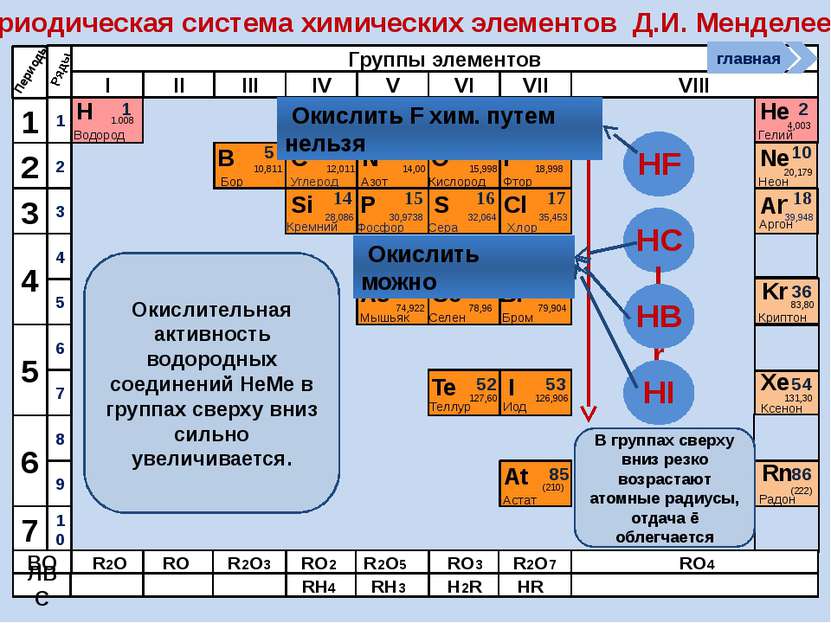
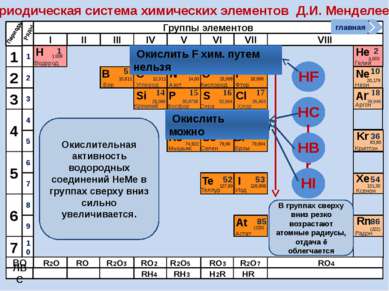
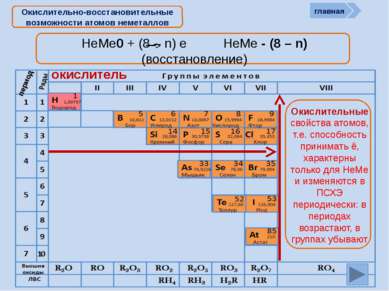
 Окислительно-восстановительные возможности атомов неметаллов НеМе0 + (8 – n) e НеМе - (8 – n) (восстановление) окислитель главная период Окислительные свойства атомов, т.е. способность принимать ē, характерны только для НеМе и изменяются в ПСХЭ периодически: в периодах возрастают, в группах убывают
Окислительно-восстановительные возможности атомов неметаллов НеМе0 + (8 – n) e НеМе - (8 – n) (восстановление) окислитель главная период Окислительные свойства атомов, т.е. способность принимать ē, характерны только для НеМе и изменяются в ПСХЭ периодически: в периодах возрастают, в группах убывают
Cлайд 7
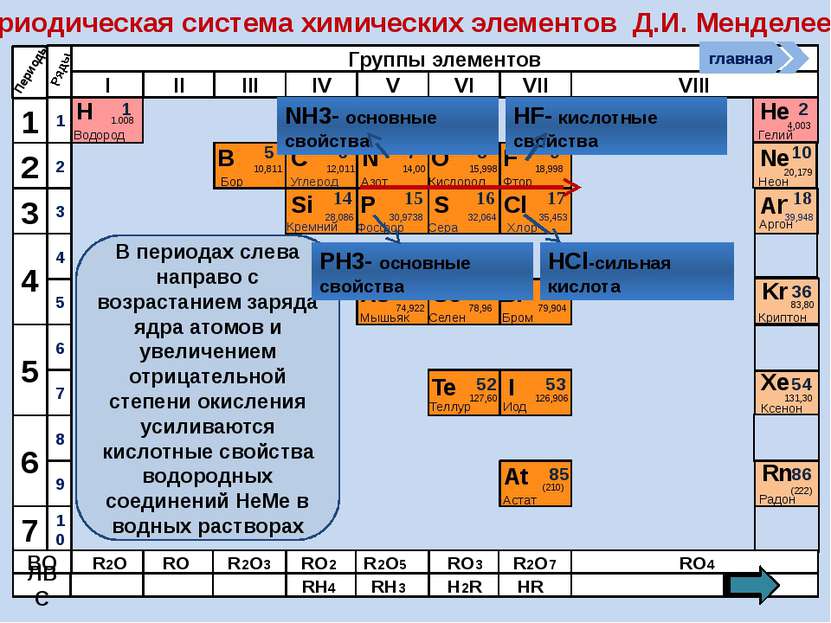
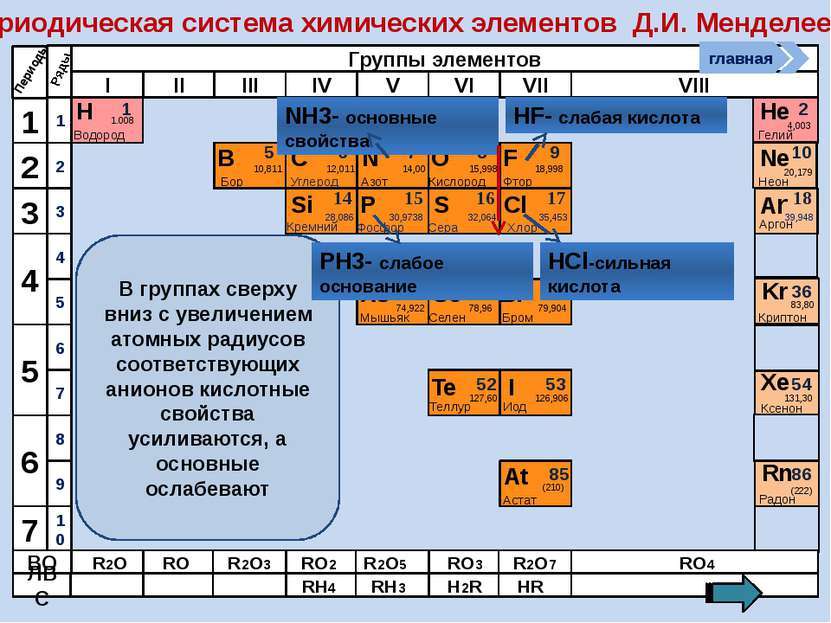
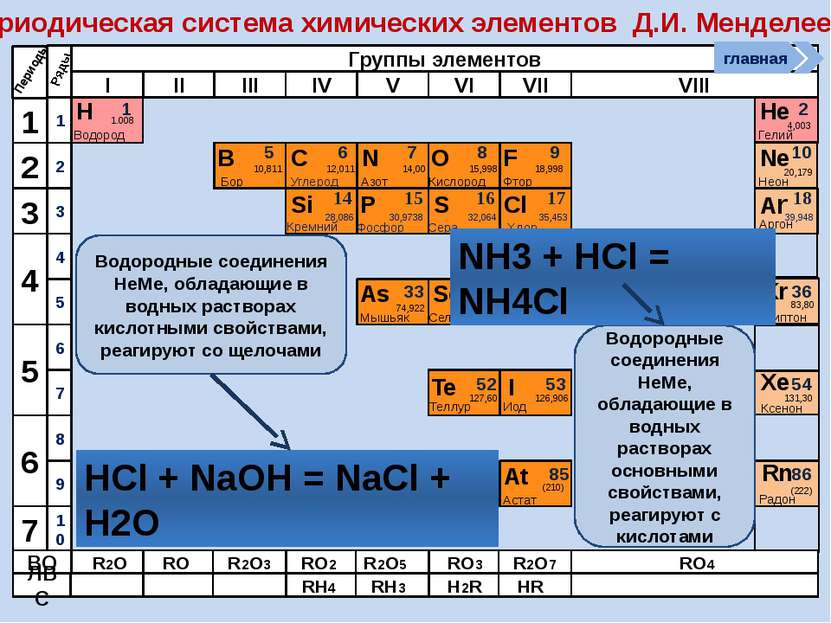
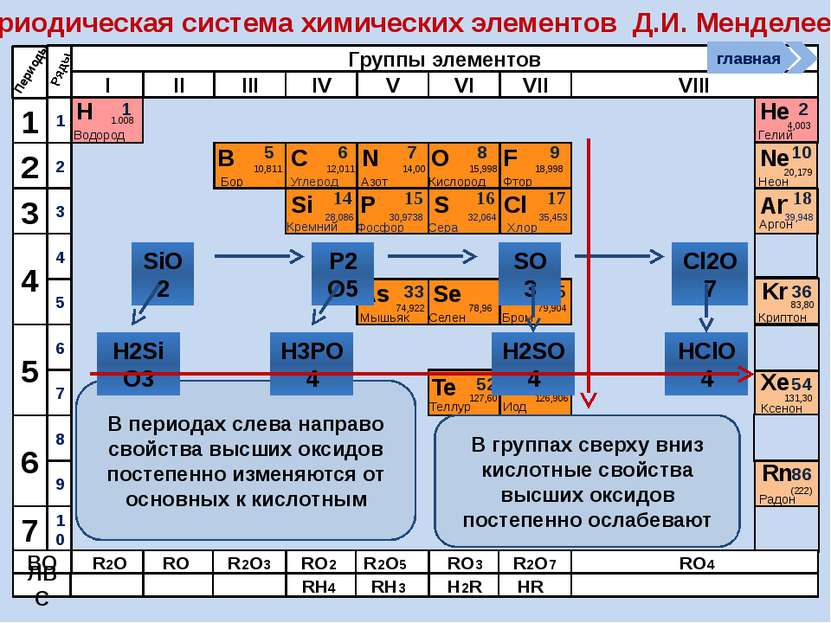
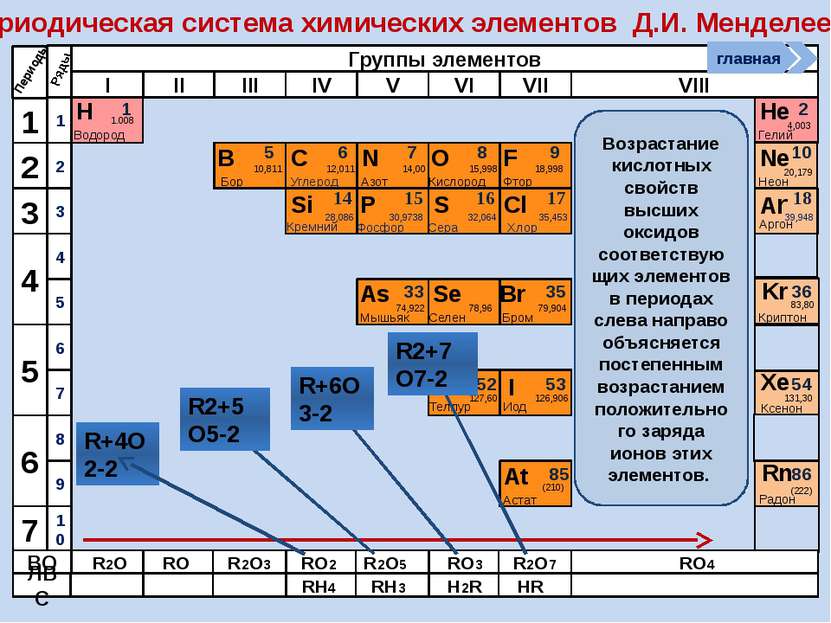
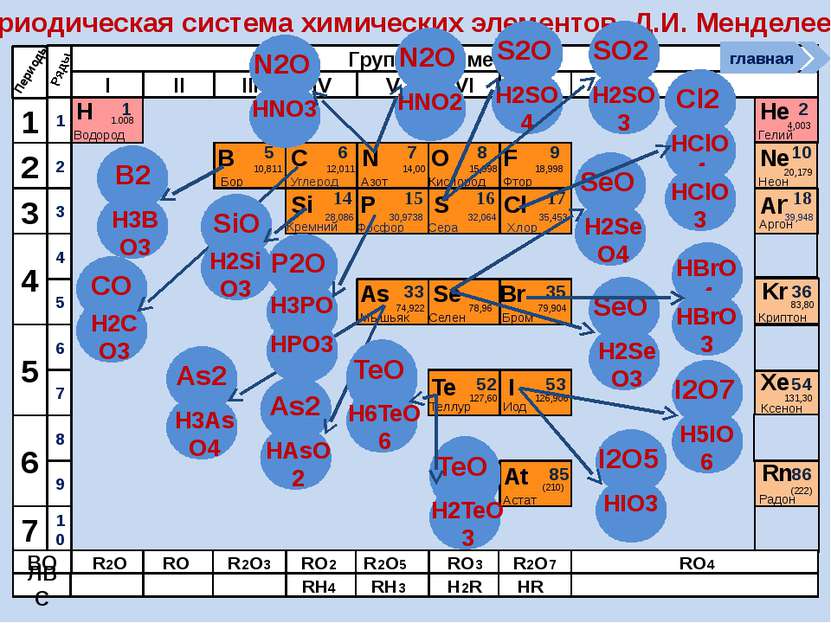
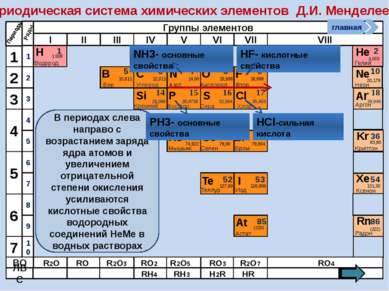
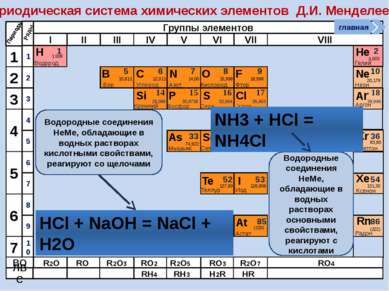
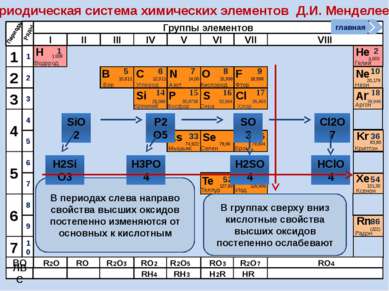
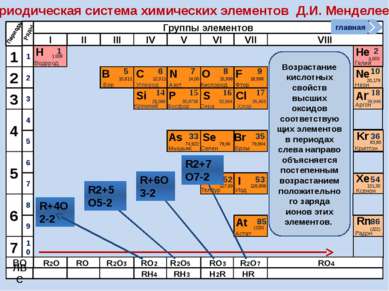
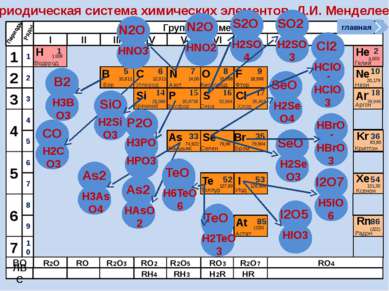
 Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He Se Te F Br I At Ne Kr Xe Rn Бор Углерод Азот Мышьяк Селен Теллур Фтор Бром Иод Астат Криптон Ксенон Радон 5 6 7 9 2 10 ВО ЛВС 33 35 36 52 53 54 85 86 10,811 12,011 14,00 74,922 15,998 78,96 127,60 18,998 79,904 126,906 (210) 4,003 20,179 83,80 131,30 (222) Гелий Неон R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов. R+4O2-2 R2+5O5-2 R+6O3-2 R2+7O7-2 Группы элементов I II III IV V VI VII VIII Si 14 28,086 Кремний Р 15 30,9738 Фосфор S 16 32,064 Сера Cl 17 35,453 Хлор Ar 18 39,948 Аргон 1 2 3 4 7 5 6 1 2 3 10 4 5 6 7 8 9 Ряды O Кислород 8 главная
Периодическая система химических элементов Д.И. Менделеева Н Водород 1 1.008 Периоды B C N As He Se Te F Br I At Ne Kr Xe Rn Бор Углерод Азот Мышьяк Селен Теллур Фтор Бром Иод Астат Криптон Ксенон Радон 5 6 7 9 2 10 ВО ЛВС 33 35 36 52 53 54 85 86 10,811 12,011 14,00 74,922 15,998 78,96 127,60 18,998 79,904 126,906 (210) 4,003 20,179 83,80 131,30 (222) Гелий Неон R2O RO R2O3 RO2 R2O5 RO3 R2O7 RO4 RH4 RH3 H2R HR Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов. R+4O2-2 R2+5O5-2 R+6O3-2 R2+7O7-2 Группы элементов I II III IV V VI VII VIII Si 14 28,086 Кремний Р 15 30,9738 Фосфор S 16 32,064 Сера Cl 17 35,453 Хлор Ar 18 39,948 Аргон 1 2 3 4 7 5 6 1 2 3 10 4 5 6 7 8 9 Ряды O Кислород 8 главная
Cлайд 8
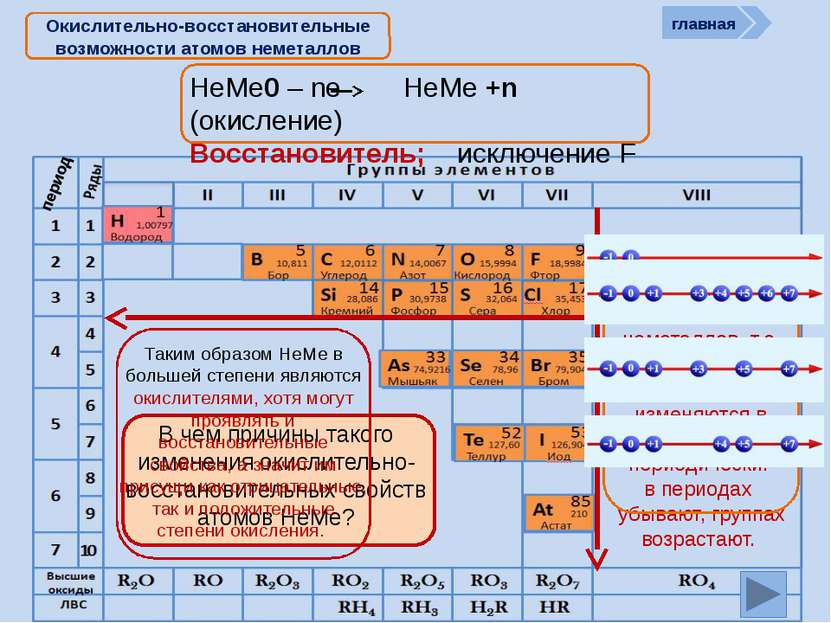
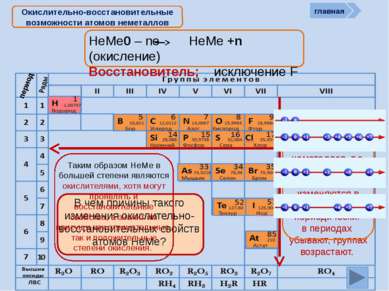 НеМе0 – ne НеМе +n (окисление) Восстановитель; исключение F Окислительно-восстановительные возможности атомов неметаллов главная период Восстановительные свойства атомов неметаллов, т.е. способность отдавать ē, изменяются в ПСХЭ периодически: в периодах убывают, группах возрастают. В чем причины такого изменения окислительно-восстановительных свойств атомов НеМе? Таким образом НеМе в большей степени являются окислителями, хотя могут проявлять и восстановительные свойства, а значит им присущи как отрицательные, так и положительные степени окисления.
НеМе0 – ne НеМе +n (окисление) Восстановитель; исключение F Окислительно-восстановительные возможности атомов неметаллов главная период Восстановительные свойства атомов неметаллов, т.е. способность отдавать ē, изменяются в ПСХЭ периодически: в периодах убывают, группах возрастают. В чем причины такого изменения окислительно-восстановительных свойств атомов НеМе? Таким образом НеМе в большей степени являются окислителями, хотя могут проявлять и восстановительные свойства, а значит им присущи как отрицательные, так и положительные степени окисления.
Cлайд 10
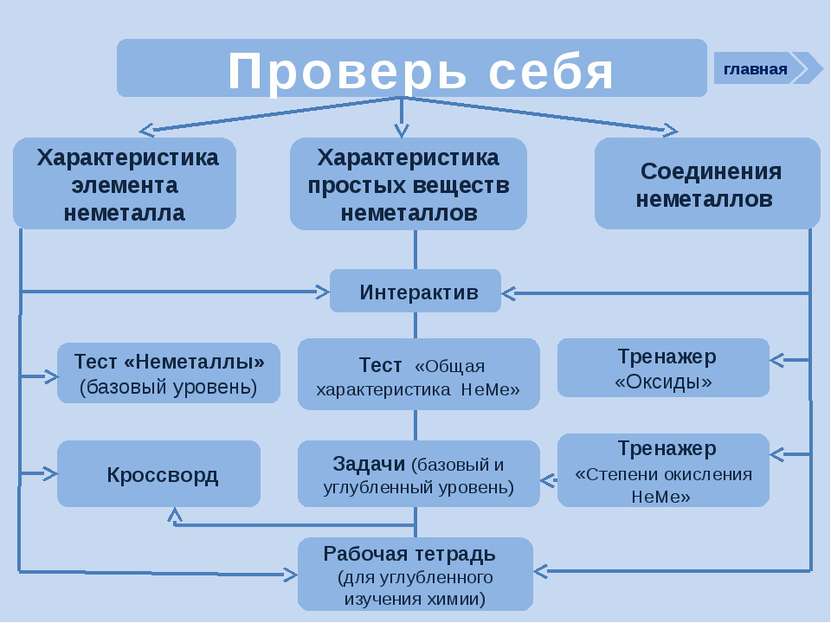
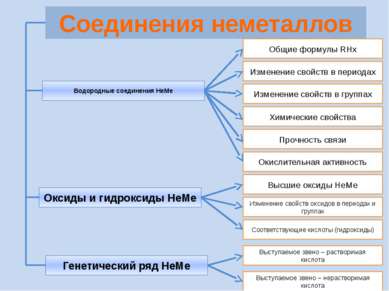
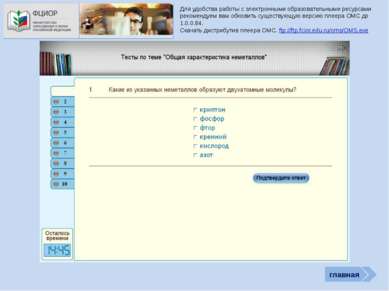
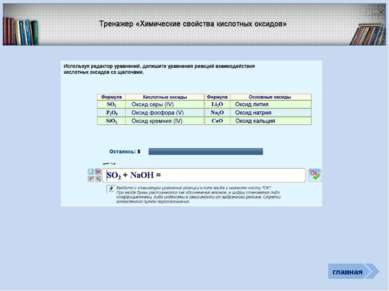
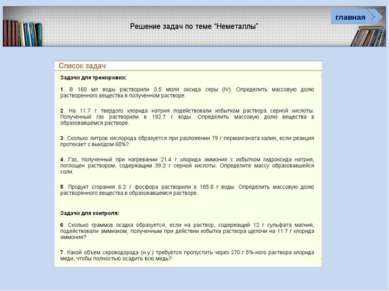
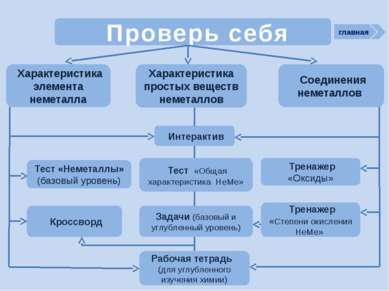
 Проверь себя Характеристика простых веществ неметаллов Характеристика элемента неметалла Тест «Неметаллы» (базовый уровень) Соединения неметаллов Тренажер «Оксиды» Тренажер «Степени окисления НеМе» Интерактив Тест «Общая характеристика НеМе» Рабочая тетрадь (для углубленного изучения химии) Задачи (базовый и углубленный уровень) Кроссворд главная
Проверь себя Характеристика простых веществ неметаллов Характеристика элемента неметалла Тест «Неметаллы» (базовый уровень) Соединения неметаллов Тренажер «Оксиды» Тренажер «Степени окисления НеМе» Интерактив Тест «Общая характеристика НеМе» Рабочая тетрадь (для углубленного изучения химии) Задачи (базовый и углубленный уровень) Кроссворд главная
Cлайд 11
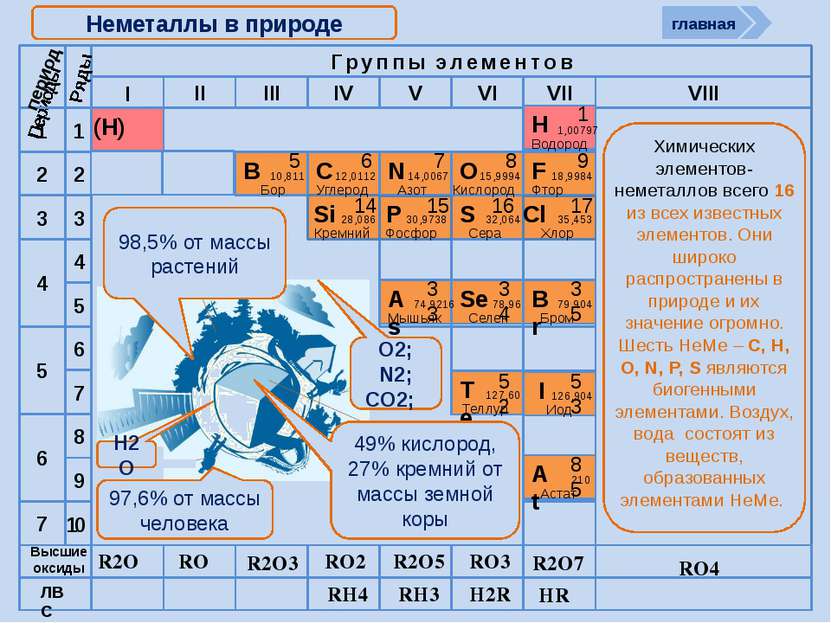
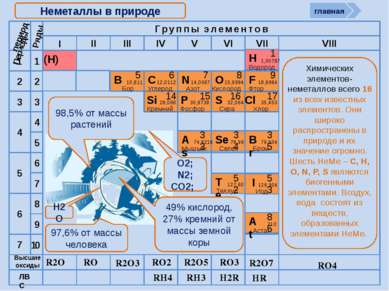
 R2O RO R2O3 RO2 R2O5 RO3 R2O7 RH4 RH3 H2R HR Высшие оксиды ЛВС Неметаллы в природе 98,5% от массы растений 97,6% от массы человека 49% кислород, 27% кремний от массы земной коры O2; N2; CO2; Н2О период Периоды Br 79,904 Бром 35 Н 1,00797 Водород 1 I 126,904 Иод 53 Se 78,96 Селен 34 At 210 Астат 85 Te 127,60 Теллур 52 As 74,9216 Мышьяк 33 RO4 Химических элементов-неметаллов всего 16 из всех известных элементов. Они широко распространены в природе и их значение огромно. Шесть НеМе – С, Н, О, N, P, S являются биогенными элементами. Воздух, вода состоят из веществ, образованных элементами НеМе. главная
R2O RO R2O3 RO2 R2O5 RO3 R2O7 RH4 RH3 H2R HR Высшие оксиды ЛВС Неметаллы в природе 98,5% от массы растений 97,6% от массы человека 49% кислород, 27% кремний от массы земной коры O2; N2; CO2; Н2О период Периоды Br 79,904 Бром 35 Н 1,00797 Водород 1 I 126,904 Иод 53 Se 78,96 Селен 34 At 210 Астат 85 Te 127,60 Теллур 52 As 74,9216 Мышьяк 33 RO4 Химических элементов-неметаллов всего 16 из всех известных элементов. Они широко распространены в природе и их значение огромно. Шесть НеМе – С, Н, О, N, P, S являются биогенными элементами. Воздух, вода состоят из веществ, образованных элементами НеМе. главная
Cлайд 12
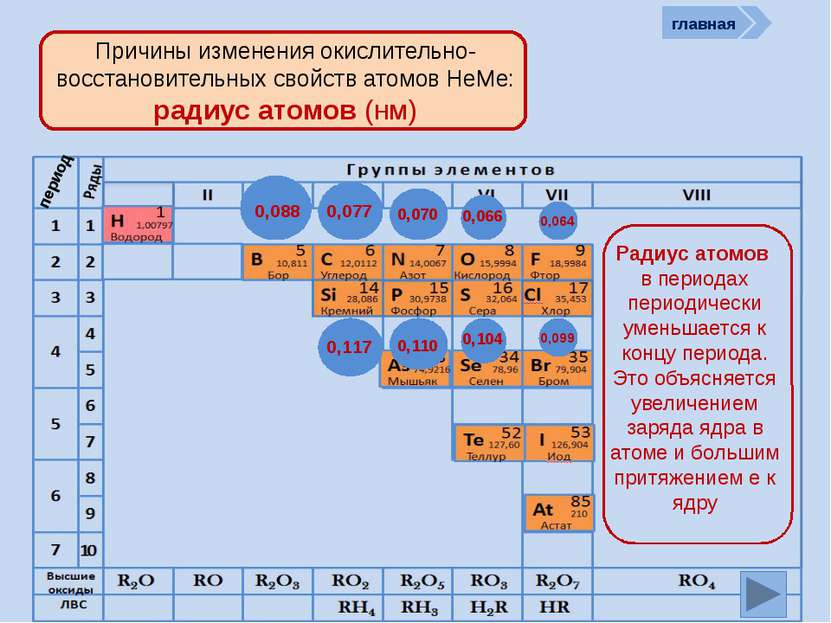
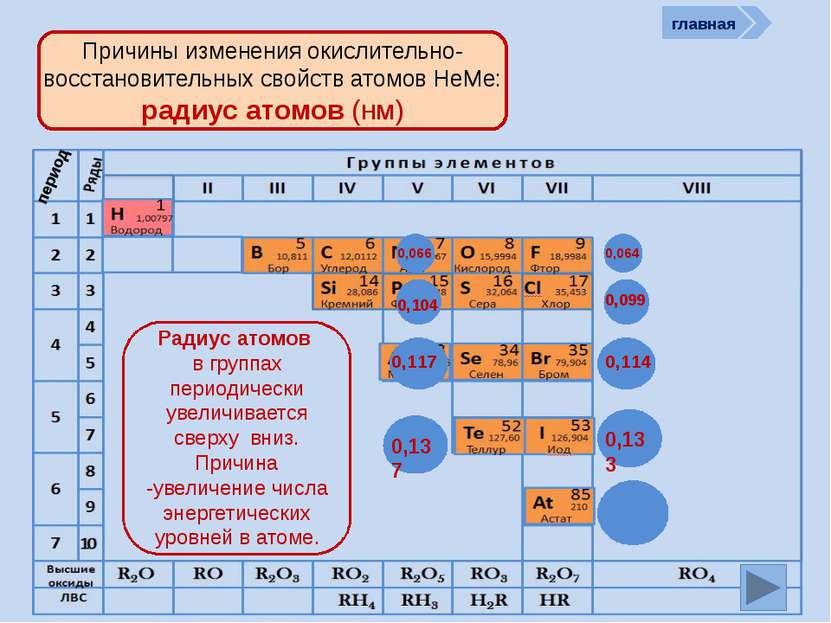
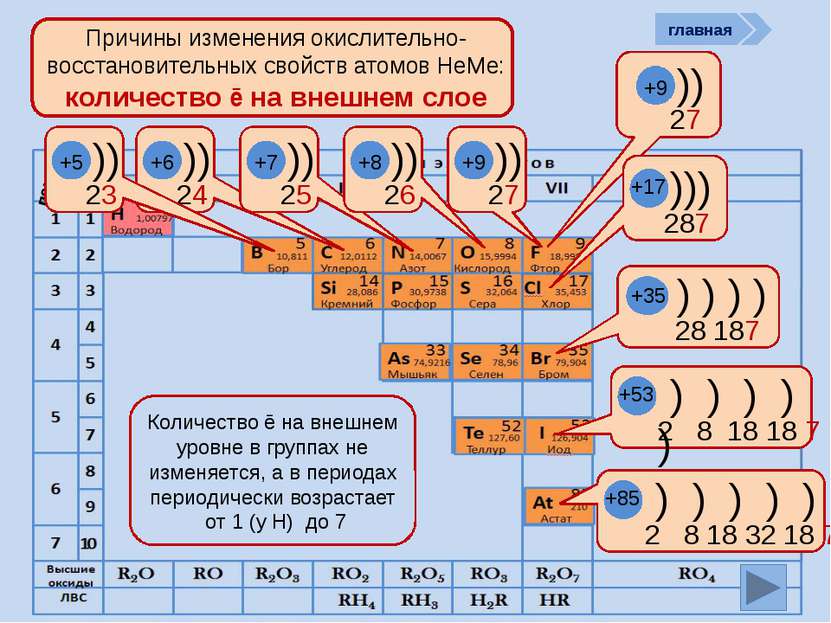
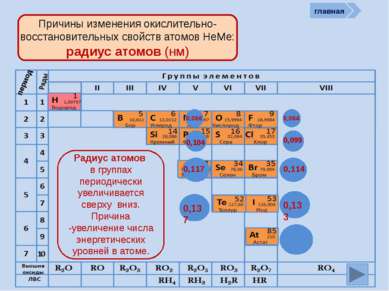
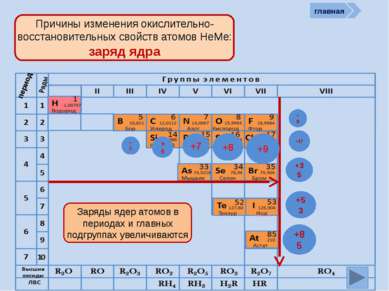
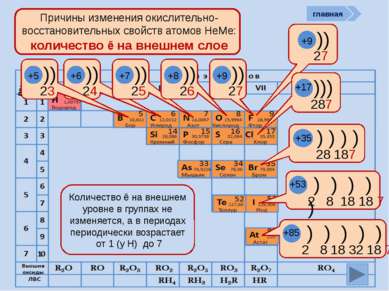 период Причины изменения окислительно-восстановительных свойств атомов НеМе: количество ē на внешнем слое )) 27 +9 ))) 287 +17 ) ) ) ) 28 187 +35 ) ) ) ) ) 2 8 18 18 7 +53 ) ) ) ) ) ) 2 8 18 32 18 7 +85 Количество ē на внешнем уровне в группах не изменяется, а в периодах периодически возрастает от 1 (у Н) до 7 )) 24 +6 )) 25 +7 )) 26 +8 )) 27 +9 главная )) 23 +5
период Причины изменения окислительно-восстановительных свойств атомов НеМе: количество ē на внешнем слое )) 27 +9 ))) 287 +17 ) ) ) ) 28 187 +35 ) ) ) ) ) 2 8 18 18 7 +53 ) ) ) ) ) ) 2 8 18 32 18 7 +85 Количество ē на внешнем уровне в группах не изменяется, а в периодах периодически возрастает от 1 (у Н) до 7 )) 24 +6 )) 25 +7 )) 26 +8 )) 27 +9 главная )) 23 +5
Cлайд 13
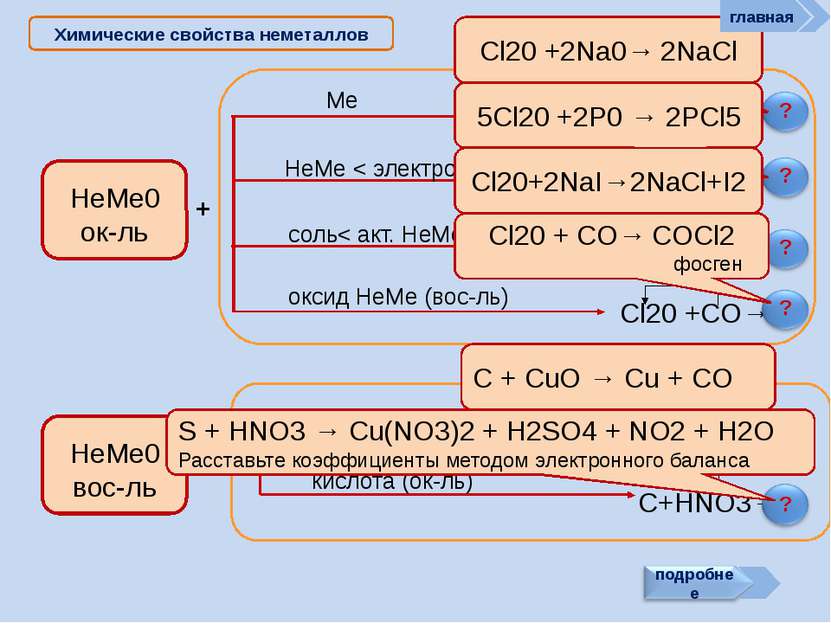
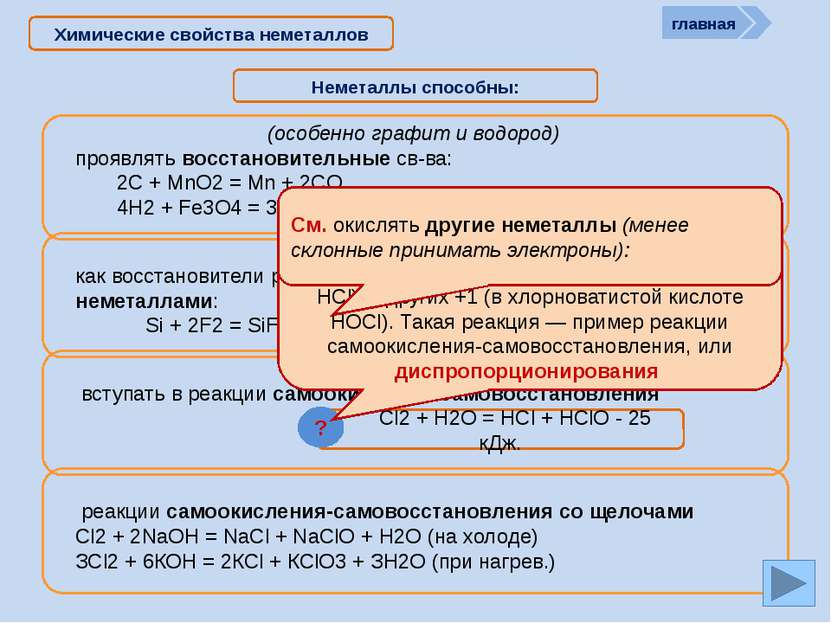
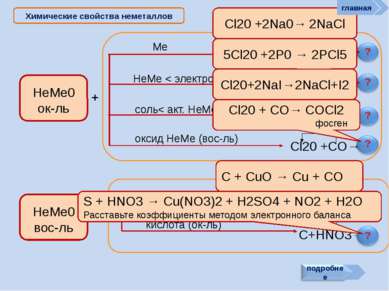
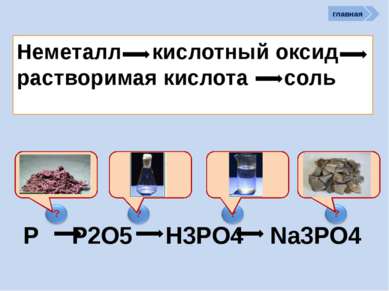
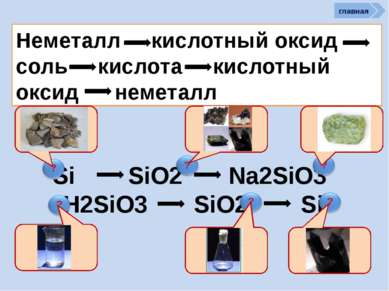
 ? Химические свойства неметаллов Неметаллы способны: Сl2 + Н2О = НСl + НСlO - 25 кДж. ? Хлор в левой части уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала -1 (в НСl), у других +1 (в хлорноватистой кислоте НОСl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования См. окислять другие неметаллы (менее склонные принимать электроны): главная как восстановители реагировать с более электротрицательными неметаллами: Si + 2F2 = SiF4 C + O2 = CO2 C + 2S = CS2 (особенно графит и водород) проявлять восстановительные св-ва: 2С + MnO2 = Mn + 2CO 4H2 + Fe3O4 = 3Fe + 4H2O вступать в реакции самоокисления-самовосстановления реакции самоокисления-самовосстановления со щелочами Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде) ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагрев.)
? Химические свойства неметаллов Неметаллы способны: Сl2 + Н2О = НСl + НСlO - 25 кДж. ? Хлор в левой части уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала -1 (в НСl), у других +1 (в хлорноватистой кислоте НОСl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования См. окислять другие неметаллы (менее склонные принимать электроны): главная как восстановители реагировать с более электротрицательными неметаллами: Si + 2F2 = SiF4 C + O2 = CO2 C + 2S = CS2 (особенно графит и водород) проявлять восстановительные св-ва: 2С + MnO2 = Mn + 2CO 4H2 + Fe3O4 = 3Fe + 4H2O вступать в реакции самоокисления-самовосстановления реакции самоокисления-самовосстановления со щелочами Сl2 + 2NаОН = NаСl + NаСlO + Н2О (на холоде) ЗСl2 + 6КОН = 2КСl + КClO3 + ЗН2О (при нагрев.)
Cлайд 14
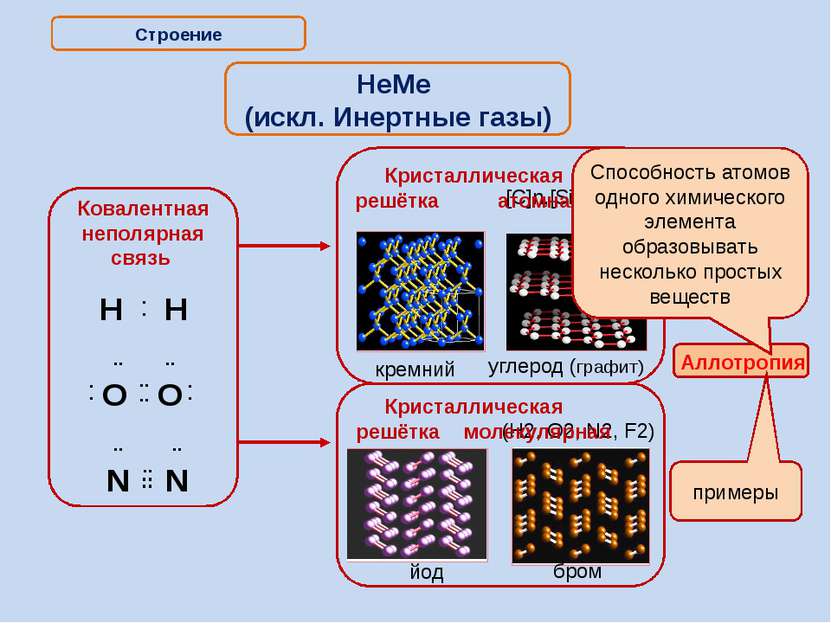
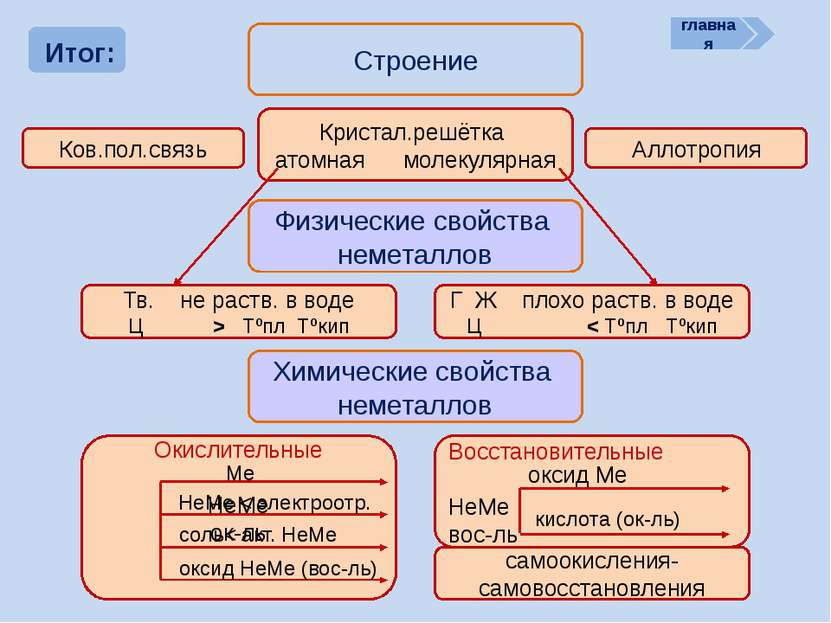
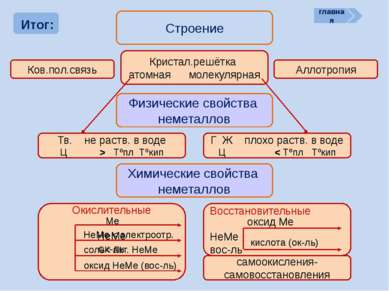
 Итог: Строение Ков.пол.связь Кристал.решётка атомная молекулярная Аллотропия Физические свойства неметаллов Тв. не раств. в воде Ц > Tºпл Tºкип Г Ж плохо раств. в воде Ц < Tºпл Tºкип Химические свойства неметаллов самоокисления-самовосстановления главная Восстановительные НеМе вос-ль оксид Ме Окислительные НеМе ок-ль
Итог: Строение Ков.пол.связь Кристал.решётка атомная молекулярная Аллотропия Физические свойства неметаллов Тв. не раств. в воде Ц > Tºпл Tºкип Г Ж плохо раств. в воде Ц < Tºпл Tºкип Химические свойства неметаллов самоокисления-самовосстановления главная Восстановительные НеМе вос-ль оксид Ме Окислительные НеМе ок-ль