X
Код презентации скопируйте его
Соли, их состав и названия
Скачать эту презентациюПрезентация на тему Соли, их состав и названия
Скачать эту презентациюCлайд 1
 Тема: «Соли, их состав и названия» 8 класс Жданова Надежда Александровна, учитель химии НОУ СОШ «Кристалл» г. Сызрани Самарской области 2010 год
Тема: «Соли, их состав и названия» 8 класс Жданова Надежда Александровна, учитель химии НОУ СОШ «Кристалл» г. Сызрани Самарской области 2010 год
Cлайд 2
 Содержание Состав солей Что такое соли? Алгоритм составления формулы соли бескислородной кислоты Алгоритм составления формулы соли кислородсодержа-щей кислоты Названия солей бескислородных кислот Названия солей кислородсодержащих кислот Номенклатура солей Физические свойства
Содержание Состав солей Что такое соли? Алгоритм составления формулы соли бескислородной кислоты Алгоритм составления формулы соли кислородсодержа-щей кислоты Названия солей бескислородных кислот Названия солей кислородсодержащих кислот Номенклатура солей Физические свойства
Cлайд 3
 Состав солей NaCl Na2S NaNO3 Na3PO4 1.Соли –это сложные или простые вещества? 2.Проанализируйте состав солей. 3.Сформулируйте определение данного класса соединений.
Состав солей NaCl Na2S NaNO3 Na3PO4 1.Соли –это сложные или простые вещества? 2.Проанализируйте состав солей. 3.Сформулируйте определение данного класса соединений.
Cлайд 4
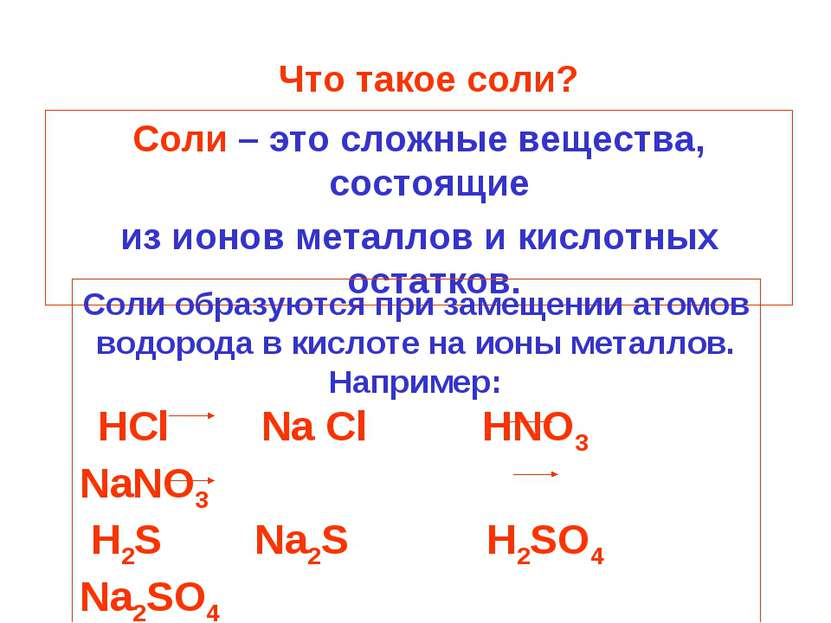
 Что такое соли? Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Соли образуются при замещении атомов водорода в кислоте на ионы металлов. Например: HCl Na Cl HNO3 NaNO3 H2S Na2S H2SO4 Na2SO4
Что такое соли? Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Соли образуются при замещении атомов водорода в кислоте на ионы металлов. Например: HCl Na Cl HNO3 NaNO3 H2S Na2S H2SO4 Na2SO4
Cлайд 5
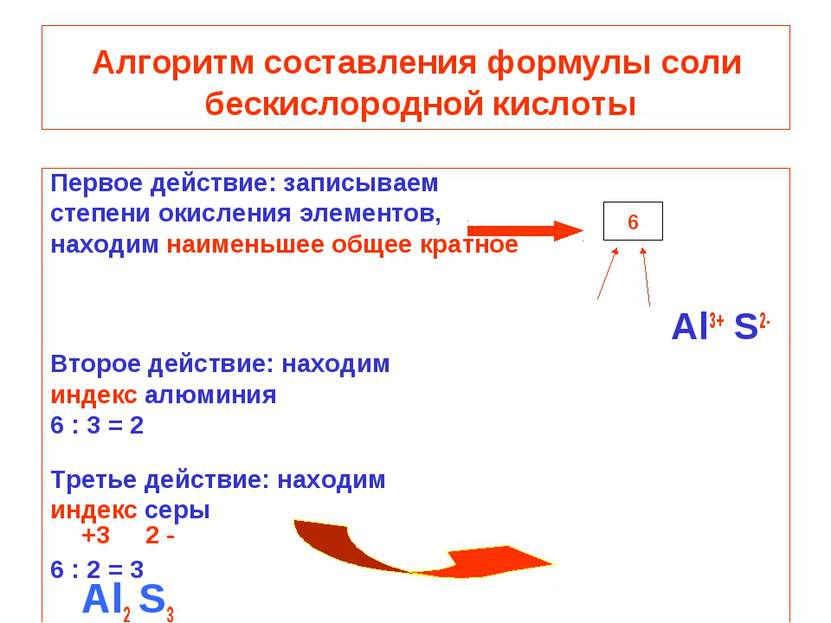
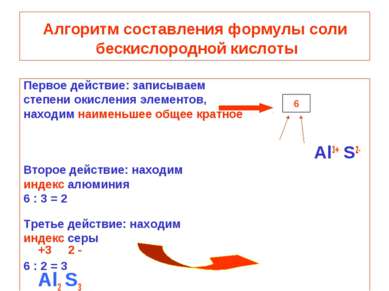 Алгоритм составления формулы соли бескислородной кислоты Первое действие: записываем степени окисления элементов, находим наименьшее общее кратное Al3+ S2- Второе действие: находим индекс алюминия 6 : 3 = 2 Третье действие: находим индекс серы +3 2 - 6 : 2 = 3 Al2 S3 6
Алгоритм составления формулы соли бескислородной кислоты Первое действие: записываем степени окисления элементов, находим наименьшее общее кратное Al3+ S2- Второе действие: находим индекс алюминия 6 : 3 = 2 Третье действие: находим индекс серы +3 2 - 6 : 2 = 3 Al2 S3 6
Cлайд 6
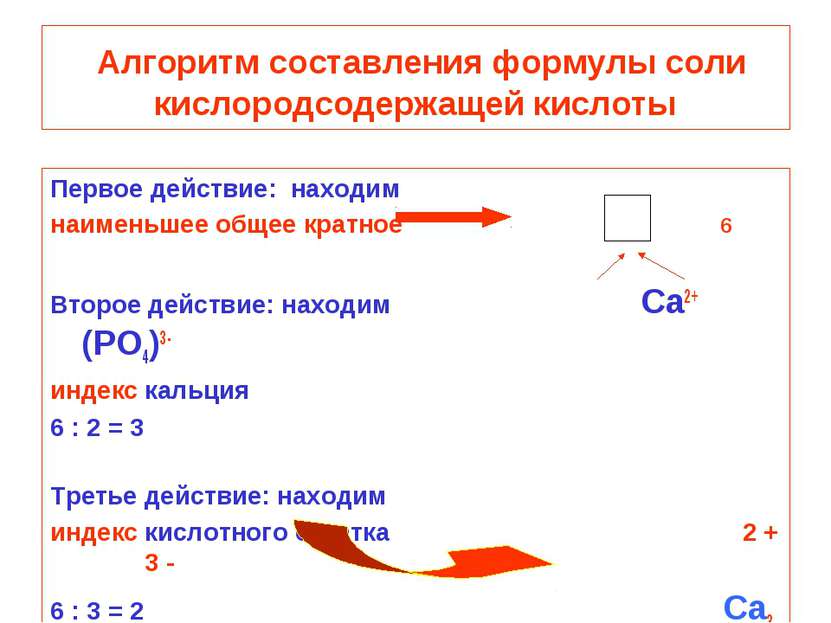
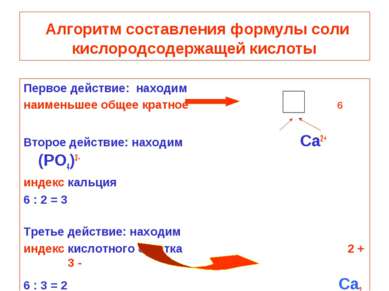 Алгоритм составления формулы соли кислородсодержащей кислоты Первое действие: находим наименьшее общее кратное 6 Второе действие: находим Ca2+ (PO4)3- индекс кальция 6 : 2 = 3 Третье действие: находим индекс кислотного остатка 2 + 3 - 6 : 3 = 2 Ca3 (PO4)2
Алгоритм составления формулы соли кислородсодержащей кислоты Первое действие: находим наименьшее общее кратное 6 Второе действие: находим Ca2+ (PO4)3- индекс кальция 6 : 2 = 3 Третье действие: находим индекс кислотного остатка 2 + 3 - 6 : 3 = 2 Ca3 (PO4)2
Cлайд 7
 Названия солей бескислородных кислот Составление названия солей, образованных от бескислородных кислот: называем электроотрицательную часть соединения – неметалл, его латинское название с суффиксом – ид (в именительном падеже); называем электроположительную часть – металл (в родительном падеже). NaCl – хлорид натрия Al2S3 – сульфид алюминия FeBr2 – бромид железа (II) FeBr3 – бромид железа (III)
Названия солей бескислородных кислот Составление названия солей, образованных от бескислородных кислот: называем электроотрицательную часть соединения – неметалл, его латинское название с суффиксом – ид (в именительном падеже); называем электроположительную часть – металл (в родительном падеже). NaCl – хлорид натрия Al2S3 – сульфид алюминия FeBr2 – бромид железа (II) FeBr3 – бромид железа (III)
Cлайд 8
 Названия солей кислородсодержащих кислот Составление названия солей, образованных от кислородсодержащих кислот: называем электроотрицательную часть соединения – ион кислотного остатка (в именительном падеже); ион кислотного остатка- латинское название с суффиксами: -ат для высшей степени окисления; -ит для низшей степени окисления.; называем электроположительную часть – металл (в родительном падеже). Na2SO4– сульфат натрия Na2SO3 - сульфит натрия Fe (NO2)2 – нитрит железа (II) Fe (NO3) 3 – нитрат железа (III)
Названия солей кислородсодержащих кислот Составление названия солей, образованных от кислородсодержащих кислот: называем электроотрицательную часть соединения – ион кислотного остатка (в именительном падеже); ион кислотного остатка- латинское название с суффиксами: -ат для высшей степени окисления; -ит для низшей степени окисления.; называем электроположительную часть – металл (в родительном падеже). Na2SO4– сульфат натрия Na2SO3 - сульфит натрия Fe (NO2)2 – нитрит железа (II) Fe (NO3) 3 – нитрат железа (III)
Cлайд 9
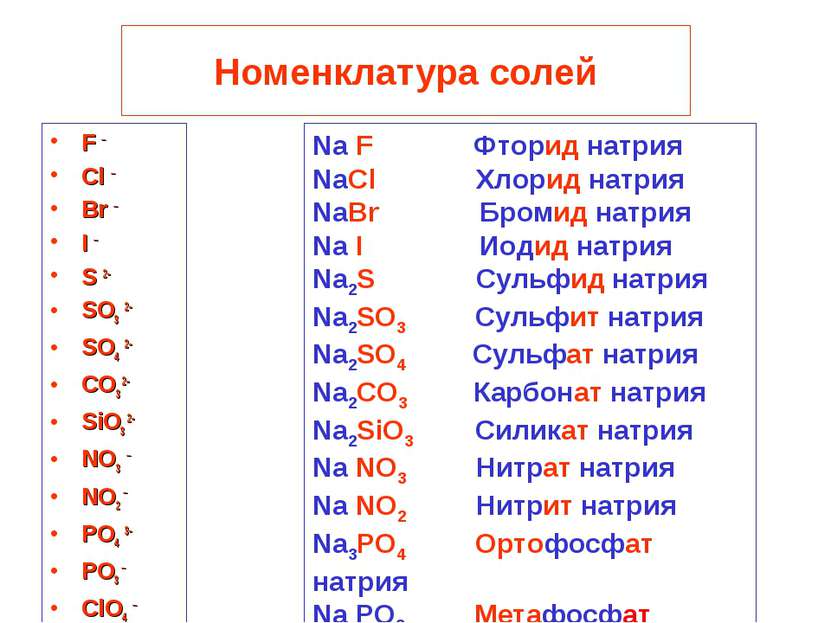
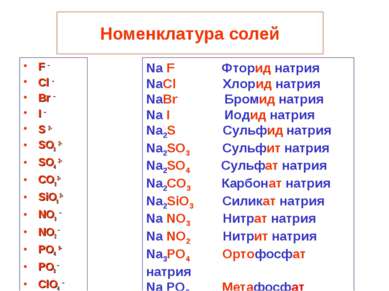 Номенклатура солей F – Cl – Br – I – S 2- SO3 2- SO4 2- CO3 2- SiO3 2- NO3 – NO2 – PO4 3- PO3 – ClO4 – Na F Фторид натрия NaCl Хлорид натрия NaBr Бромид натрия Na I Иодид натрия Na2S Сульфид натрия Na2SO3 Сульфит натрия Na2SO4 Сульфат натрия Na2CO3 Карбонат натрия Na2SiO3 Силикат натрия Na NO3 Нитрат натрия Na NO2 Нитрит натрия Na3PO4 Ортофосфат натрия Na PO3 Метафосфат натрия NaClO4 Хлорат натрия
Номенклатура солей F – Cl – Br – I – S 2- SO3 2- SO4 2- CO3 2- SiO3 2- NO3 – NO2 – PO4 3- PO3 – ClO4 – Na F Фторид натрия NaCl Хлорид натрия NaBr Бромид натрия Na I Иодид натрия Na2S Сульфид натрия Na2SO3 Сульфит натрия Na2SO4 Сульфат натрия Na2CO3 Карбонат натрия Na2SiO3 Силикат натрия Na NO3 Нитрат натрия Na NO2 Нитрит натрия Na3PO4 Ортофосфат натрия Na PO3 Метафосфат натрия NaClO4 Хлорат натрия
Cлайд 10
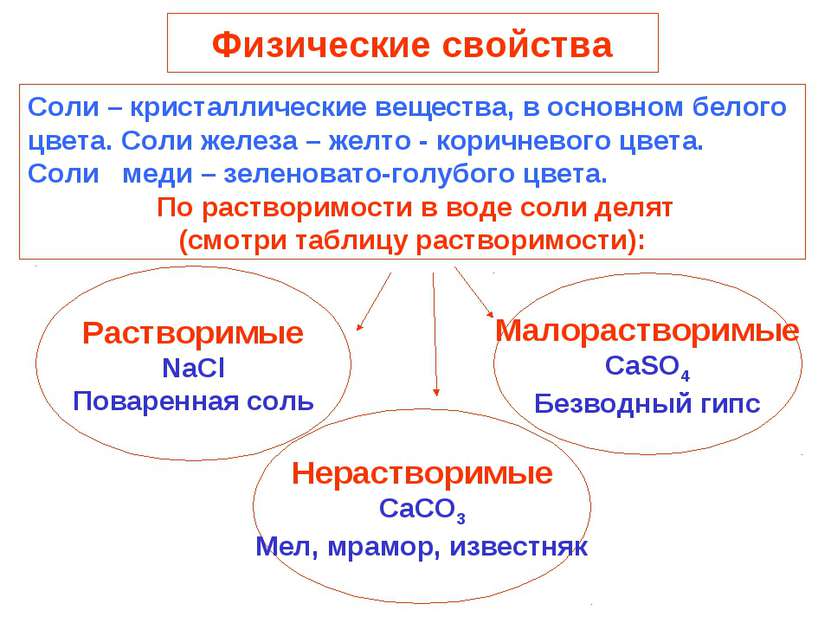
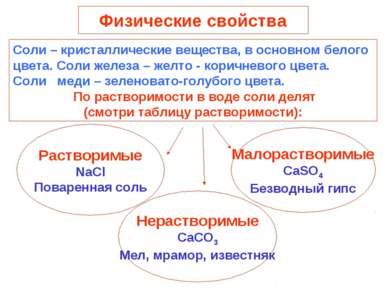 Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета. По растворимости в воде соли делят (смотри таблицу растворимости): Нерастворимые CaCO3 Мел, мрамор, известняк Малорастворимые CaSO4 Безводный гипс
Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа – желто - коричневого цвета. Соли меди – зеленовато-голубого цвета. По растворимости в воде соли делят (смотри таблицу растворимости): Нерастворимые CaCO3 Мел, мрамор, известняк Малорастворимые CaSO4 Безводный гипс
Cлайд 11
 Список литературы 1. Габриелян О.С. Химия 8.- М.: Дрофа, 2007. 2. Габриелян О.С., Решетов П.В., Остроумов И.Г., Никитюк А.М. Готовимся к единому государственному экзамену. - М.: Дрофа, 2003. 3. Зеленин К.Н., Сергутина В.П., Солод О.В. Сдаем экзамен по химии. – ЭЛБИ-СПБ, 2005. Автор проекта желает всем успехов в изучении данной темы ! Город на Волге - Сызрань
Список литературы 1. Габриелян О.С. Химия 8.- М.: Дрофа, 2007. 2. Габриелян О.С., Решетов П.В., Остроумов И.Г., Никитюк А.М. Готовимся к единому государственному экзамену. - М.: Дрофа, 2003. 3. Зеленин К.Н., Сергутина В.П., Солод О.В. Сдаем экзамен по химии. – ЭЛБИ-СПБ, 2005. Автор проекта желает всем успехов в изучении данной темы ! Город на Волге - Сызрань