X
Код презентации скопируйте его
Насыщенный пар
Скачать эту презентациюПрезентация на тему Насыщенный пар
Скачать эту презентациюCлайд 1
 Насыщенный пар Призентация по физике Выполнил: ученик 10 «А» Каретко Дима Руководитель: Попова Ирина Александровна г. Белово 2011 Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школа № 30 города Белово»
Насыщенный пар Призентация по физике Выполнил: ученик 10 «А» Каретко Дима Руководитель: Попова Ирина Александровна г. Белово 2011 Муниципальное общеобразовательное учреждение «Средняя общеобразовательная школа № 30 города Белово»
Cлайд 2
 План 1)Введение 2)Испарение и конденсация 3)Насыщенный пар 4)Давление насыщенного пара 5)Ненасыщенный пар 6)Кипение 7)Критическая температура 8)Изотермы реального газа
План 1)Введение 2)Испарение и конденсация 3)Насыщенный пар 4)Давление насыщенного пара 5)Ненасыщенный пар 6)Кипение 7)Критическая температура 8)Изотермы реального газа
Cлайд 4
 Испарение и конденсация Испарение — это процесс, при котором с поверхности жидкости или твердого тела вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия молекул Конденса ция — переход вещества в жидкое или твёрдое состояние из газообразного. Молекулы жидкости движутся беспорядочно. Чем выше температура жидкости, тем больше кинетическая энергия молекул. Среднее значение кинетической энергии молекул при заданной температуре имеет определенное значение. Но у каждой молекулы кинетическая энергия в данный момент может оказаться как меньше, так и больше средней.
Испарение и конденсация Испарение — это процесс, при котором с поверхности жидкости или твердого тела вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия молекул Конденса ция — переход вещества в жидкое или твёрдое состояние из газообразного. Молекулы жидкости движутся беспорядочно. Чем выше температура жидкости, тем больше кинетическая энергия молекул. Среднее значение кинетической энергии молекул при заданной температуре имеет определенное значение. Но у каждой молекулы кинетическая энергия в данный момент может оказаться как меньше, так и больше средней.
Cлайд 5
 Насыщенный пар Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называется насыщенным паром. Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала процесса испарения концентрация вещества в газообразном состоянии достигает такого значения, при котором число молекул, возвращающихся в жидкость в единицу времени, становится равным числу молекул, покидающих поверхность жидкости за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества.
Насыщенный пар Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называется насыщенным паром. Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала процесса испарения концентрация вещества в газообразном состоянии достигает такого значения, при котором число молекул, возвращающихся в жидкость в единицу времени, становится равным числу молекул, покидающих поверхность жидкости за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества.
Cлайд 6
 Давление насыщенного пара Что будет происходить с насыщенным паром, если уменьшить занимаемый им объем? Если сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая температуру содержимого цилиндра постоянной. При сжатии пара равновесие начнет нарушаться. Плотность пара в первый момент немного увеличится, и из газа в жидкость начнет переходить большее число молекул, чем из жидкости в газ. Ведь число молекул, покидающих жидкость в единицу времени, зависит только от температуры, и сжатие пара это число не меняет. Процесс продолжается до тех пор, пока вновь не установится динамическое равновесие и плотность пара.
Давление насыщенного пара Что будет происходить с насыщенным паром, если уменьшить занимаемый им объем? Если сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая температуру содержимого цилиндра постоянной. При сжатии пара равновесие начнет нарушаться. Плотность пара в первый момент немного увеличится, и из газа в жидкость начнет переходить большее число молекул, чем из жидкости в газ. Ведь число молекул, покидающих жидкость в единицу времени, зависит только от температуры, и сжатие пара это число не меняет. Процесс продолжается до тех пор, пока вновь не установится динамическое равновесие и плотность пара.
Cлайд 7
 Ненасыщенный пар Пар, находящийся при давлении ниже давления насыщенного пара, называется ненасыщенным. При сжатии насыщенного пара концентрация молекул пара увеличивается, равновесие между процессами испарения и конденсации нарушается и часть пара превращается в жидкость. При расширении насыщенного пара концентрация его молекул уменьшается и часть жидкости превращается в пар. Таким образом, концентрация насыщенного пара остается постоянной независимо от объема. Так как давление газа пропорционально концентрации и температуре (p = nkT), давление насыщенного пара при постоянной температуре не зависит от объема.
Ненасыщенный пар Пар, находящийся при давлении ниже давления насыщенного пара, называется ненасыщенным. При сжатии насыщенного пара концентрация молекул пара увеличивается, равновесие между процессами испарения и конденсации нарушается и часть пара превращается в жидкость. При расширении насыщенного пара концентрация его молекул уменьшается и часть жидкости превращается в пар. Таким образом, концентрация насыщенного пара остается постоянной независимо от объема. Так как давление газа пропорционально концентрации и температуре (p = nkT), давление насыщенного пара при постоянной температуре не зависит от объема.
Cлайд 8
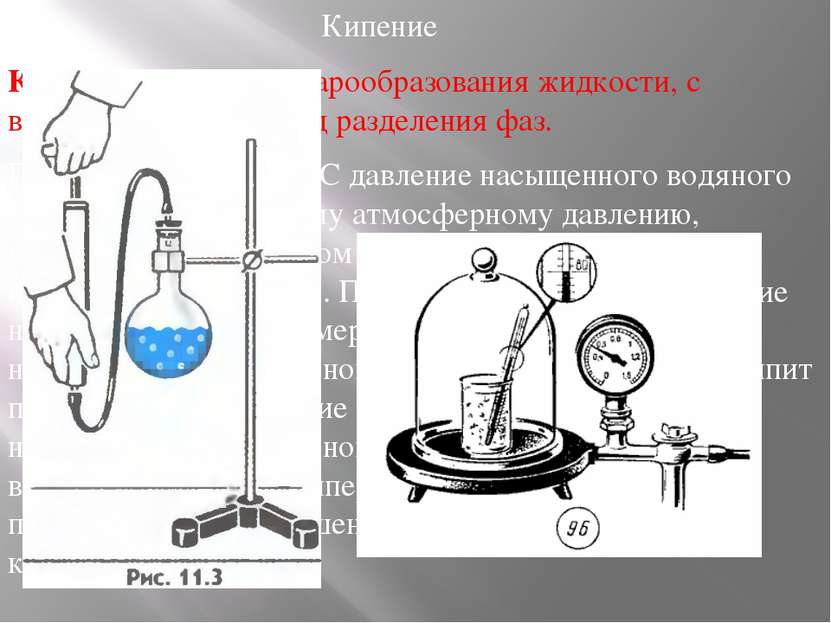
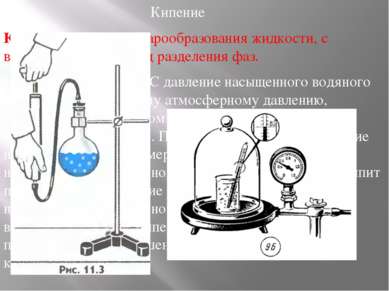 Кипение Кипение — процесс парообразования жидкости, с возникновением границ разделения фаз. При температуре 100 °С давление насыщенного водяного пара равно нормальному атмосферному давлению, поэтому при нормальном давлении кипение воды происходит при 100 °С. При температуре 80 °С давление насыщенного пара примерно в два раза меньше нормального атмосферного давления. Поэтому вода кипит при 80 °С, если давление над ней уменьшить до 0,5 нормального атмосферного давления. При понижении внешнего давления температура кипения жидкости понижается, при повышении давления температура кипения повышается.
Кипение Кипение — процесс парообразования жидкости, с возникновением границ разделения фаз. При температуре 100 °С давление насыщенного водяного пара равно нормальному атмосферному давлению, поэтому при нормальном давлении кипение воды происходит при 100 °С. При температуре 80 °С давление насыщенного пара примерно в два раза меньше нормального атмосферного давления. Поэтому вода кипит при 80 °С, если давление над ней уменьшить до 0,5 нормального атмосферного давления. При понижении внешнего давления температура кипения жидкости понижается, при повышении давления температура кипения повышается.
Cлайд 9
 Критическая температура Критическая температура — такая температура, при которой плотность и давление насыщенного пара становится максимальными, а плотность жидкости, находящейся в динамическом равновесии с паром, становится минимальной. Любое вещество, находящееся в газообразном состоянии, может превратиться в жидкость. Однако каждое вещество может испытать такое превращение лишь при температурах, меньших некоторого, особого для каждого вещества. При понижении температуры ниже критической для данного газа действием сил притяжения между молекулами уже нельзя пренебрегать, и при достаточно высоком давлении молекулы вещества соединяются между собой.
Критическая температура Критическая температура — такая температура, при которой плотность и давление насыщенного пара становится максимальными, а плотность жидкости, находящейся в динамическом равновесии с паром, становится минимальной. Любое вещество, находящееся в газообразном состоянии, может превратиться в жидкость. Однако каждое вещество может испытать такое превращение лишь при температурах, меньших некоторого, особого для каждого вещества. При понижении температуры ниже критической для данного газа действием сил притяжения между молекулами уже нельзя пренебрегать, и при достаточно высоком давлении молекулы вещества соединяются между собой.
Cлайд 10
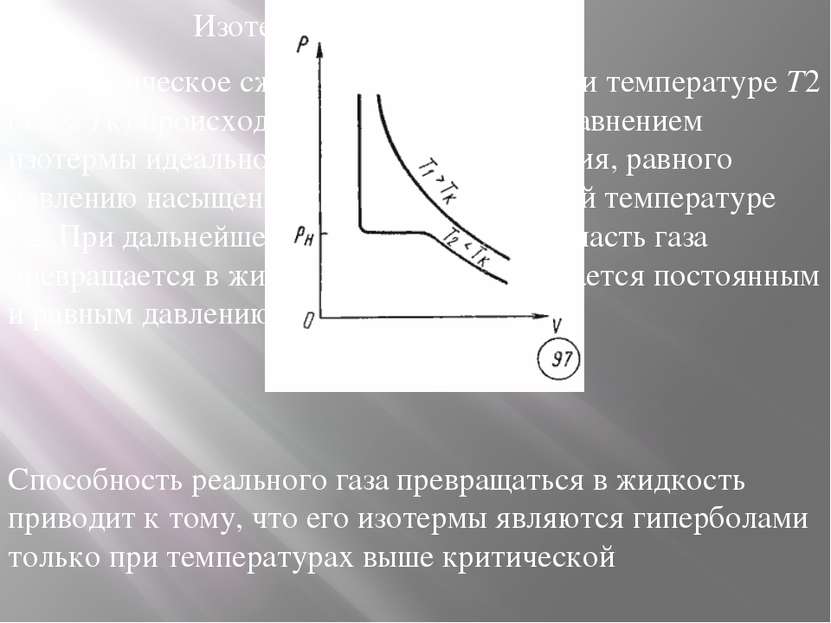
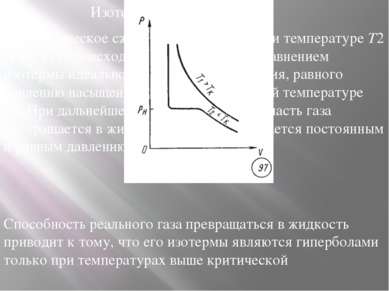 Изотермы реального газа Изотермическое сжатие реального газа при температуре T2 (T2 < Tк) происходит в соответствии с уравнением изотермы идеального газа лишь до давления, равного давлению насыщенного пара p0 при данной температуре T2. При дальнейшем уменьшении объема часть газа превращается в жидкость, а давление остается постоянным и равным давлению насыщенного пара. Способность реального газа превращаться в жидкость приводит к тому, что его изотермы являются гиперболами только при температурах выше критической
Изотермы реального газа Изотермическое сжатие реального газа при температуре T2 (T2 < Tк) происходит в соответствии с уравнением изотермы идеального газа лишь до давления, равного давлению насыщенного пара p0 при данной температуре T2. При дальнейшем уменьшении объема часть газа превращается в жидкость, а давление остается постоянным и равным давлению насыщенного пара. Способность реального газа превращаться в жидкость приводит к тому, что его изотермы являются гиперболами только при температурах выше критической
Cлайд 11
 Используемая литература Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. «Физика. 10 класс», «Просвещение», 2007 г. Касьянов, В.А. Физика, 10 класс [Текст]: учебник для общеобразовательных школ / В.А. Касьянов. – ООО "Дрофа", 2004. – 116 с. Кабардин О.Ф., Орлов В.А., Эвенчик Э.Е., Шамаш С.Я., Пинский А.А., Кабардина С.И., Дик Ю.И., Никифоров Г.Г., Шефер Н.И. «Физика. 10 класс», «Просвещение», 2007 г.
Используемая литература Мякишев Г.Я., Буховцев Б.Б., Сотский Н.Н. «Физика. 10 класс», «Просвещение», 2007 г. Касьянов, В.А. Физика, 10 класс [Текст]: учебник для общеобразовательных школ / В.А. Касьянов. – ООО "Дрофа", 2004. – 116 с. Кабардин О.Ф., Орлов В.А., Эвенчик Э.Е., Шамаш С.Я., Пинский А.А., Кабардина С.И., Дик Ю.И., Никифоров Г.Г., Шефер Н.И. «Физика. 10 класс», «Просвещение», 2007 г.