X
Код презентации скопируйте его
Источники загрязнения Атмосферы
Скачать эту презентациюПрезентация на тему Источники загрязнения Атмосферы
Скачать эту презентациюCлайд 2
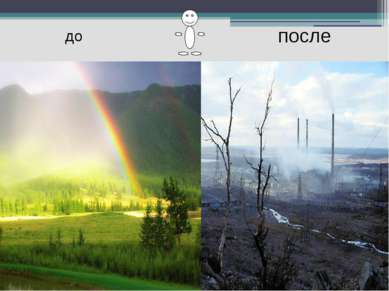
 …это проникновение в атмосферный воздух новых нехарактерных для него физических, химических и биологических веществ или изменение в естественной среде многолетней концентрации этих веществ. Загрязнение атмосферы-…
…это проникновение в атмосферный воздух новых нехарактерных для него физических, химических и биологических веществ или изменение в естественной среде многолетней концентрации этих веществ. Загрязнение атмосферы-…
Cлайд 3
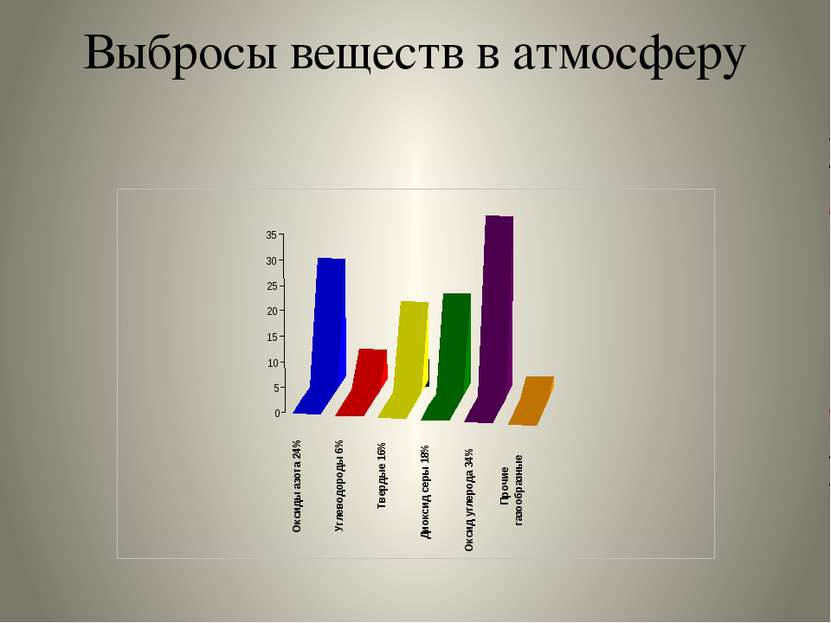
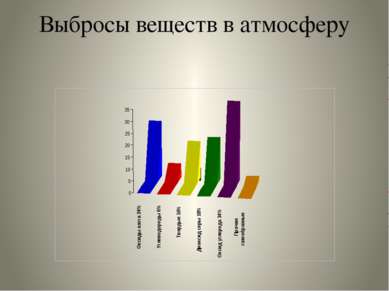
 Основные загрязнители атмосферного воздуха: Оксид углерода Оксиды азота Диоксид серы Углеводороды Альдегиды Тяжёлые металлы Аммиак
Основные загрязнители атмосферного воздуха: Оксид углерода Оксиды азота Диоксид серы Углеводороды Альдегиды Тяжёлые металлы Аммиак
Cлайд 6
 Последствия загрязнения атмосферы. Смог Смог-это туман, смешанный с пылью, сажей и ядовитыми газами. Смог оказывает влияние на отражающую способность Земли Частицы пыли сокращают доступ ультрафиолетовой радиации и образуют избыточное количество паров воды. Всё это увеличивает отражающую способность атмосферы и приводит к похолоданию климата.
Последствия загрязнения атмосферы. Смог Смог-это туман, смешанный с пылью, сажей и ядовитыми газами. Смог оказывает влияние на отражающую способность Земли Частицы пыли сокращают доступ ультрафиолетовой радиации и образуют избыточное количество паров воды. Всё это увеличивает отражающую способность атмосферы и приводит к похолоданию климата.
Cлайд 8
 Что такое угарный газ? Угарный газ (оксид углерода (II) — бесцветный ядовитый газ без вкуса и запаха. Химическая формула — CO. Угарный газ— один из наиболее распространенных отравляющих газов в природе, загрязняющих окружающую среду. Главным источником СО является неполное сгорание ископаемого топлива, особенно угля. Выхлопные газы служат одним из главных источников образования СО в окружающей среде.
Что такое угарный газ? Угарный газ (оксид углерода (II) — бесцветный ядовитый газ без вкуса и запаха. Химическая формула — CO. Угарный газ— один из наиболее распространенных отравляющих газов в природе, загрязняющих окружающую среду. Главным источником СО является неполное сгорание ископаемого топлива, особенно угля. Выхлопные газы служат одним из главных источников образования СО в окружающей среде.
Cлайд 9
 Пирометаллургия - получение металлов и сплавов под действием высоких температур. Восстановление металлов угарным газом: PbO + CО = CO2 + Pb
Пирометаллургия - получение металлов и сплавов под действием высоких температур. Восстановление металлов угарным газом: PbO + CО = CO2 + Pb
Cлайд 10
 Физиологическое действие угарного газа на организм. Угарный газ очень ядовит. Первыми признаками острого отравления СО являются головная боль и головокружение, в дальнейшем наступает потеря сознания. Основным противоядием при отравлении СО служит свежий воздух. Полезно также кратковременное вдыхание паров нашатырного спирта.
Физиологическое действие угарного газа на организм. Угарный газ очень ядовит. Первыми признаками острого отравления СО являются головная боль и головокружение, в дальнейшем наступает потеря сознания. Основным противоядием при отравлении СО служит свежий воздух. Полезно также кратковременное вдыхание паров нашатырного спирта.
Cлайд 11
 Оксид углерода (IV) Углекислый газ Газ без цвета и запаха. Это кислотный оксид, ему соответствует двухосновная угольная кислота. Растворение оксида углерода (IV) — обратимый процесс, в результате которого образуется угольная кислота. H2O + CO2 H2CO3
Оксид углерода (IV) Углекислый газ Газ без цвета и запаха. Это кислотный оксид, ему соответствует двухосновная угольная кислота. Растворение оксида углерода (IV) — обратимый процесс, в результате которого образуется угольная кислота. H2O + CO2 H2CO3
Cлайд 12
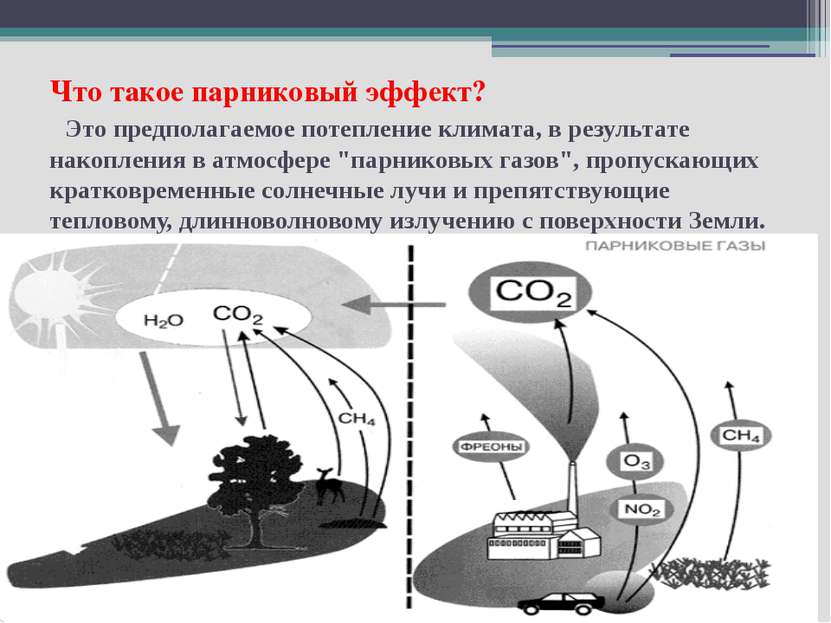
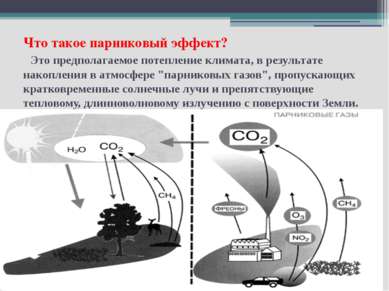 Что такое парниковый эффект? Это предполагаемое потепление климата, в результате накопления в атмосфере "парниковых газов", пропускающих кратковременные солнечные лучи и препятствующие тепловому, длинноволновому излучению с поверхности Земли.
Что такое парниковый эффект? Это предполагаемое потепление климата, в результате накопления в атмосфере "парниковых газов", пропускающих кратковременные солнечные лучи и препятствующие тепловому, длинноволновому излучению с поверхности Земли.
Cлайд 14
 SO2 оксид серы(IV) Сернистый газ Физические свойства SO2 Химические свойства SO2 Кислотный оксид Обладает всеми свойствами кислотных оксидов Слабая сернистая кислота H2O+SO2 H2SO3 газ бесцветный запах резкий, удушливый tкип = -10С
SO2 оксид серы(IV) Сернистый газ Физические свойства SO2 Химические свойства SO2 Кислотный оксид Обладает всеми свойствами кислотных оксидов Слабая сернистая кислота H2O+SO2 H2SO3 газ бесцветный запах резкий, удушливый tкип = -10С
Cлайд 15
 . Кислотные дожди Любая дождевая вода обладает очень слабой степенью кислотности. Однако при сгорании продуктов переработки природного топлива выделяются химические вещества, намного увеличивающие кислотность влаги, которая содержится в атмосфере. В конечном итоге эта влага выпадает на землю в виде кислотного дождя.
. Кислотные дожди Любая дождевая вода обладает очень слабой степенью кислотности. Однако при сгорании продуктов переработки природного топлива выделяются химические вещества, намного увеличивающие кислотность влаги, которая содержится в атмосфере. В конечном итоге эта влага выпадает на землю в виде кислотного дождя.
Cлайд 17
 Оксид азота (II) NO Бесцветный газ, не имеет запаха. В воде малорастворим. Образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре: N2 + O2 2NO
Оксид азота (II) NO Бесцветный газ, не имеет запаха. В воде малорастворим. Образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре: N2 + O2 2NO
Cлайд 18
 Оксид азота (IV)- NO2 Кислотный оксид 2NO2 + H2O = HNO2 + HNO3 Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде.
Оксид азота (IV)- NO2 Кислотный оксид 2NO2 + H2O = HNO2 + HNO3 Ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде.
Cлайд 19
 Применение азотной кислоты: - производство азотных и комбинированных удобрений, - взрывчатых веществ (тринитротолуола и др.), - органических красителей. - как окислитель ракетного топлива. - в металлургии азотная кислота применяют для травления и растворения металлов, а также для разделения золота и серебра.
Применение азотной кислоты: - производство азотных и комбинированных удобрений, - взрывчатых веществ (тринитротолуола и др.), - органических красителей. - как окислитель ракетного топлива. - в металлургии азотная кислота применяют для травления и растворения металлов, а также для разделения золота и серебра.