X
Код презентации скопируйте его
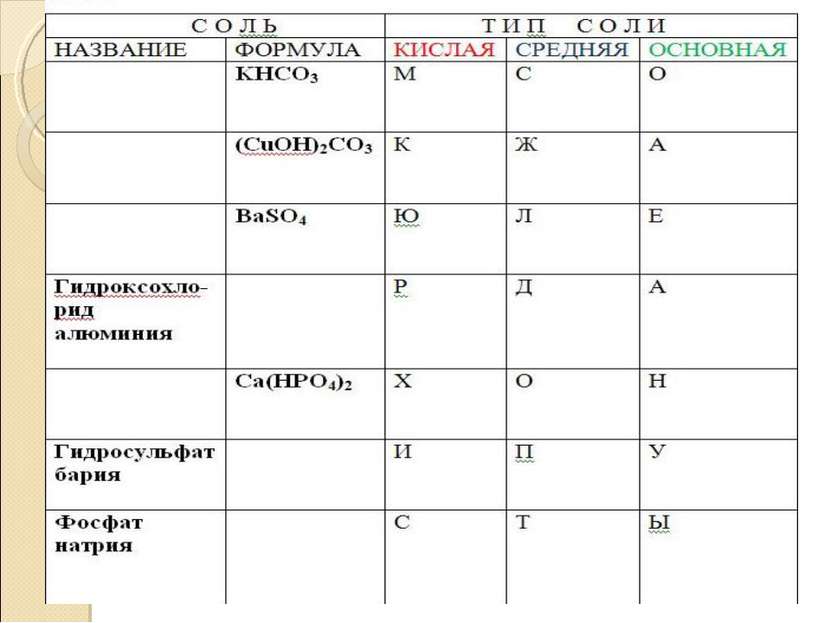
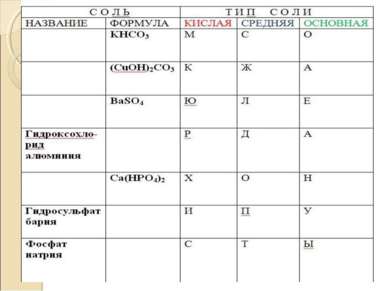
Химические свойства солей
Скачать эту презентациюПрезентация на тему Химические свойства солей
Скачать эту презентациюCлайд 4
 Вычеркните «лишние» формулы и допишите предложения. А) H2SO4 , HNO3, H3PO4, HCl, H2 S – это кислоты, которые не образуют кислых солей, так как ………………………………………………………………………………................
Вычеркните «лишние» формулы и допишите предложения. А) H2SO4 , HNO3, H3PO4, HCl, H2 S – это кислоты, которые не образуют кислых солей, так как ………………………………………………………………………………................
Cлайд 5
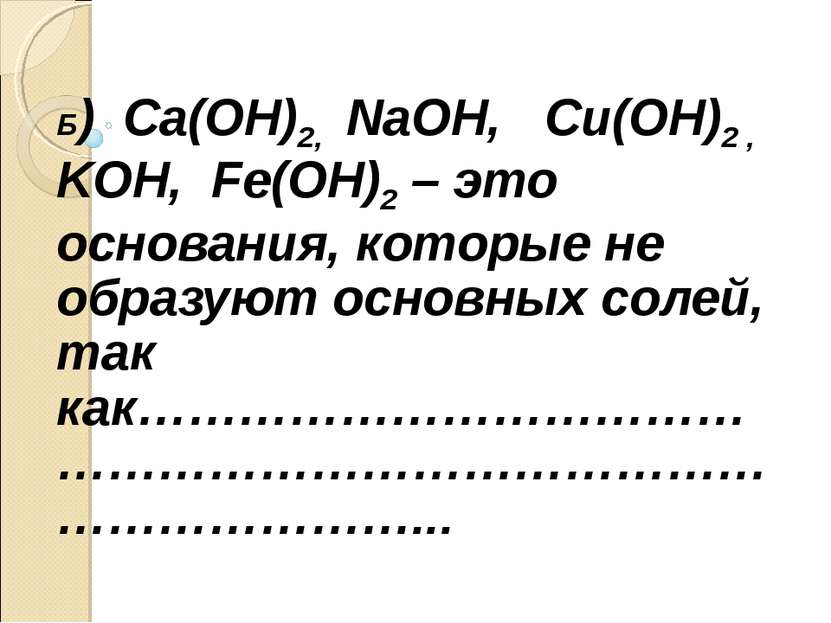
 Б) Ca(OH)2, NaOH, Cu(OH)2 , KOH, Fe(OH)2 – это основания, которые не образуют основных солей, так как………………………………………………………………………………………...
Б) Ca(OH)2, NaOH, Cu(OH)2 , KOH, Fe(OH)2 – это основания, которые не образуют основных солей, так как………………………………………………………………………………………...
Cлайд 14
 Н.Н БЕКЕТОВ В 1865г ИЗУЧИЛ СПОСОБНОСТЬ МЕТАЛЛОВ ВЫТЕСНЯТЬ ИЗ РАСТВОРОВ СОЛЕЙ ДРУГИЕ МЕТАЛЛЫ. НА ОСНОВЕ ЭТИХ ИССЛЕДОВАНИЙ СОСТАВИЛ ВЫТЕСНИТЕЛЬНЫЙ РЯД МЕТАЛЛОВ
Н.Н БЕКЕТОВ В 1865г ИЗУЧИЛ СПОСОБНОСТЬ МЕТАЛЛОВ ВЫТЕСНЯТЬ ИЗ РАСТВОРОВ СОЛЕЙ ДРУГИЕ МЕТАЛЛЫ. НА ОСНОВЕ ЭТИХ ИССЛЕДОВАНИЙ СОСТАВИЛ ВЫТЕСНИТЕЛЬНЫЙ РЯД МЕТАЛЛОВ
Cлайд 15
 В 1892 Г В. НЕРНСТ ДОКАЗАЛ, ЧТО ВЫТЕСНИТЕЛЬНЫЙ РЯД ПРАКТИЧЕСКИ СОВПАДАЕТ С РЯДОМ В КОТОРОМ МЕТАЛЛЫ И ВОДОРОД РАСПОЛОЖЕНЫ В ПОРЯДКЕ УМЕНЬШЕНИЯ ИХ ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ. ЭТОТ РЯД НАЗЫВАЮТ ЭЛЕКТРОХИМИЧЕСКИМ РЯДОМ НАПРЯЖЕНИЯ МЕТАЛЛОВ
В 1892 Г В. НЕРНСТ ДОКАЗАЛ, ЧТО ВЫТЕСНИТЕЛЬНЫЙ РЯД ПРАКТИЧЕСКИ СОВПАДАЕТ С РЯДОМ В КОТОРОМ МЕТАЛЛЫ И ВОДОРОД РАСПОЛОЖЕНЫ В ПОРЯДКЕ УМЕНЬШЕНИЯ ИХ ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ. ЭТОТ РЯД НАЗЫВАЮТ ЭЛЕКТРОХИМИЧЕСКИМ РЯДОМ НАПРЯЖЕНИЯ МЕТАЛЛОВ