X
Код презентации скопируйте его
ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРОИЗВОДНЫЕ ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕНА
Скачать эту презентациюПрезентация на тему ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРОИЗВОДНЫЕ ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕНА
Скачать эту презентациюCлайд 1
 ЛЕКЦИЯ 3 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРОИЗВОДНЫЕ ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕНА http://prezentacija.biz/
ЛЕКЦИЯ 3 ЛЕКАРСТВЕННЫЕ СРЕДСТВА, ПРОИЗВОДНЫЕ ЦИКЛОПЕНТАНПЕРГИДРОФЕНАНТРЕНА http://prezentacija.biz/
Cлайд 2
 Фенантрен - ароматическая конденсированная система, содержащая три бензольных ядра Пергидрофенантрен - полностью гидрированная форма фенантрена, ароматические свойства отсутствуют Пергидрофенантрен Циклопентан + конденсация Циклопентанпергидрофенантрен (ЦППФ)
Фенантрен - ароматическая конденсированная система, содержащая три бензольных ядра Пергидрофенантрен - полностью гидрированная форма фенантрена, ароматические свойства отсутствуют Пергидрофенантрен Циклопентан + конденсация Циклопентанпергидрофенантрен (ЦППФ)
Cлайд 3
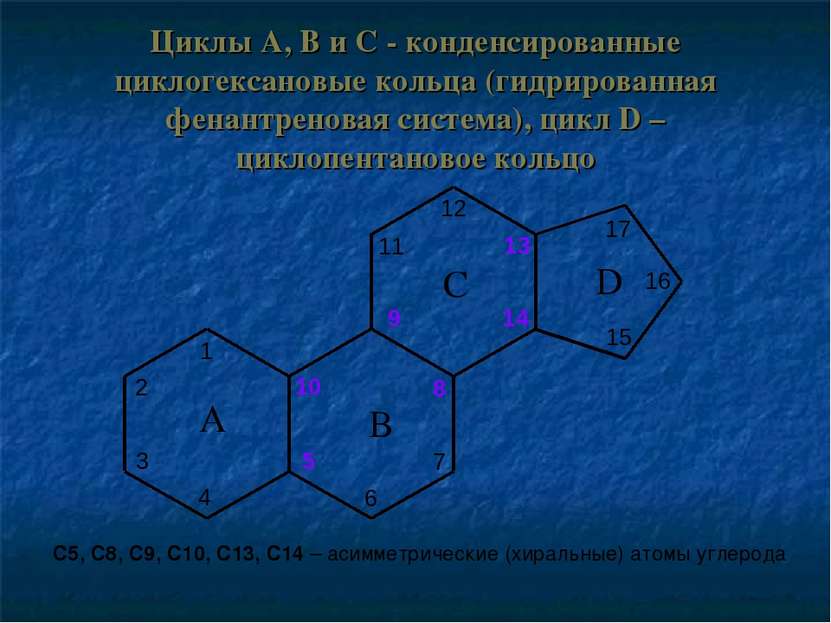
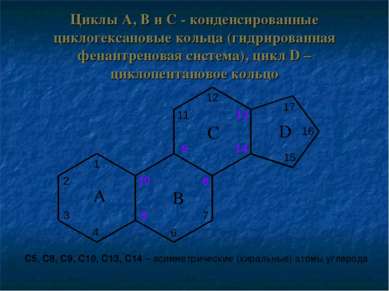 Циклы A, B и C - конденсированные циклогексановые кольца (гидрированная фенантреновая система), цикл D – циклопентановое кольцо С5, С8, С9, С10, С13, С14 – асимметрические (хиральные) атомы углерода
Циклы A, B и C - конденсированные циклогексановые кольца (гидрированная фенантреновая система), цикл D – циклопентановое кольцо С5, С8, С9, С10, С13, С14 – асимметрические (хиральные) атомы углерода
Cлайд 4
 Классификация ЛС – производных ЦППФ Кардиостероиды (сердечные гликозиды) 2. Витамины группы D (кальциферолы) 3. Стероидные гормоны: Кортикостероиды Андрогены Эстрогены Гестагены Анаболические стероиды
Классификация ЛС – производных ЦППФ Кардиостероиды (сердечные гликозиды) 2. Витамины группы D (кальциферолы) 3. Стероидные гормоны: Кортикостероиды Андрогены Эстрогены Гестагены Анаболические стероиды
Cлайд 5
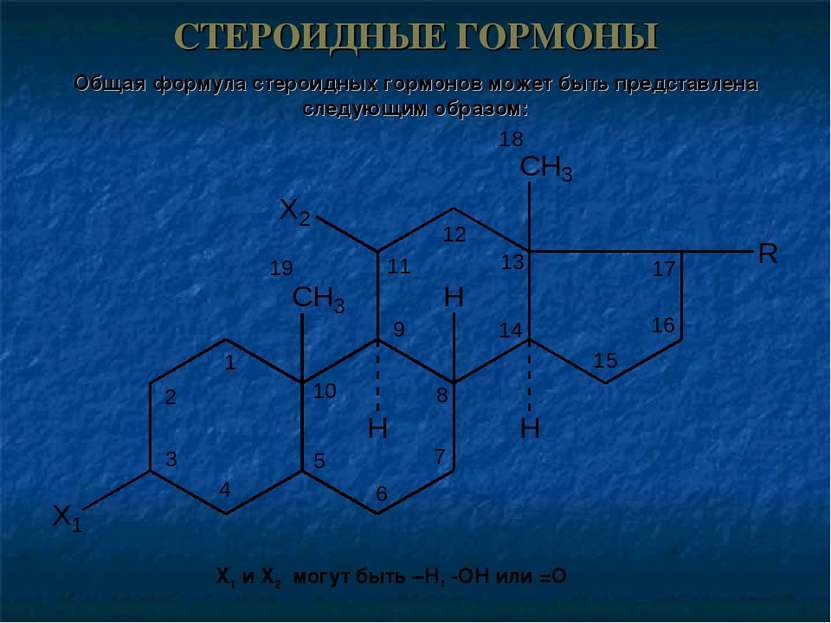
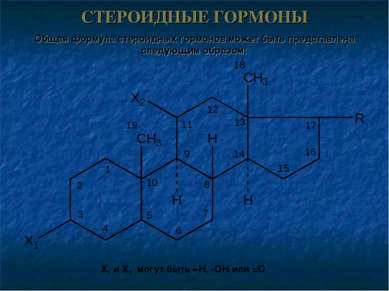 СТЕРОИДНЫЕ ГОРМОНЫ Общая формула стероидных гормонов может быть представлена следующим образом: X1 и X2 могут быть –Н, -ОН или =О
СТЕРОИДНЫЕ ГОРМОНЫ Общая формула стероидных гормонов может быть представлена следующим образом: X1 и X2 могут быть –Н, -ОН или =О
Cлайд 7
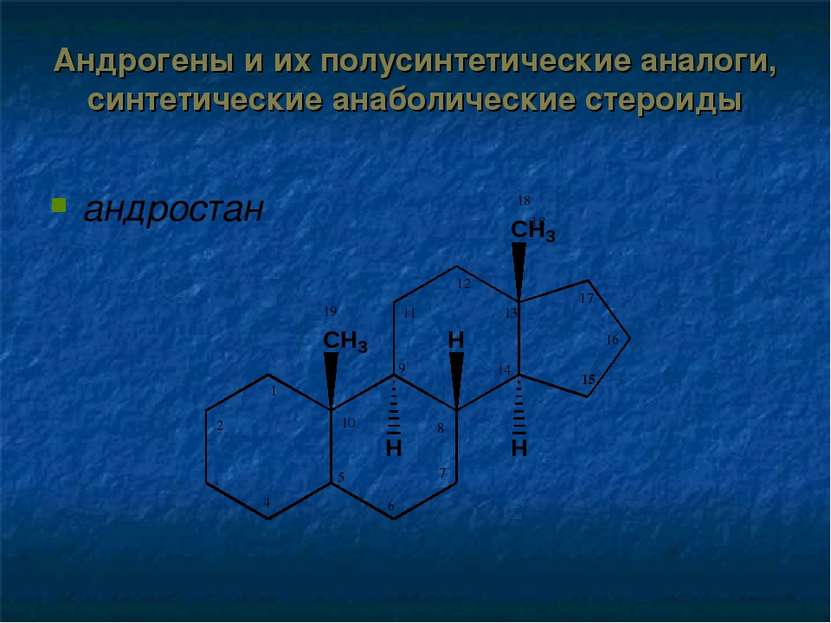
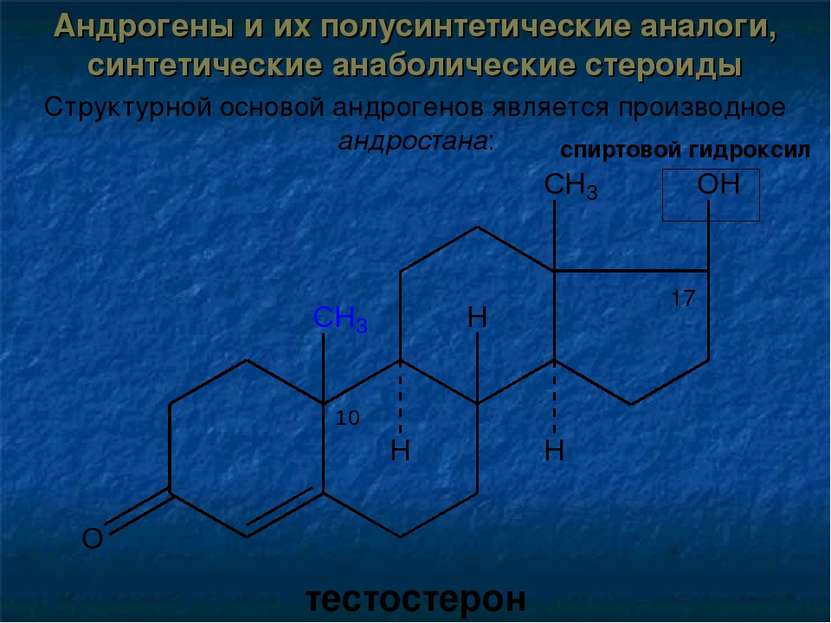
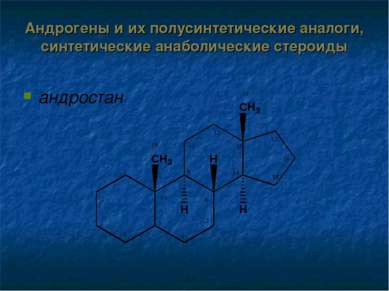
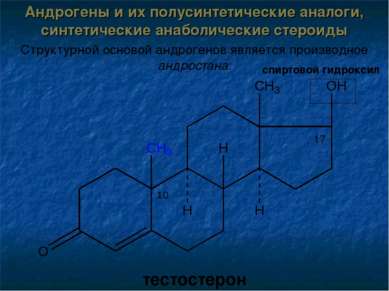 Андрогены и их полусинтетические аналоги, синтетические анаболические стероиды Структурной основой андрогенов является производное андростана: тестостерон спиртовой гидроксил 17
Андрогены и их полусинтетические аналоги, синтетические анаболические стероиды Структурной основой андрогенов является производное андростана: тестостерон спиртовой гидроксил 17
Cлайд 8
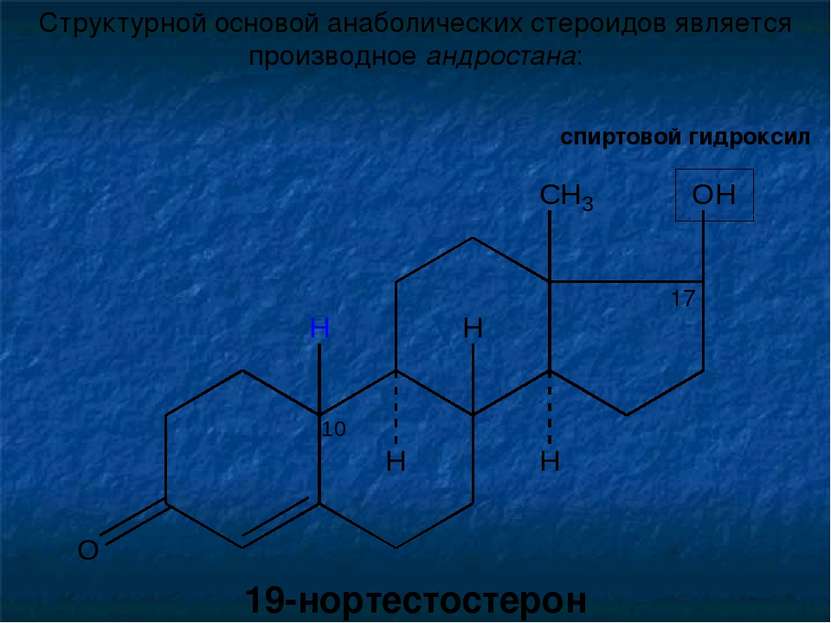
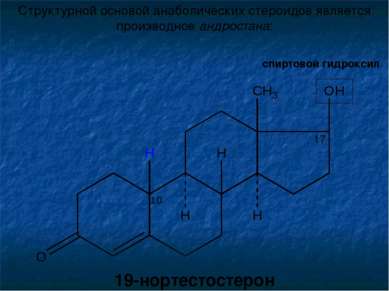 Структурной основой анаболических стероидов является производное андростана: спиртовой гидроксил 19-нортестостерон 17
Структурной основой анаболических стероидов является производное андростана: спиртовой гидроксил 19-нортестостерон 17
Cлайд 9
 Основные физиологические эффекты: синтез белков и их распад синтез жиров их распад уровень холестерина, липидов и глюкозы в крови Основные патологические эффекты (недостаток): либидо половая дисфункция мышечной массы и упадок сил депрессии Андрогены (греч. ανδρεία (мужество, храбрость) + греч. γένος (рождающий) вырабатываются мужскими половыми железами, участвуют в развитии вторичных половых признаков у мужчин.
Основные физиологические эффекты: синтез белков и их распад синтез жиров их распад уровень холестерина, липидов и глюкозы в крови Основные патологические эффекты (недостаток): либидо половая дисфункция мышечной массы и упадок сил депрессии Андрогены (греч. ανδρεία (мужество, храбрость) + греч. γένος (рождающий) вырабатываются мужскими половыми железами, участвуют в развитии вторичных половых признаков у мужчин.
Cлайд 10
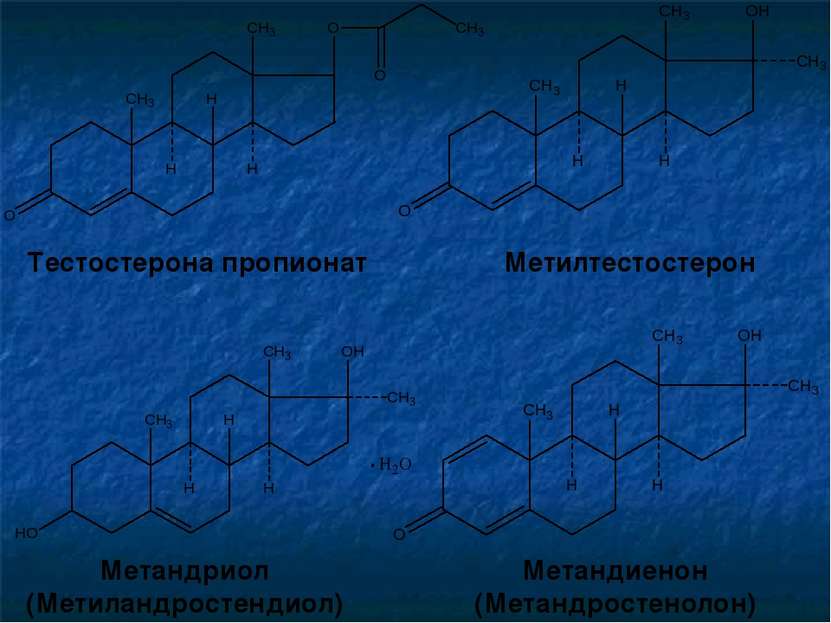
 Лекарственные субстанции андрогенов и анаболических стероидов представляют собой белые кристаллические вещества с кремовым оттенком. Они практически не растворимы в воде, легко растворимы в спирте, растворимы в хлороформе и эфире. Андрогены: Тестостерона пропионат Метилтестостерон Метандриол (нет в ЕФ 6.0) Метандиенон (нет в ЕФ 6.0) Анаболические стероиды: Ретаболил (нандролона деканоат) Феноболин (нандролона фенилпропионат)
Лекарственные субстанции андрогенов и анаболических стероидов представляют собой белые кристаллические вещества с кремовым оттенком. Они практически не растворимы в воде, легко растворимы в спирте, растворимы в хлороформе и эфире. Андрогены: Тестостерона пропионат Метилтестостерон Метандриол (нет в ЕФ 6.0) Метандиенон (нет в ЕФ 6.0) Анаболические стероиды: Ретаболил (нандролона деканоат) Феноболин (нандролона фенилпропионат)
Cлайд 11
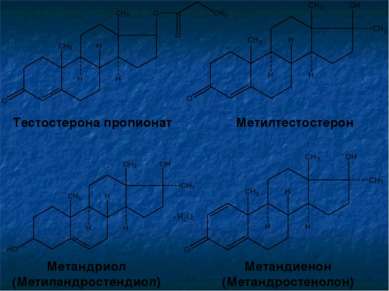 Тестостерона пропионат Метилтестостерон Метандриол (Метиландростендиол) Метандиенон (Метандростенолон)
Тестостерона пропионат Метилтестостерон Метандриол (Метиландростендиол) Метандиенон (Метандростенолон)
Cлайд 12
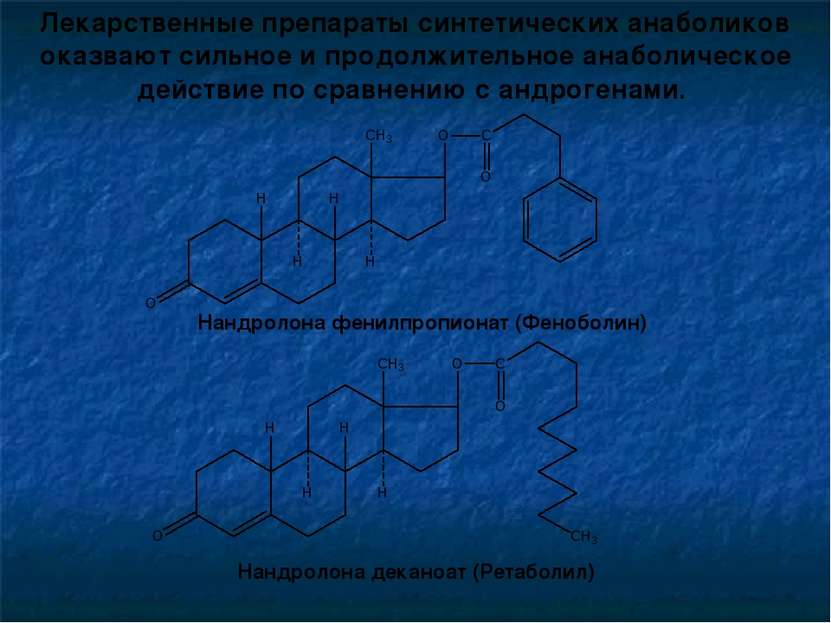
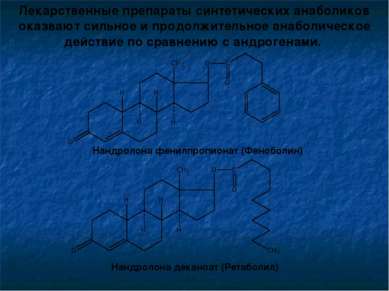 Лекарственные препараты синтетических анаболиков оказвают сильное и продолжительное анаболическое действие по сравнению с андрогенами. Нандролона фенилпропионат (Феноболин) Нандролона деканоат (Ретаболил)
Лекарственные препараты синтетических анаболиков оказвают сильное и продолжительное анаболическое действие по сравнению с андрогенами. Нандролона фенилпропионат (Феноболин) Нандролона деканоат (Ретаболил)
Cлайд 13
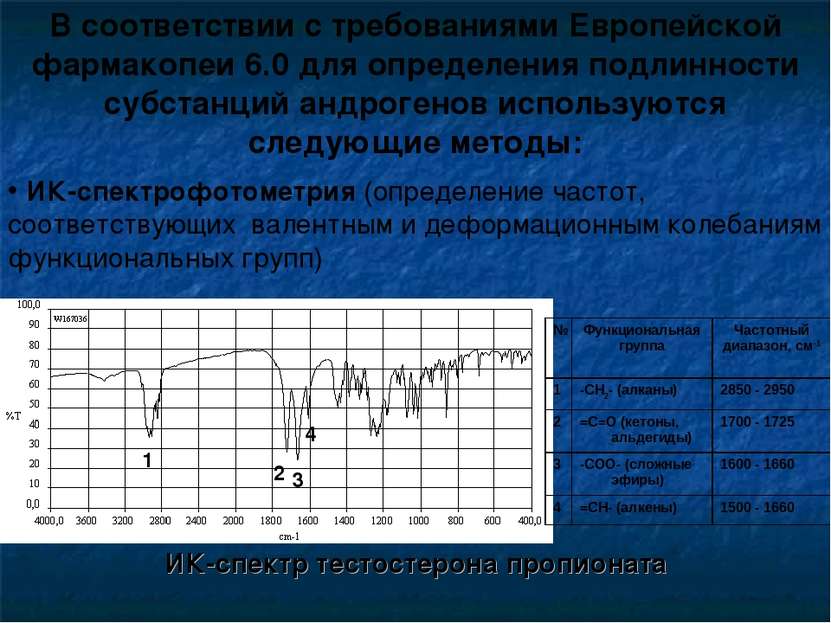
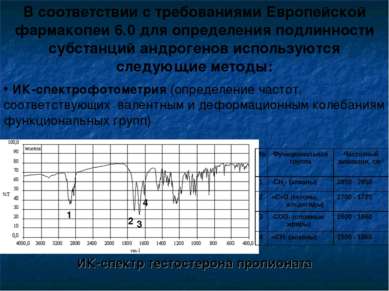 В соответствии с требованиями Европейской фармакопеи 6.0 для определения подлинности субстанций андрогенов используются следующие методы: ИК-спектрофотометрия (определение частот, соответствующих валентным и деформационным колебаниям функциональных групп) ИК-спектр тестостерона пропионата 1 2 4 3 № Функциональная группа Частотный диапазон, см-1 1 -СН2- (алканы) 2850 - 2950 2 =С=О (кетоны, альдегиды) 1700 - 1725 3 -СОО- (сложные эфиры) 1600 - 1660 4 =СН- (алкены) 1500 - 1660
В соответствии с требованиями Европейской фармакопеи 6.0 для определения подлинности субстанций андрогенов используются следующие методы: ИК-спектрофотометрия (определение частот, соответствующих валентным и деформационным колебаниям функциональных групп) ИК-спектр тестостерона пропионата 1 2 4 3 № Функциональная группа Частотный диапазон, см-1 1 -СН2- (алканы) 2850 - 2950 2 =С=О (кетоны, альдегиды) 1700 - 1725 3 -СОО- (сложные эфиры) 1600 - 1660 4 =СН- (алкены) 1500 - 1660
Cлайд 14
 Поляриметрия: определение удельного угла вращения Хроматография в тонком слое сорбента (ТСХ): пятна исследуемой субстанции и стандартного образца должны совпадать по положению, размерам и интенсив-ности свечения Определение Тпл: Вещество [α]D20, ° Тестостерона пропионат +84- +90 (1% в этаноле) Метилтестостерон +162- +168 (1% в этаноле) Нандролона деканоат +35- +40 (1% в этаноле) Вещество Тпл, С° Метилтестостерон +162 - +168 Нандролона деканоат +34 - +38
Поляриметрия: определение удельного угла вращения Хроматография в тонком слое сорбента (ТСХ): пятна исследуемой субстанции и стандартного образца должны совпадать по положению, размерам и интенсив-ности свечения Определение Тпл: Вещество [α]D20, ° Тестостерона пропионат +84- +90 (1% в этаноле) Метилтестостерон +162- +168 (1% в этаноле) Нандролона деканоат +35- +40 (1% в этаноле) Вещество Тпл, С° Метилтестостерон +162 - +168 Нандролона деканоат +34 - +38
Cлайд 15
 Гидроксамовая реакция на сложно-эфирную группу ( тестостерона пропионат) R-CH2-O-CO-C2H5 + NH2OH●HCl → R-CH2-OH + C2H5-CO-NHONa C2H5-CO-NHO- + Cu2+→ (C2H5-CO-NHO)2Cu гидроксамат меди (зеленый)
Гидроксамовая реакция на сложно-эфирную группу ( тестостерона пропионат) R-CH2-O-CO-C2H5 + NH2OH●HCl → R-CH2-OH + C2H5-CO-NHONa C2H5-CO-NHO- + Cu2+→ (C2H5-CO-NHO)2Cu гидроксамат меди (зеленый)
Cлайд 16
 Для обнаружения родственных примесей ЕФ 6.0 рекомендует метод высокоэффективной жидкостной хроматографии (ВЭЖХ) Оценка чистоты Также проводится определение потери в массе при высушивании.
Для обнаружения родственных примесей ЕФ 6.0 рекомендует метод высокоэффективной жидкостной хроматографии (ВЭЖХ) Оценка чистоты Также проводится определение потери в массе при высушивании.
Cлайд 17
 Количественное определение УФ-спектрофотометрия. Испытуемый раствор готовят на этаноле, для расчёта используют удельный показатель поглощения. Рассчитывают содержание вещества из уравнения Бугера-Ламберта-Беера: A = E1%1см·C·l А – величина поглощения при аналитической длине волны; E1%1см – удельный показатель поглощения; С – концентрация испытуемого раствора; l – длина оптического пути.
Количественное определение УФ-спектрофотометрия. Испытуемый раствор готовят на этаноле, для расчёта используют удельный показатель поглощения. Рассчитывают содержание вещества из уравнения Бугера-Ламберта-Беера: A = E1%1см·C·l А – величина поглощения при аналитической длине волны; E1%1см – удельный показатель поглощения; С – концентрация испытуемого раствора; l – длина оптического пути.
Cлайд 18
 Количественное определение Растворяют 25,0 мг исследуемой субстанции в этаноле и доводят раствор тем же растворителем до метки в мерной колбе на 250,0 мл. Разводят 10 мл полученного раствора этанолом в мерной колбе на 100 мл. Измеряют абсорбцию при 241 нм. Рассчитывают содержание C22H32O3 , принимая во внимание, что удельная абсорбция раствора Субстанция тестостерона пропионата содержит не менее 97,0% и не более 103,0 % C22H32O3 в расчете на сухое вещество.
Количественное определение Растворяют 25,0 мг исследуемой субстанции в этаноле и доводят раствор тем же растворителем до метки в мерной колбе на 250,0 мл. Разводят 10 мл полученного раствора этанолом в мерной колбе на 100 мл. Измеряют абсорбцию при 241 нм. Рассчитывают содержание C22H32O3 , принимая во внимание, что удельная абсорбция раствора Субстанция тестостерона пропионата содержит не менее 97,0% и не более 103,0 % C22H32O3 в расчете на сухое вещество.
Cлайд 19
 Хранение По списку Б В хорошо укупоренной таре, предохраняя от действия света и влаги. Для хранения анаболических стероидов требуются специальные условия: температура от + 2 С° до +8 С° полное изолирование от света Применение Андрогены назначают при врождённом недоразвитии мужских половых желез, евнухоидизме, импотенции. Также применяются при раке молочной железы. Форма выпуска: таблетки (метилтестостерон), масляные растворы (тестостерона пропионат). Анаболические стероида назначают при кахексии и прочих нарушениям белкового анаболизма. Также при остеопорозе, переломах костей, в эндокринологии при гипофизарной недостаточности. Формы выпуска: таблетки (метандиенон, метандриол) и масляные растворы (феноболин, ретаболил)
Хранение По списку Б В хорошо укупоренной таре, предохраняя от действия света и влаги. Для хранения анаболических стероидов требуются специальные условия: температура от + 2 С° до +8 С° полное изолирование от света Применение Андрогены назначают при врождённом недоразвитии мужских половых желез, евнухоидизме, импотенции. Также применяются при раке молочной железы. Форма выпуска: таблетки (метилтестостерон), масляные растворы (тестостерона пропионат). Анаболические стероида назначают при кахексии и прочих нарушениям белкового анаболизма. Также при остеопорозе, переломах костей, в эндокринологии при гипофизарной недостаточности. Формы выпуска: таблетки (метандиенон, метандриол) и масляные растворы (феноболин, ретаболил)
Cлайд 20
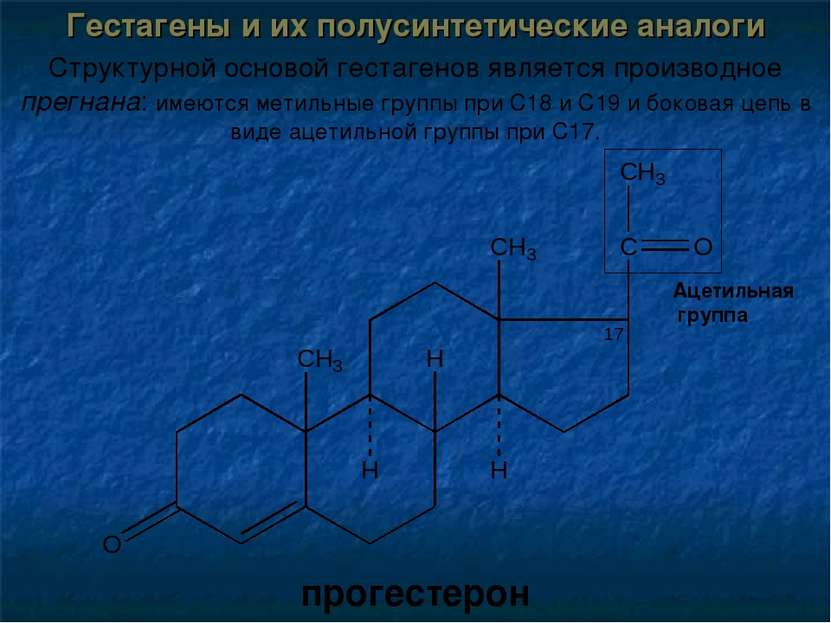
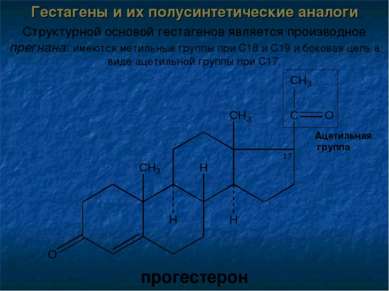 Гестагены и их полусинтетические аналоги Структурной основой гестагенов является производное прегнана: имеются метильные группы при С18 и С19 и боковая цепь в виде ацетильной группы при С17. прогестерон Ацетильная группа
Гестагены и их полусинтетические аналоги Структурной основой гестагенов является производное прегнана: имеются метильные группы при С18 и С19 и боковая цепь в виде ацетильной группы при С17. прогестерон Ацетильная группа
Cлайд 21
 Гестагены (лат. gesto — вынашивать+ греч. genes — порождающий) синтезируются из холестерина в надпочечниках, плаценте и жёлтом теле женщин. Основные физиологические эффекты: возбудимость и сократимость мускулатуры матки и маточных труб выработку фолликулостимулирующего гормона из гипофиза рост и развитие железистой ткани молочных желез секрецию лютеинизирующего гормона Основные патологические эффекты (недостаток): бесплодие нарушение менструального цикла спонтанное прерывание беременности
Гестагены (лат. gesto — вынашивать+ греч. genes — порождающий) синтезируются из холестерина в надпочечниках, плаценте и жёлтом теле женщин. Основные физиологические эффекты: возбудимость и сократимость мускулатуры матки и маточных труб выработку фолликулостимулирующего гормона из гипофиза рост и развитие железистой ткани молочных желез секрецию лютеинизирующего гормона Основные патологические эффекты (недостаток): бесплодие нарушение менструального цикла спонтанное прерывание беременности
Cлайд 22
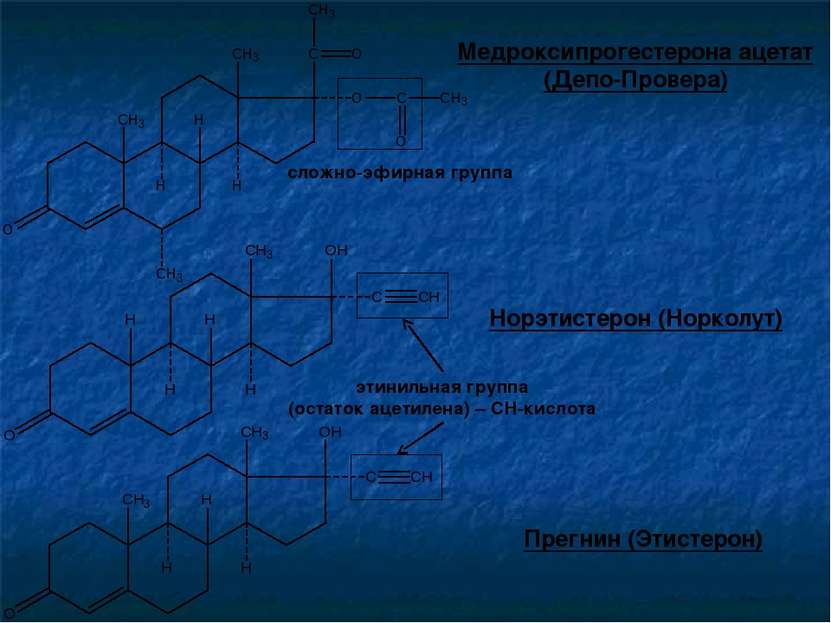
 Лекарственные субстанции гестагенов их полусинтетических аналогов представляют собой белые кристаллические вещества с кремовым оттенком. Они практически не растворимы в воде, мало растворимы в спирте, растворимы в хлороформе и эфире. Лекарственные вещества: Прогестерон Норэтистерон (Норколут) Медроксипрогестерона ацетат Прегнин (Этистерон) (нет в ЕФ 6.0)
Лекарственные субстанции гестагенов их полусинтетических аналогов представляют собой белые кристаллические вещества с кремовым оттенком. Они практически не растворимы в воде, мало растворимы в спирте, растворимы в хлороформе и эфире. Лекарственные вещества: Прогестерон Норэтистерон (Норколут) Медроксипрогестерона ацетат Прегнин (Этистерон) (нет в ЕФ 6.0)
Cлайд 23
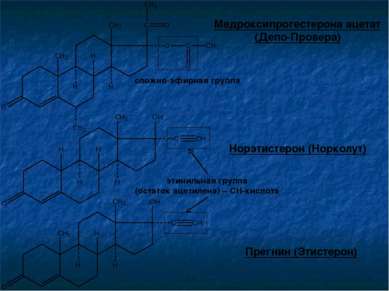 Норэтистерон (Норколут) Медроксипрогестерона ацетат (Депо-Провера) Прегнин (Этистерон) сложно-эфирная группа этинильная группа (остаток ацетилена) – СН-кислота
Норэтистерон (Норколут) Медроксипрогестерона ацетат (Депо-Провера) Прегнин (Этистерон) сложно-эфирная группа этинильная группа (остаток ацетилена) – СН-кислота
Cлайд 24
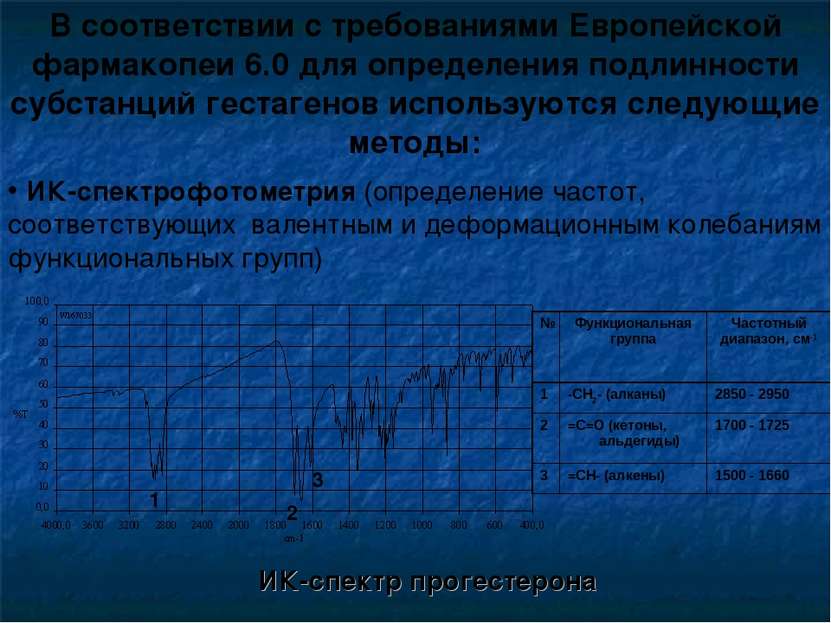
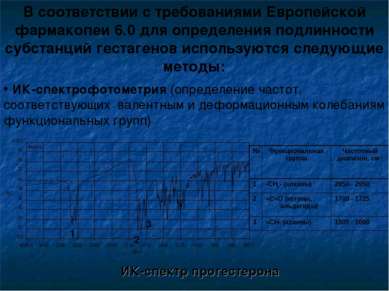 В соответствии с требованиями Европейской фармакопеи 6.0 для определения подлинности субстанций гестагенов используются следующие методы: ИК-спектр прогестерона 1 2 3 ИК-спектрофотометрия (определение частот, соответствующих валентным и деформационным колебаниям функциональных групп) № Функциональная группа Частотный диапазон, см-1 1 -СН2- (алканы) 2850 - 2950 2 =С=О (кетоны, альдегиды) 1700 - 1725 3 =СН- (алкены) 1500 - 1660
В соответствии с требованиями Европейской фармакопеи 6.0 для определения подлинности субстанций гестагенов используются следующие методы: ИК-спектр прогестерона 1 2 3 ИК-спектрофотометрия (определение частот, соответствующих валентным и деформационным колебаниям функциональных групп) № Функциональная группа Частотный диапазон, см-1 1 -СН2- (алканы) 2850 - 2950 2 =С=О (кетоны, альдегиды) 1700 - 1725 3 =СН- (алкены) 1500 - 1660
Cлайд 25
 Поляриметрия: определение удельного угла вращения Хроматография в тонком слое сорбента (ТСХ): пятна исследуемой субстанции и стандартного образца должны совпадать по положению, размерам и интенсивности свечения Вещество [α]D20, ° Прогестерон +186- +194 (1% в этаноле) Медроксипрогестерона ацетат +47- +53 (1% в ацетоне) Норэтистерон -32- -35 (1% в ацетоне)
Поляриметрия: определение удельного угла вращения Хроматография в тонком слое сорбента (ТСХ): пятна исследуемой субстанции и стандартного образца должны совпадать по положению, размерам и интенсивности свечения Вещество [α]D20, ° Прогестерон +186- +194 (1% в этаноле) Медроксипрогестерона ацетат +47- +53 (1% в ацетоне) Норэтистерон -32- -35 (1% в ацетоне)
Cлайд 26
 Для обнаружения родственных примесей ЕФ 6.0 рекомендует метод высокоэффективной жидкостной хроматографии (ВЭЖХ) Оценка чистоты Также проводится определение потери в массе при высушивании.
Для обнаружения родственных примесей ЕФ 6.0 рекомендует метод высокоэффективной жидкостной хроматографии (ВЭЖХ) Оценка чистоты Также проводится определение потери в массе при высушивании.
Cлайд 27
 Количественное определение УФ-спектрофотометрия (прогестерон, медроксипрогестерона ацетат) Испытуемый раствор готовят на этаноле, для расчёта используют удельный показатель поглощения. Рассчитывают содержание вещества из уравнения Бугера-Ламберта-Беера: A = E1%1см·C·l А – величина поглощения при аналитической длине волны; E1%1см – удельный показатель поглощения; С – концентрация испытуемого раствора; l – длина оптического пути.
Количественное определение УФ-спектрофотометрия (прогестерон, медроксипрогестерона ацетат) Испытуемый раствор готовят на этаноле, для расчёта используют удельный показатель поглощения. Рассчитывают содержание вещества из уравнения Бугера-Ламберта-Беера: A = E1%1см·C·l А – величина поглощения при аналитической длине волны; E1%1см – удельный показатель поглощения; С – концентрация испытуемого раствора; l – длина оптического пути.
Cлайд 28
 Количественное определение Норэтистерон проявляет слабые кислотные свойства за счёт наличия в структуре остатка ацетилена: Точную навеску норэтистерона растворяют в тетрагидрофуране, добавляют небольшой избыток раствора AgNO3 : Выделившуюся в эквивалентном количестве азотную кислоту оттитровывают гидроксидом натрия: HNO3 + NaOH NaNO3 + H2O КТТ определяется потенциометрически 2AgNO3 +2 NaOH 2NaNO3 + H2O + Ag2O
Количественное определение Норэтистерон проявляет слабые кислотные свойства за счёт наличия в структуре остатка ацетилена: Точную навеску норэтистерона растворяют в тетрагидрофуране, добавляют небольшой избыток раствора AgNO3 : Выделившуюся в эквивалентном количестве азотную кислоту оттитровывают гидроксидом натрия: HNO3 + NaOH NaNO3 + H2O КТТ определяется потенциометрически 2AgNO3 +2 NaOH 2NaNO3 + H2O + Ag2O
Cлайд 29
 Хранение По списку Б В хорошо укупоренной таре, предохраняя от действия света Применение Назначают при аменорее, бесплодии, маточных кровотечениях, мастопатии и т.д. Выпускаются в виде таблеток (прегнин, норколут), масляных растворов (прогестерон), капсул, мазей. Медроксипрогестерон применяется как контрацептив и проявляет противоопухолевое действие (при раке матки или молочной железы). Выпускается в виде суспензионных растворов, таблеток.
Хранение По списку Б В хорошо укупоренной таре, предохраняя от действия света Применение Назначают при аменорее, бесплодии, маточных кровотечениях, мастопатии и т.д. Выпускаются в виде таблеток (прегнин, норколут), масляных растворов (прогестерон), капсул, мазей. Медроксипрогестерон применяется как контрацептив и проявляет противоопухолевое действие (при раке матки или молочной железы). Выпускается в виде суспензионных растворов, таблеток.
Cлайд 31
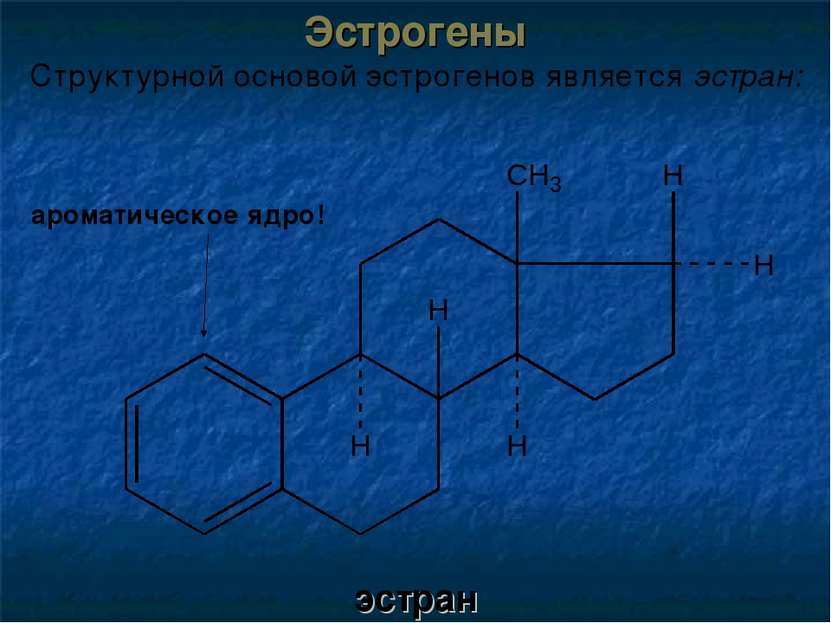
 Эстрогены (от греч. oistros - возбуждение и genos - рождающий) вырабатываются в яичниках во время полового созревания и синтезируется в фолликулах до наступления климактерического периода. Отвечают за развитие вторичных половых признаков у женщин. Известны три природных эстрогена: эстрон, эстрадиол и эстриол. Основные физиологические эффекты: синтез факторов свёртывания крови уровень тироксина, Fe2+ и Cu2+ в плазме крови холестерина вызывают задержку Na+ и воды в организме
Эстрогены (от греч. oistros - возбуждение и genos - рождающий) вырабатываются в яичниках во время полового созревания и синтезируется в фолликулах до наступления климактерического периода. Отвечают за развитие вторичных половых признаков у женщин. Известны три природных эстрогена: эстрон, эстрадиол и эстриол. Основные физиологические эффекты: синтез факторов свёртывания крови уровень тироксина, Fe2+ и Cu2+ в плазме крови холестерина вызывают задержку Na+ и воды в организме
Cлайд 32
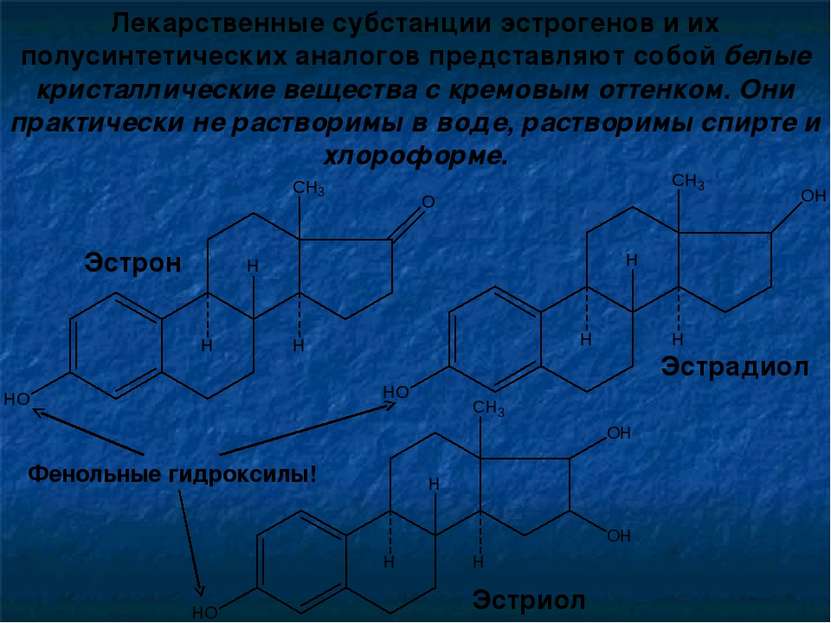
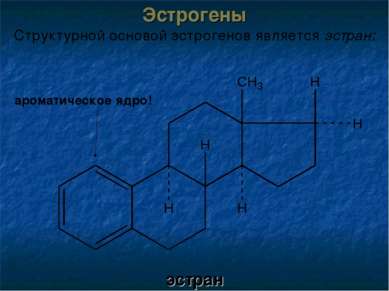
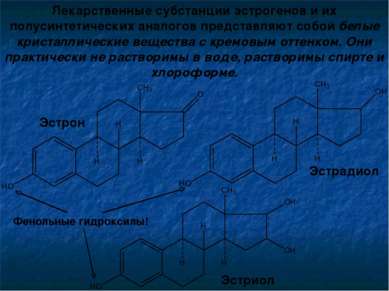 Лекарственные субстанции эстрогенов и их полусинтетических аналогов представляют собой белые кристаллические вещества с кремовым оттенком. Они практически не растворимы в воде, растворимы спирте и хлороформе. Эстрон Эстрадиол Эстриол Фенольные гидроксилы!
Лекарственные субстанции эстрогенов и их полусинтетических аналогов представляют собой белые кристаллические вещества с кремовым оттенком. Они практически не растворимы в воде, растворимы спирте и хлороформе. Эстрон Эстрадиол Эстриол Фенольные гидроксилы!
Cлайд 33
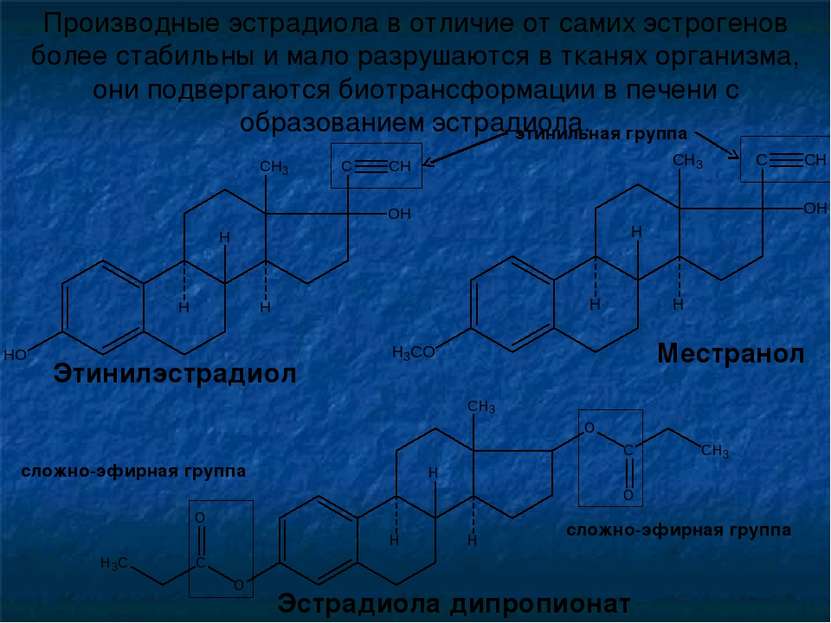
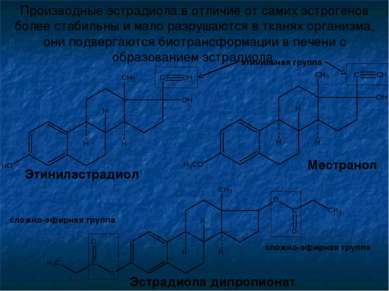 Производные эстрадиола в отличие от самих эстрогенов более стабильны и мало разрушаются в тканях организма, они подвергаются биотрансформации в печени с образованием эстрадиола. Эстрадиола дипропионат Местранол Этинилэстрадиол этинильная группа сложно-эфирная группа сложно-эфирная группа
Производные эстрадиола в отличие от самих эстрогенов более стабильны и мало разрушаются в тканях организма, они подвергаются биотрансформации в печени с образованием эстрадиола. Эстрадиола дипропионат Местранол Этинилэстрадиол этинильная группа сложно-эфирная группа сложно-эфирная группа
Cлайд 34
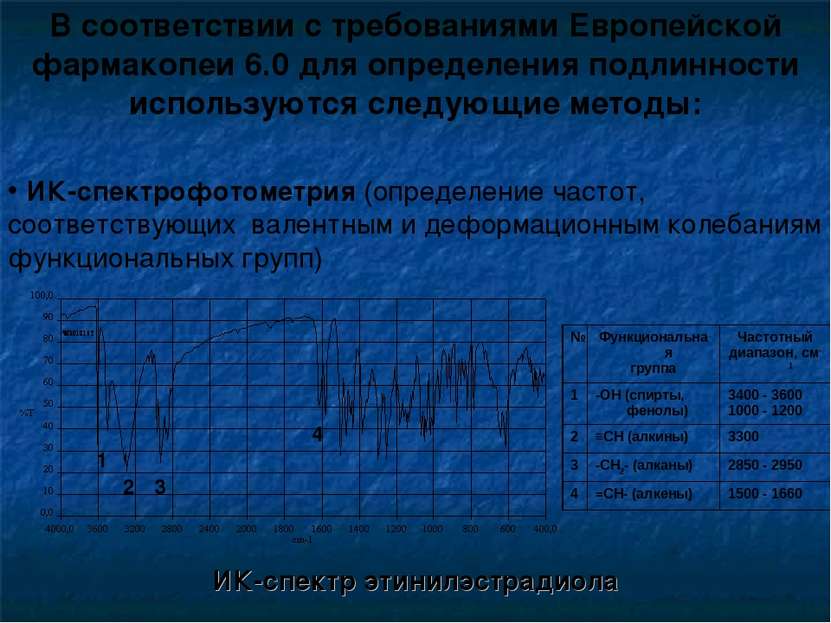
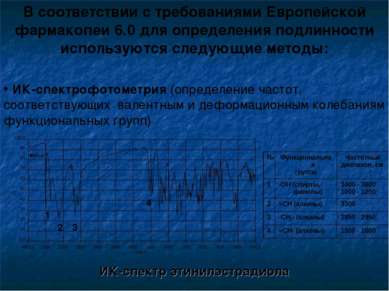 В соответствии с требованиями Европейской фармакопеи 6.0 для определения подлинности используются следующие методы: ИК-спектрофотометрия (определение частот, соответствующих валентным и деформационным колебаниям функциональных групп) ИК-спектр этинилэстрадиола 1 2 3 4 № Функциональная группа Частотный диапазон, см-1 1 -ОН (спирты, фенолы) 3400 - 3600 1000 - 1200 2 ≡СН (алкины) 3300 3 -СН2- (алканы) 2850 - 2950 4 =СН- (алкены) 1500 - 1660
В соответствии с требованиями Европейской фармакопеи 6.0 для определения подлинности используются следующие методы: ИК-спектрофотометрия (определение частот, соответствующих валентным и деформационным колебаниям функциональных групп) ИК-спектр этинилэстрадиола 1 2 3 4 № Функциональная группа Частотный диапазон, см-1 1 -ОН (спирты, фенолы) 3400 - 3600 1000 - 1200 2 ≡СН (алкины) 3300 3 -СН2- (алканы) 2850 - 2950 4 =СН- (алкены) 1500 - 1660
Cлайд 35
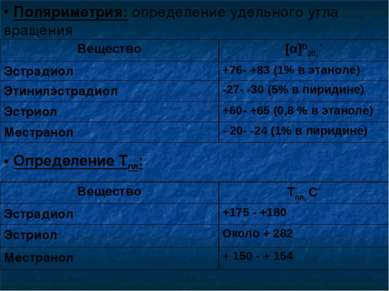 Поляриметрия: определение удельного угла вращения Определение Тпл: Вещество [α]D20, ° Эстрадиол +76- +83 (1% в этаноле) Этинилэстрадиол -27- -30 (5% в пиридине) Эстриол +60- +65 (0,8 % в этаноле) Местранол - 20- -24 (1% в пиридине) Вещество Тпл, С° Эстрадиол +175 - +180 Эстриол Около + 282 Местранол + 150 - + 154
Поляриметрия: определение удельного угла вращения Определение Тпл: Вещество [α]D20, ° Эстрадиол +76- +83 (1% в этаноле) Этинилэстрадиол -27- -30 (5% в пиридине) Эстриол +60- +65 (0,8 % в этаноле) Местранол - 20- -24 (1% в пиридине) Вещество Тпл, С° Эстрадиол +175 - +180 Эстриол Около + 282 Местранол + 150 - + 154
Cлайд 36
 Хроматография в тонком слое сорбента (ТСХ): пятна исследуемой субстанции и стандартного образца должны совпадать по положению, размерам и интенсивности свечения. Оценка чистоты Для обнаружения родственных примесей ЕФ 6.0 рекомендует метод высокоэффективной жидкостной хроматографии (ВЭЖХ). Для местранола применяется ТСХ. Также проводится определение потери в массе при высушивании.
Хроматография в тонком слое сорбента (ТСХ): пятна исследуемой субстанции и стандартного образца должны совпадать по положению, размерам и интенсивности свечения. Оценка чистоты Для обнаружения родственных примесей ЕФ 6.0 рекомендует метод высокоэффективной жидкостной хроматографии (ВЭЖХ). Для местранола применяется ТСХ. Также проводится определение потери в массе при высушивании.
Cлайд 37
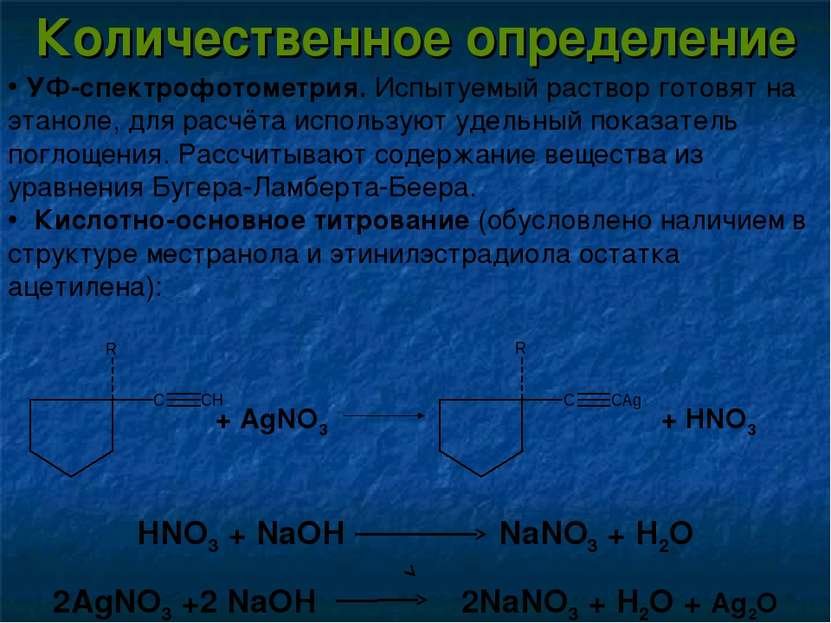
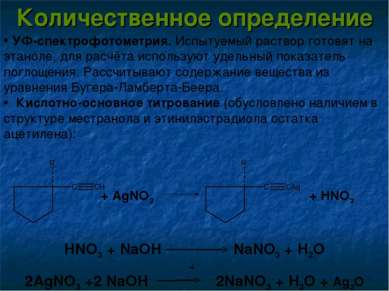 Количественное определение УФ-спектрофотометрия. Испытуемый раствор готовят на этаноле, для расчёта используют удельный показатель поглощения. Рассчитывают содержание вещества из уравнения Бугера-Ламберта-Беера. Кислотно-основное титрование (обусловлено наличием в структуре местранола и этинилэстрадиола остатка ацетилена): HNO3 + NaOH NaNO3 + H2O 2AgNO3 +2 NaOH 2NaNO3 + H2O + Ag2O
Количественное определение УФ-спектрофотометрия. Испытуемый раствор готовят на этаноле, для расчёта используют удельный показатель поглощения. Рассчитывают содержание вещества из уравнения Бугера-Ламберта-Беера. Кислотно-основное титрование (обусловлено наличием в структуре местранола и этинилэстрадиола остатка ацетилена): HNO3 + NaOH NaNO3 + H2O 2AgNO3 +2 NaOH 2NaNO3 + H2O + Ag2O
Cлайд 38
 Хранение По списку Б В хорошо укупоренной таре, предохраняя от действия света и влаги Применение Эстрогены применяют для заместительной гормональной терапии климактерического периода, при слабости родовой деятельности, недоразвитости развития половых органов у девочек и т.д. Формы выпуска: таблетки (эстрадиол, этинилэстрадиол), масляные растворы (эстрадиола дипропионат), трансдермальные формы (эстрадиол).
Хранение По списку Б В хорошо укупоренной таре, предохраняя от действия света и влаги Применение Эстрогены применяют для заместительной гормональной терапии климактерического периода, при слабости родовой деятельности, недоразвитости развития половых органов у девочек и т.д. Формы выпуска: таблетки (эстрадиол, этинилэстрадиол), масляные растворы (эстрадиола дипропионат), трансдермальные формы (эстрадиол).
Cлайд 39
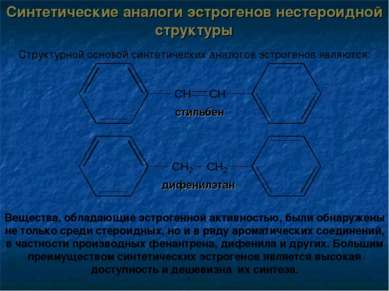 Синтетические аналоги эстрогенов нестероидной структуры Структурной основой синтетических аналогов эстрогенов являются: дифенилэтан стильбен Вещества, обладающие эстрогенной активностью, были обнаружены не только среди стероидных, но и в ряду ароматических соединений, в частности производных фенантрена, дифенила и других. Большим преимуществом синтетических эстрогенов является высокая доступность и дешевизна их синтеза.
Синтетические аналоги эстрогенов нестероидной структуры Структурной основой синтетических аналогов эстрогенов являются: дифенилэтан стильбен Вещества, обладающие эстрогенной активностью, были обнаружены не только среди стероидных, но и в ряду ароматических соединений, в частности производных фенантрена, дифенила и других. Большим преимуществом синтетических эстрогенов является высокая доступность и дешевизна их синтеза.
Cлайд 40
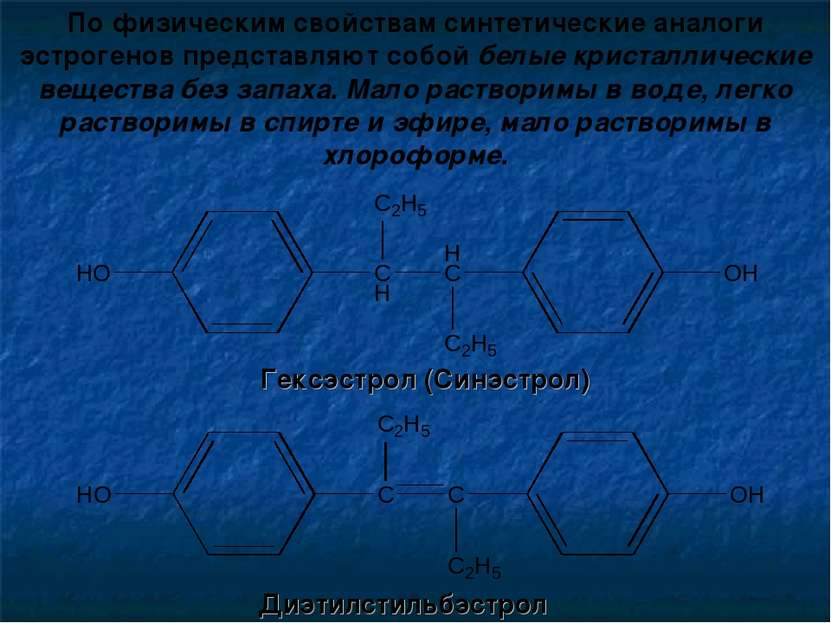
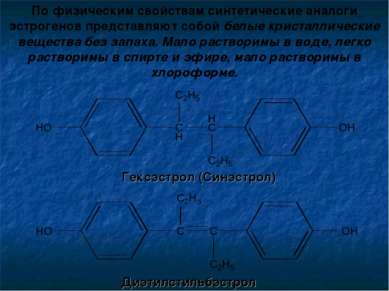 По физическим свойствам синтетические аналоги эстрогенов представляют собой белые кристаллические вещества без запаха. Мало растворимы в воде, легко растворимы в спирте и эфире, мало растворимы в хлороформе. Гексэстрол (Синэстрол) Диэтилстильбэстрол
По физическим свойствам синтетические аналоги эстрогенов представляют собой белые кристаллические вещества без запаха. Мало растворимы в воде, легко растворимы в спирте и эфире, мало растворимы в хлороформе. Гексэстрол (Синэстрол) Диэтилстильбэстрол
Cлайд 41
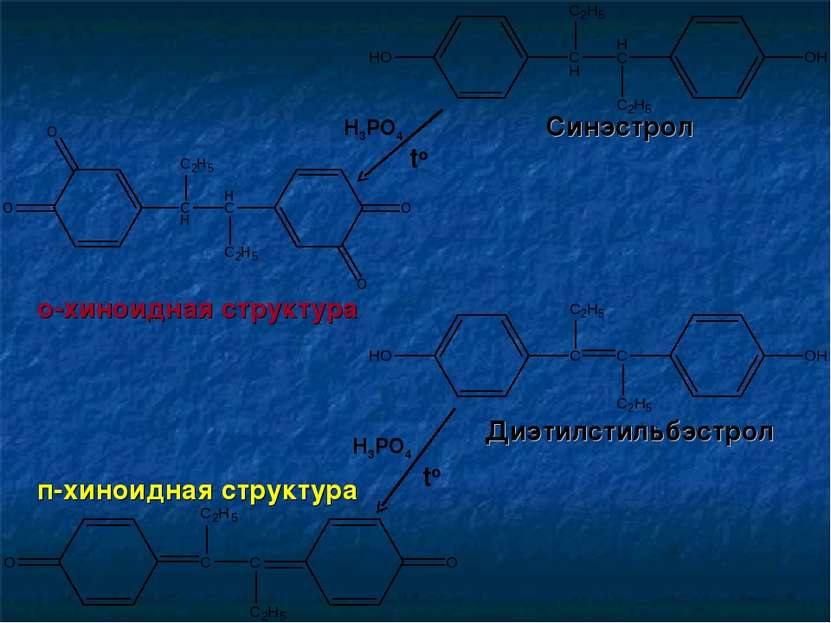
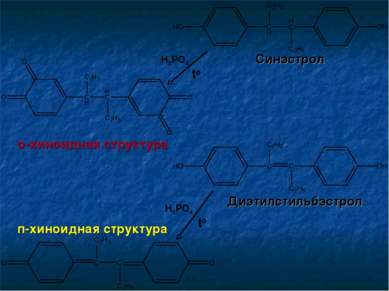
 Определение подлинности Химическая реакция: Навеску вещества растворяют в ледяной уксусной кислоте, добавляют 5-10 капель концентрированной Н3РО4 и нагревают на кипящей водяной бане в течение 3 минут. Диэтилстильбэстрол приобретает жёлтое окрашивание Синэстрол приобретает красно-фиолетовое окрашивание Реакция основана на окислении фенольных гидроксилов до о-хинонов и п-хинонов, для которых характерна яркая окраска.
Определение подлинности Химическая реакция: Навеску вещества растворяют в ледяной уксусной кислоте, добавляют 5-10 капель концентрированной Н3РО4 и нагревают на кипящей водяной бане в течение 3 минут. Диэтилстильбэстрол приобретает жёлтое окрашивание Синэстрол приобретает красно-фиолетовое окрашивание Реакция основана на окислении фенольных гидроксилов до о-хинонов и п-хинонов, для которых характерна яркая окраска.
Cлайд 43
 Определение подлинности Инструментальные методы: Спектрофотометрия в ИК-области Спектрофотометрия в УФ-области (для диэтилстильбэстрола λmax при 292 нм и 418 нм) Хроматография в тонком слое сорбента (ТСХ) Оценка чистоты Для синэстрола – ТСХ Для диэтилстильбэстрола – ВЭЖХ Также проводится определение потери в массе при высушивании и сульфатной золы.
Определение подлинности Инструментальные методы: Спектрофотометрия в ИК-области Спектрофотометрия в УФ-области (для диэтилстильбэстрола λmax при 292 нм и 418 нм) Хроматография в тонком слое сорбента (ТСХ) Оценка чистоты Для синэстрола – ТСХ Для диэтилстильбэстрола – ВЭЖХ Также проводится определение потери в массе при высушивании и сульфатной золы.
Cлайд 44
 Количественное определение УФ-спектрофотометрия. Испытуемый раствор готовят на этаноле. Для сравнения готовят раствор стандартного образца. Содержание действующего вещества рассчитывают из величин абсорбции испытуемого раствора и раствора сравнения исходя из уравнения Бугера-Ламберта-Беера: Ast = E1%1см·Cst·l Ax = E1%1см·Cx·l Ast Cst · Ax Cx= ·100% Ast Cst Ax Cx =
Количественное определение УФ-спектрофотометрия. Испытуемый раствор готовят на этаноле. Для сравнения готовят раствор стандартного образца. Содержание действующего вещества рассчитывают из величин абсорбции испытуемого раствора и раствора сравнения исходя из уравнения Бугера-Ламберта-Беера: Ast = E1%1см·Cst·l Ax = E1%1см·Cx·l Ast Cst · Ax Cx= ·100% Ast Cst Ax Cx =
Cлайд 45
 Хранение Применение Показания к применению синтетических аналогов эстрогенов схожи с таковыми для эстрона и других эстрогенных гормонов Формы выпуска: таблетки, масляные растворы. В настоящее время применение ограничено из-за множества побочных действий По списку Б В хорошо укупоренной таре, предохраняя от действия света и влаги
Хранение Применение Показания к применению синтетических аналогов эстрогенов схожи с таковыми для эстрона и других эстрогенных гормонов Формы выпуска: таблетки, масляные растворы. В настоящее время применение ограничено из-за множества побочных действий По списку Б В хорошо укупоренной таре, предохраняя от действия света и влаги