X
Код презентации скопируйте его
Таргетная терапия у онкологических больных
Скачать эту презентациюПрезентация на тему Таргетная терапия у онкологических больных
Скачать эту презентациюCлайд 2
 Определение ТАРГЕТНАЯ терапия в онкологии – это терапия направленного действия, то есть, воздействия на опухолевые «мишени» (белки, рецепторы, гены), имеющие важнейшее («критическое») значение для развития новообразования. Благодаря направленному действию целевые препараты поражают в основном опухолевые клетки и практически не повреждают здоровые органы и ткани, на которых мишени отсутствуют или их повреждение не является критичным.
Определение ТАРГЕТНАЯ терапия в онкологии – это терапия направленного действия, то есть, воздействия на опухолевые «мишени» (белки, рецепторы, гены), имеющие важнейшее («критическое») значение для развития новообразования. Благодаря направленному действию целевые препараты поражают в основном опухолевые клетки и практически не повреждают здоровые органы и ткани, на которых мишени отсутствуют или их повреждение не является критичным.
Cлайд 3
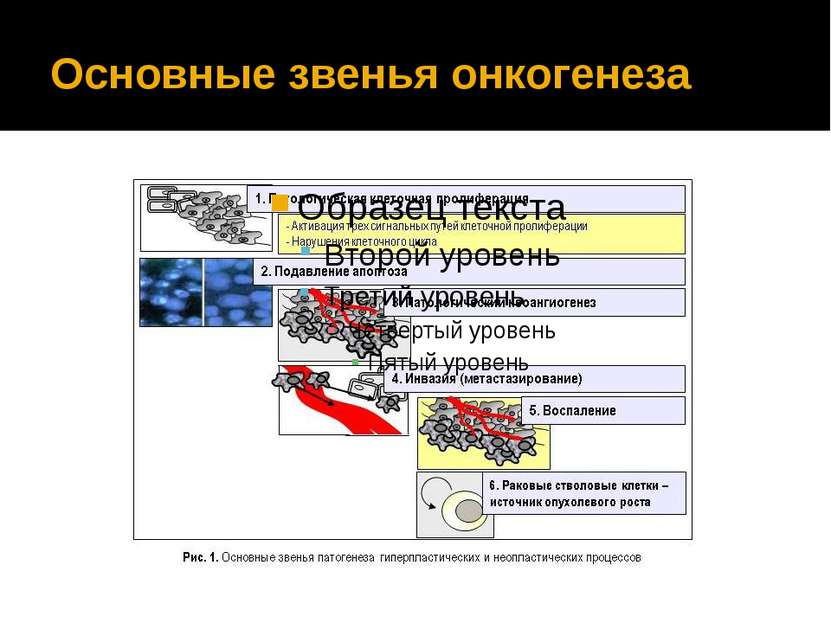
 Онкогенез Онкогенез-многоступенчатый процесс включает в себя: генетические изменения трансформация нормальных клеток в опухолевые (нарушение клеточной пролиферации, ангиогенеза, апоптоза) При целевой терапии проводят точечное воздействие на указанные выше причины онкогенеза.
Онкогенез Онкогенез-многоступенчатый процесс включает в себя: генетические изменения трансформация нормальных клеток в опухолевые (нарушение клеточной пролиферации, ангиогенеза, апоптоза) При целевой терапии проводят точечное воздействие на указанные выше причины онкогенеза.
Cлайд 5
 Механизм действия Предназначенные для таргентной терапии препараты обладают разными механизмами действия. Некоторые из них являются моноклональными антителами -молекулами, подобными тем, которые возникают в организме как иммунный ответ на инфекционное вторжение . Другие подавляют функцию ферментов, которые участвуют в передаче сигнала, необходимого для запуска деления клетки. Третьи – блокируют образование новых сосудов в опухоли, необходимых для ее питания и роста. Таким образом, каждый препарат направленно воздействует на какую-то одну мишень, играющую ключевую роль в развитии опухолевой клетки.
Механизм действия Предназначенные для таргентной терапии препараты обладают разными механизмами действия. Некоторые из них являются моноклональными антителами -молекулами, подобными тем, которые возникают в организме как иммунный ответ на инфекционное вторжение . Другие подавляют функцию ферментов, которые участвуют в передаче сигнала, необходимого для запуска деления клетки. Третьи – блокируют образование новых сосудов в опухоли, необходимых для ее питания и роста. Таким образом, каждый препарат направленно воздействует на какую-то одну мишень, играющую ключевую роль в развитии опухолевой клетки.
Cлайд 6
 Механизм действия Строение рецепторов фактора роста: - экстрацеллюлярный домен, ответсвенный за соединение с лигандом (фактором роста) - трансмембранная липофильная часть - интрацеллюлярный домен, представляющий собой тирозинсодержащие киназы, с активации которых начинается каскад последующих реакций по передаче сигнала на белки‐переносчики В норме после связывания EGFR c соответствующим лигандом и VEGF с соотвествующим рецептором VEGFR происходит активация рецепторов, что индуцирует последующую активацию нескольких сигнальных путей (RAS/RAF/MAPK, STAT , PI3K/Akt), для трансдукции митогенного сигнала от рецептора к ядру клетки (рис 1.)
Механизм действия Строение рецепторов фактора роста: - экстрацеллюлярный домен, ответсвенный за соединение с лигандом (фактором роста) - трансмембранная липофильная часть - интрацеллюлярный домен, представляющий собой тирозинсодержащие киназы, с активации которых начинается каскад последующих реакций по передаче сигнала на белки‐переносчики В норме после связывания EGFR c соответствующим лигандом и VEGF с соотвествующим рецептором VEGFR происходит активация рецепторов, что индуцирует последующую активацию нескольких сигнальных путей (RAS/RAF/MAPK, STAT , PI3K/Akt), для трансдукции митогенного сигнала от рецептора к ядру клетки (рис 1.)
Cлайд 7
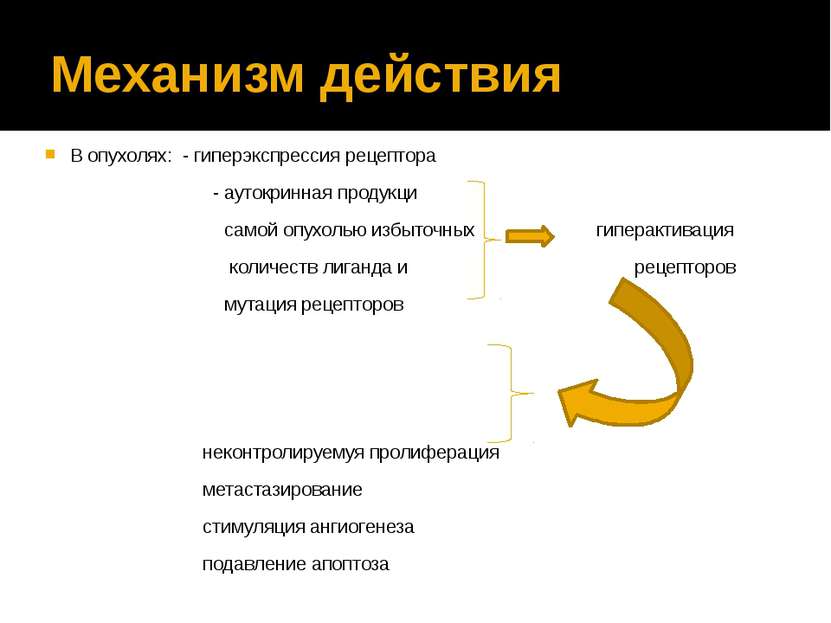
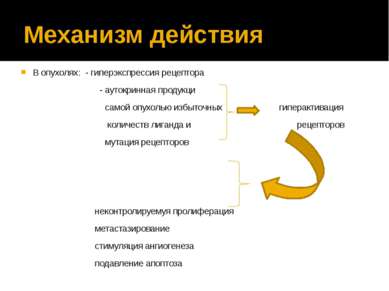 Механизм действия В опухолях: - гиперэкспрессия рецептора - аутокринная продукци самой опухолью избыточных гиперактивация количеств лиганда и рецепторов мутация рецепторов неконтролируемуя пролиферация метастазирование стимуляция ангиогенеза подавление апоптоза
Механизм действия В опухолях: - гиперэкспрессия рецептора - аутокринная продукци самой опухолью избыточных гиперактивация количеств лиганда и рецепторов мутация рецепторов неконтролируемуя пролиферация метастазирование стимуляция ангиогенеза подавление апоптоза
Cлайд 8
 Таргтные препараты Исходя из этих данных, в качестве противоопухолевых агентов предложено использовать моноклональные антитела к: - EGFR (цетуксимаб, панитумумаб) – блок сигнальных путей, апоптоз - VEGF (бевацизумаб) реагирует с участком VEGF, ответственным за связывание с соответствующим рецептором, что блокирует образование ангиогенного сигнала и, как следствие подавляет неоангиогенез.
Таргтные препараты Исходя из этих данных, в качестве противоопухолевых агентов предложено использовать моноклональные антитела к: - EGFR (цетуксимаб, панитумумаб) – блок сигнальных путей, апоптоз - VEGF (бевацизумаб) реагирует с участком VEGF, ответственным за связывание с соответствующим рецептором, что блокирует образование ангиогенного сигнала и, как следствие подавляет неоангиогенез.
Cлайд 9
 Таргетные препараты к семейству рецепторов эпидермального фактора роста ІІ типа также относят рецептор Her-2/neu, присутствующий и в нормальных тканях молочной железы человека — в среднем 20 000–50 000 рецепторов на поверхности клетки, однако их количество возрастает до 1 000 000 и более на поверхности раковых клеток(HER2-позитивный рак груди) Герцептин – очень эффективный препарат в лечении HER2-позитивного рака груди у женщин на II, III и IV стадиях рака. Герцептин назначается обычно внутривенно один раз в 1 – 3 недели.
Таргетные препараты к семейству рецепторов эпидермального фактора роста ІІ типа также относят рецептор Her-2/neu, присутствующий и в нормальных тканях молочной железы человека — в среднем 20 000–50 000 рецепторов на поверхности клетки, однако их количество возрастает до 1 000 000 и более на поверхности раковых клеток(HER2-позитивный рак груди) Герцептин – очень эффективный препарат в лечении HER2-позитивного рака груди у женщин на II, III и IV стадиях рака. Герцептин назначается обычно внутривенно один раз в 1 – 3 недели.
Cлайд 10
 Механизм действия герцептина Герцептин представляет собой особые антитела, которые прикрепляются к HER2-рецепторам раковых клеток, в результате чего они не могут получать необходимый для их роста сигнал. Кроме того, герцептин помогает иммунной системе пациентки распознавать раковые клетки и уничтожать их.
Механизм действия герцептина Герцептин представляет собой особые антитела, которые прикрепляются к HER2-рецепторам раковых клеток, в результате чего они не могут получать необходимый для их роста сигнал. Кроме того, герцептин помогает иммунной системе пациентки распознавать раковые клетки и уничтожать их.
Cлайд 11
 Просто примите таблетку Подавляющее число препаратов для таргетной терапии выпускается в виде таблеток. Это позволяет больным не находиться в стационаре и зачастую чувствовать себя настолько хорошо, чтобы продолжать работать. Несомненным преимуществом является также и низкая токсичность, не требующая частого контроля показателей крови, госпитализации при развитии осложнений.
Просто примите таблетку Подавляющее число препаратов для таргетной терапии выпускается в виде таблеток. Это позволяет больным не находиться в стационаре и зачастую чувствовать себя настолько хорошо, чтобы продолжать работать. Несомненным преимуществом является также и низкая токсичность, не требующая частого контроля показателей крови, госпитализации при развитии осложнений.
Cлайд 12
 Благодаря усилиям ученых сегодня в клинической практике уже используется более 10 препаратов с молекулярно- направленным действием. Несколько десятков проходят апробацию в клинических исследованиях. Их появление на фармацевтическом рынке ожидается в ближайшие годы. Параллельно продолжается процесс изучения молекулярно-генетических особенностей опухолевой клетки. Он позволит пролить свет на уязвимые звенья ее развития и создать арсенал препаратов, достаточный не только для подавления роста, но и для полного разрушения злокачественных клеток. А это вселяет надежду на излечение человечества от столь грозного заболевания, как рак.
Благодаря усилиям ученых сегодня в клинической практике уже используется более 10 препаратов с молекулярно- направленным действием. Несколько десятков проходят апробацию в клинических исследованиях. Их появление на фармацевтическом рынке ожидается в ближайшие годы. Параллельно продолжается процесс изучения молекулярно-генетических особенностей опухолевой клетки. Он позволит пролить свет на уязвимые звенья ее развития и создать арсенал препаратов, достаточный не только для подавления роста, но и для полного разрушения злокачественных клеток. А это вселяет надежду на излечение человечества от столь грозного заболевания, как рак.