X
Код презентации скопируйте его
Водород
Скачать эту презентациюПрезентация на тему Водород
Скачать эту презентациюCлайд 1
 Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Барсуков Д. Б. г. Кемерово ВОДОРОД
Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Барсуков Д. Б. г. Кемерово ВОДОРОД
Cлайд 2
 Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г.осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Выделение горючего газа при взаимодействии кислот и металлов наблюдали в XVI и XVII веках на заре становления химии как науки. Прямо указывал на выделение его и Михаил Васильевич Ломоносов, но уже определённо сознавая, что это не флогистон. Английский физик и химик Генри Кавендиш в 1766 году исследовал этот газ и назвал его «горючим воздухом». При сжигании «горючий воздух» давал воду, но приверженность Кавендиша теории флогистона помешала ему сделать правильные выводы. Французский химик Антуан Лавуазье совместно с инженером Ж. Менье, используя специальные газометры, в 1783 г.осуществил синтез воды, а затем и её анализ, разложив водяной пар раскалённым железом. Таким образом он установил, что «горючий воздух» входит в состав воды и может быть из неё получен.
Cлайд 3
 Обычный водородный атом (протий) состоит из двух фундаментальных частиц (протона и электрона) и имеет атомную массу 1. Водород сходен со щелочными металлами в том, что все эти элементы способны отдавать электрон атому-акцептору для образования химической связи.
Обычный водородный атом (протий) состоит из двух фундаментальных частиц (протона и электрона) и имеет атомную массу 1. Водород сходен со щелочными металлами в том, что все эти элементы способны отдавать электрон атому-акцептору для образования химической связи.
Cлайд 4
 На электронной орбите атома водорода могут находиться 2 электрона, поэтому водород способен также принимать электрон, образуя отрицательный ион Н–, гидрид-ион, и это роднит водород с галогенами, для которых характерно принятие электрона с образованием отрицательного галогенид-иона типа Cl–. Дуализм водорода находит отражение в том, что в периодической таблице элементов его располагают в IA подгруппе (щелочные металлы), а иногда – в VIIA подгруппе (галогены).
На электронной орбите атома водорода могут находиться 2 электрона, поэтому водород способен также принимать электрон, образуя отрицательный ион Н–, гидрид-ион, и это роднит водород с галогенами, для которых характерно принятие электрона с образованием отрицательного галогенид-иона типа Cl–. Дуализм водорода находит отражение в том, что в периодической таблице элементов его располагают в IA подгруппе (щелочные металлы), а иногда – в VIIA подгруппе (галогены).
Cлайд 5
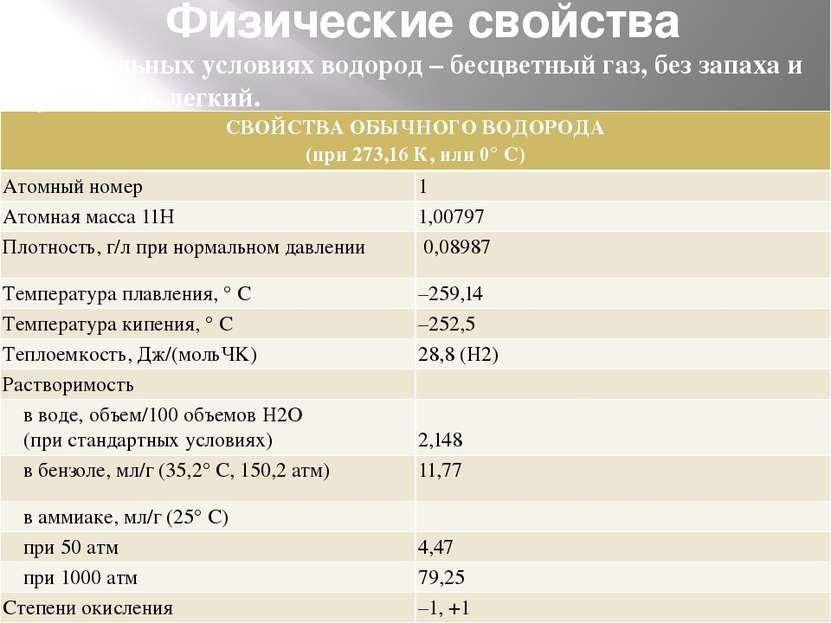
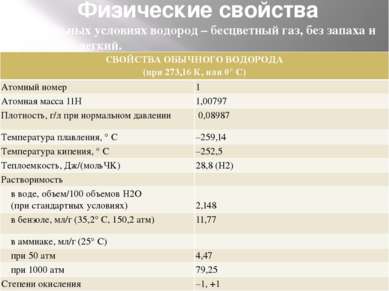 Физические свойства В нормальных условиях водород – бесцветный газ, без запаха и вкуса, очень легкий. СВОЙСТВА ОБЫЧНОГО ВОДОРОДА (при 273,16 К, или 0°С) Атомный номер 1 Атомная масса 11Н 1,00797 Плотность,г/лпри нормальном давлении 0,08987 Температура плавления, ° С –259,14 Температура кипения, ° С –252,5 Теплоемкость, Дж/(мольЧK) 28,8 (H2) Растворимость в воде, объем/100 объемов H2O (при стандартных условиях) 2,148 в бензоле, мл/г (35,2° С, 150,2 атм) 11,77 в аммиаке, мл/г (25° С) при 50 атм 4,47 при 1000 атм 79,25 Степени окисления –1, +1
Физические свойства В нормальных условиях водород – бесцветный газ, без запаха и вкуса, очень легкий. СВОЙСТВА ОБЫЧНОГО ВОДОРОДА (при 273,16 К, или 0°С) Атомный номер 1 Атомная масса 11Н 1,00797 Плотность,г/лпри нормальном давлении 0,08987 Температура плавления, ° С –259,14 Температура кипения, ° С –252,5 Теплоемкость, Дж/(мольЧK) 28,8 (H2) Растворимость в воде, объем/100 объемов H2O (при стандартных условиях) 2,148 в бензоле, мл/г (35,2° С, 150,2 атм) 11,77 в аммиаке, мл/г (25° С) при 50 атм 4,47 при 1000 атм 79,25 Степени окисления –1, +1
Cлайд 6
 Правила обращения Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение. Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % объёмных.
Правила обращения Водород при смеси с воздухом образует взрывоопасную смесь — так называемый гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении водорода и кислорода 2:1, или водорода и воздуха приближённо 2:5, так как в воздухе кислорода содержится примерно 21 %. Также водород пожароопасен. Жидкий водород при попадании на кожу может вызвать сильное обморожение. Взрывоопасные концентрации водорода с кислородом возникают от 4 % до 96 % объёмных. При смеси с воздухом от 4 % до 75 (74) % объёмных.
Cлайд 7
 Химические свойства при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция: Са + Н2 = СаН2 и с единственным неметаллом — фтором, образуя фтороводород: F2 + H2 = 2HF
Химические свойства при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция: Са + Н2 = СаН2 и с единственным неметаллом — фтором, образуя фтороводород: F2 + H2 = 2HF
Cлайд 8
 С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении: О2 + 2Н2 = 2Н2О. Он может «отнимать» кислород от некоторых оксидов, например: CuO + Н2 = Cu + H2O Записанное уравнение отражает восстановительные свойства водорода. N2 + 3H2 → 2NH3
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении: О2 + 2Н2 = 2Н2О. Он может «отнимать» кислород от некоторых оксидов, например: CuO + Н2 = Cu + H2O Записанное уравнение отражает восстановительные свойства водорода. N2 + 3H2 → 2NH3
Cлайд 9
 Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2Na + H2 → 2NaH Ca + H2 → CaH2 Гидриды — солеобразные, твёрдые вещества, легко гидролизуются: CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2Na + H2 → 2NaH Ca + H2 → CaH2 Гидриды — солеобразные, твёрдые вещества, легко гидролизуются: CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Cлайд 10
 Получение водорода В промышленности 1.Электролиз водных растворов солей: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C: H2O + С ⇄ H2 + СО 3.Из природного газа. Конверсия с водяным паром: CH4 + H2O ⇄ CO + 3H2 (1000 °C) Каталитическое окисление кислородом: 2CH4 + O2 ⇄ 2CO + 4H2
Получение водорода В промышленности 1.Электролиз водных растворов солей: 2NaCl + 2H2O → H2↑ + 2NaOH + Cl2 2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C: H2O + С ⇄ H2 + СО 3.Из природного газа. Конверсия с водяным паром: CH4 + H2O ⇄ CO + 3H2 (1000 °C) Каталитическое окисление кислородом: 2CH4 + O2 ⇄ 2CO + 4H2
Cлайд 11
 В лаборатории 1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту: Zn + HCl→ ZnCl2 + H2↑ 2.Взаимодействие кальция с водой: Ca + 2H2O → Ca(OH)2 + H2↑ 3.Гидролиз гидридов: NaH + H2O → NaOH + H2↑
В лаборатории 1.Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту: Zn + HCl→ ZnCl2 + H2↑ 2.Взаимодействие кальция с водой: Ca + 2H2O → Ca(OH)2 + H2↑ 3.Гидролиз гидридов: NaH + H2O → NaOH + H2↑
Cлайд 12
![4.Действие щелочей на цинк или алюминий: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + ... 4.Действие щелочей на цинк или алюминий: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + ...](https://bigslide.ru/images/53/52465/389/img11.jpg) 4.Действие щелочей на цинк или алюминий: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
4.Действие щелочей на цинк или алюминий: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑ Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
Cлайд 13
 Водород в природе Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.
Водород в природе Водород — самый распространённый элемент во Вселенной. На его долю приходится около 92 % всех атомов (8 % составляют атомы гелия, доля всех остальных вместе взятых элементов — менее 0,1 %). Таким образом, водород — основная составная часть звёзд и межзвёздного газа. В условиях звёздных температур (например, температура поверхности Солнца ~ 6000 °C) водород существует в виде плазмы, в межзвёздном пространстве этот элемент существует в виде отдельных молекул, атомов и ионов и может образовывать молекулярные облака, значительно различающиеся по размерам, плотности и температуре.











![4.Действие щелочей на цинк или алюминий: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + ... 4.Действие щелочей на цинк или алюминий: 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + ...](https://bigslide.ru/images/53/52465/831/img11.jpg)






















