X
Код презентации скопируйте его
ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ.
Скачать эту презентациюПрезентация на тему ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ.
Скачать эту презентациюCлайд 2
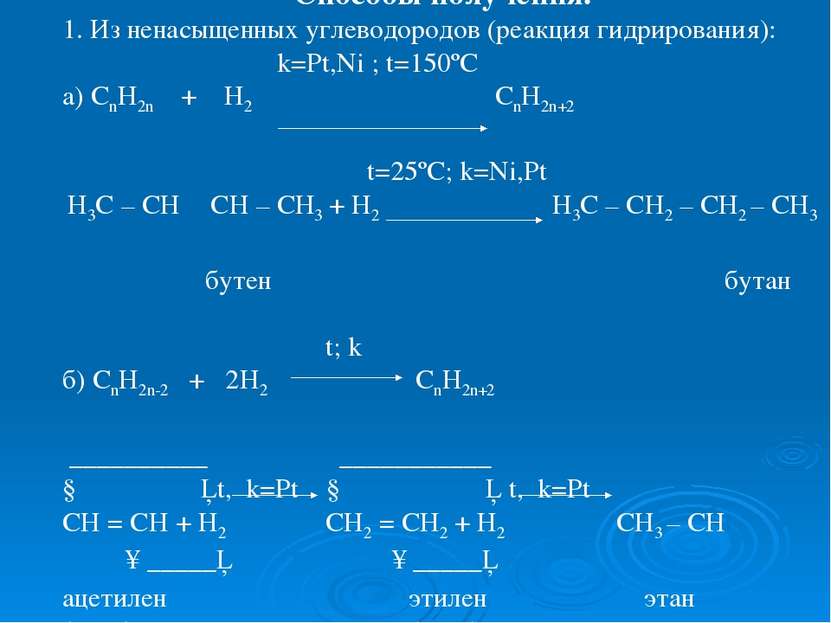
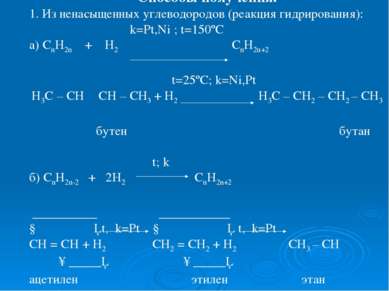 Способы получения. 1. Из ненасыщенных углеводородов (реакция гидрирования): k=Pt,Ni ; t=150ºC а) CnH2n + H2 CnH2n+2 t=25ºC; k=Ni,Pt Н3С – СН ═ СН – СН3 + Н2 Н3С – СН2 – СН2 – СН3 бутен бутан t; k б) СnH2n-2 + 2H2 CnH2n+2 __________ ___________ ↓ │ t, k=Pt ↓ │ t, k=Pt CH = CH + H2 CH2 = CH2 + H2 CH3 – CH ↑_____│ ↑_____│ ацетилен этилен этан (этин) (этен)
Способы получения. 1. Из ненасыщенных углеводородов (реакция гидрирования): k=Pt,Ni ; t=150ºC а) CnH2n + H2 CnH2n+2 t=25ºC; k=Ni,Pt Н3С – СН ═ СН – СН3 + Н2 Н3С – СН2 – СН2 – СН3 бутен бутан t; k б) СnH2n-2 + 2H2 CnH2n+2 __________ ___________ ↓ │ t, k=Pt ↓ │ t, k=Pt CH = CH + H2 CH2 = CH2 + H2 CH3 – CH ↑_____│ ↑_____│ ацетилен этилен этан (этин) (этен)
Cлайд 3
 2. Из галогенопроизводных (реакция Вюрца). Этой реакцией пользуются, когда необходимо увеличить углеродную цепь. t˚ R – Hal + 2Na + R – Hal R – R + 2NaHal t˚ 2CH3I+ 2Na H3C – CH3 + 2NaI иодметан этан Из солей карбоновых кислот: t˚ СН3 COONa + NaO H Na2CO3 + CH4↑ ацетат натрия крист. 4. Прямой синтез из углерода и водорода t=400-500ºC, K=Ni С + 2Н2 СН4 5. Из нефти, природного газа. 6. Из карбида алюминия: Al4C3 + 12H2O 4Al(OH)3 + 3CH4↑
2. Из галогенопроизводных (реакция Вюрца). Этой реакцией пользуются, когда необходимо увеличить углеродную цепь. t˚ R – Hal + 2Na + R – Hal R – R + 2NaHal t˚ 2CH3I+ 2Na H3C – CH3 + 2NaI иодметан этан Из солей карбоновых кислот: t˚ СН3 COONa + NaO H Na2CO3 + CH4↑ ацетат натрия крист. 4. Прямой синтез из углерода и водорода t=400-500ºC, K=Ni С + 2Н2 СН4 5. Из нефти, природного газа. 6. Из карбида алюминия: Al4C3 + 12H2O 4Al(OH)3 + 3CH4↑
Cлайд 4
 7. Синтез из угарного газа и водорода: p, t=200-300ºC, K=Co, Fe nCO + ( 2n+1 ) H2 ——————————→ CnH2n+2 + nH2 Этим способом получают алканы от С6 до С10. Химические свойства. Алканы, по словам Коновалова, «химические мертвецы». Для них характерны реакции замещения. Реакции замещения: 1. Галогенирование. Эта реакция является фотохимической реакцией: свет свет СН4 + Сl2 ——→ CH3Cl + Cl2 ——→ - HCl - HCl хлорметан свет ——→ CH2Cl2 + Cl2——→ CHCl3 -HCl трихлорметан дихлорметан ( хлороформ )
7. Синтез из угарного газа и водорода: p, t=200-300ºC, K=Co, Fe nCO + ( 2n+1 ) H2 ——————————→ CnH2n+2 + nH2 Этим способом получают алканы от С6 до С10. Химические свойства. Алканы, по словам Коновалова, «химические мертвецы». Для них характерны реакции замещения. Реакции замещения: 1. Галогенирование. Эта реакция является фотохимической реакцией: свет свет СН4 + Сl2 ——→ CH3Cl + Cl2 ——→ - HCl - HCl хлорметан свет ——→ CH2Cl2 + Cl2——→ CHCl3 -HCl трихлорметан дихлорметан ( хлороформ )
Cлайд 5
 свет СНCl3 + Cl2 ———→ CCl4 - HCl четыреххлористый углерод тетрахлорметан Эта реакция протекает по свободнорадикальному механизму. Впервые этот механизм был изучен русским химиком Семеновым. Такие реакции называют часто цепными реакциями. 2. Нитрование ( реакция Коновалова ): CH3 СН3 │ t=140ºC │ Н3С—СН2—СН—СН2—СН3+HNO3→H3C—CH2—C—CH2—CH3 10 % - H2O │ 3-метилпентан ( HO—NO2 ) NO2 азотная 3-метил-3-нитропентан кислота Правило Зайцева: ” Отщепление атомов водорода всегда происходит от наименее гидрогенизированного атома углерода”.
свет СНCl3 + Cl2 ———→ CCl4 - HCl четыреххлористый углерод тетрахлорметан Эта реакция протекает по свободнорадикальному механизму. Впервые этот механизм был изучен русским химиком Семеновым. Такие реакции называют часто цепными реакциями. 2. Нитрование ( реакция Коновалова ): CH3 СН3 │ t=140ºC │ Н3С—СН2—СН—СН2—СН3+HNO3→H3C—CH2—C—CH2—CH3 10 % - H2O │ 3-метилпентан ( HO—NO2 ) NO2 азотная 3-метил-3-нитропентан кислота Правило Зайцева: ” Отщепление атомов водорода всегда происходит от наименее гидрогенизированного атома углерода”.
Cлайд 6
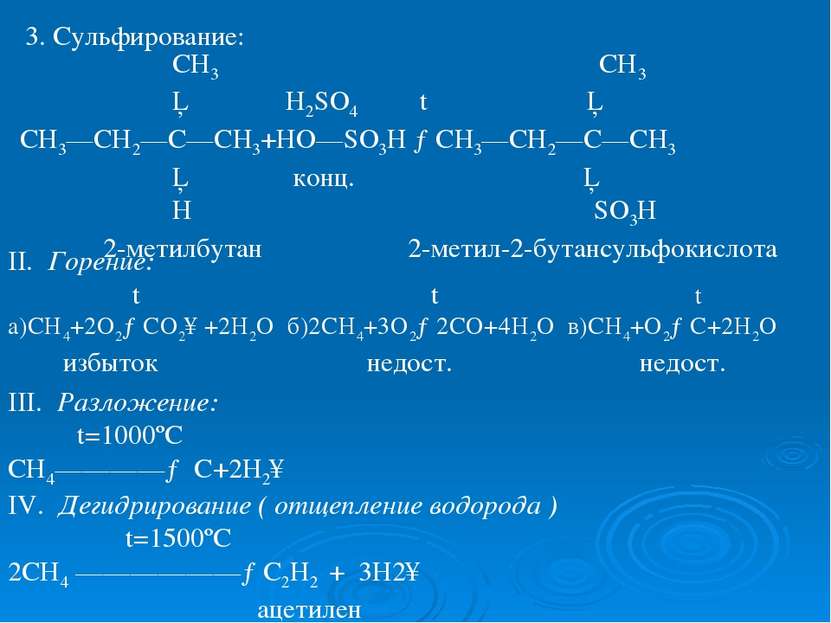
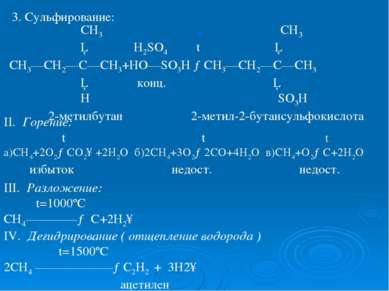 3. Сульфирование: СН3 СН3 │ H2SO4 t │ СН3—СН2—С—СН3+НО—SO3H →СН3—СН2—С—СН3 │ конц. │ Н SO3H 2-метилбутан 2-метил-2-бутансульфокислота II. Горение: t t t а)СН4+2О2→СО2↑+2Н2О б)2СН4+3О2→2СО+4Н2О в)СН4+О2→С+2Н2О избыток недост. недост. III. Разложение: t=1000ºC CH4————→ C+2H2↑ IV. Дегидрирование ( отщепление водорода ) t=1500ºС 2СН4 ——————→С2Н2 + 3Н2↑ ацетилен
3. Сульфирование: СН3 СН3 │ H2SO4 t │ СН3—СН2—С—СН3+НО—SO3H →СН3—СН2—С—СН3 │ конц. │ Н SO3H 2-метилбутан 2-метил-2-бутансульфокислота II. Горение: t t t а)СН4+2О2→СО2↑+2Н2О б)2СН4+3О2→2СО+4Н2О в)СН4+О2→С+2Н2О избыток недост. недост. III. Разложение: t=1000ºC CH4————→ C+2H2↑ IV. Дегидрирование ( отщепление водорода ) t=1500ºС 2СН4 ——————→С2Н2 + 3Н2↑ ацетилен
Cлайд 7
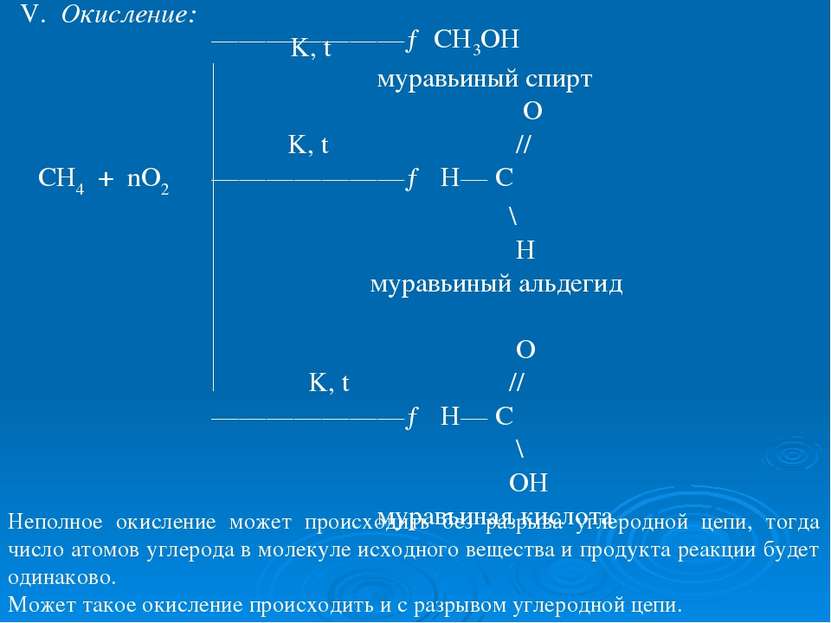
 V. Окисление: K, t ———————→ CH3OH муравьиный спирт O K, t // СН4 + nO2 ———————→ H— C \ H муравьиный альдегид O K, t // ———————→ H— C \ OH муравьиная кислота Неполное окисление может происходить без разрыва углеродной цепи, тогда число атомов углерода в молекуле исходного вещества и продукта реакции будет одинаково. Может такое окисление происходить и с разрывом углеродной цепи.
V. Окисление: K, t ———————→ CH3OH муравьиный спирт O K, t // СН4 + nO2 ———————→ H— C \ H муравьиный альдегид O K, t // ———————→ H— C \ OH муравьиная кислота Неполное окисление может происходить без разрыва углеродной цепи, тогда число атомов углерода в молекуле исходного вещества и продукта реакции будет одинаково. Может такое окисление происходить и с разрывом углеродной цепи.
Cлайд 8
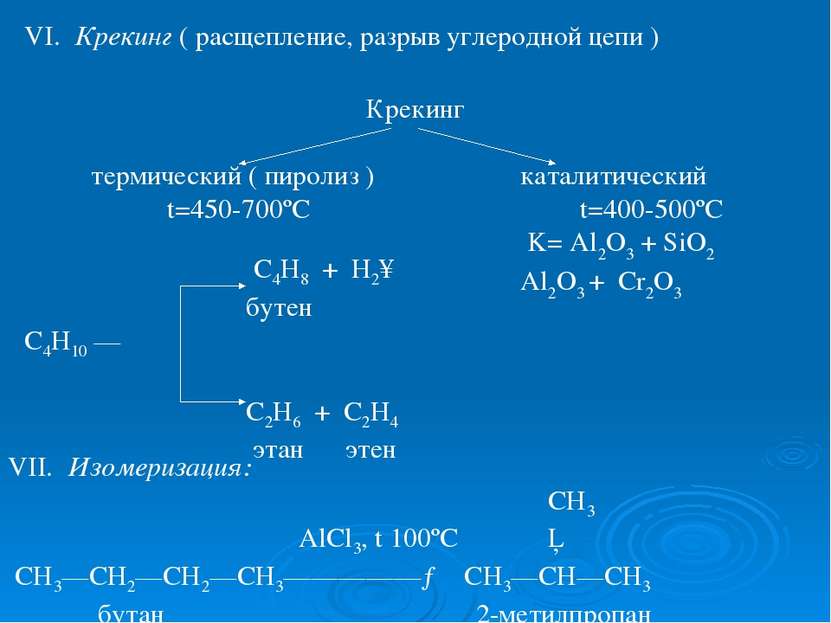
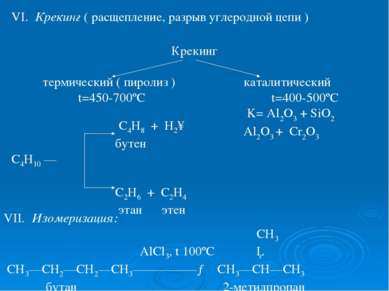 VI. Крекинг ( расщепление, разрыв углеродной цепи ) Крекинг термический ( пиролиз ) каталитический t=450-700ºC t=400-500ºC K= Al2O3 + SiO2 Al2O3 + Cr2O3 VII. Изомеризация: СН3 AlCl3, t 100ºC │ СН3—СН2—СН2—СН3—————→ СН3—СН—СН3 бутан 2-метилпропан
VI. Крекинг ( расщепление, разрыв углеродной цепи ) Крекинг термический ( пиролиз ) каталитический t=450-700ºC t=400-500ºC K= Al2O3 + SiO2 Al2O3 + Cr2O3 VII. Изомеризация: СН3 AlCl3, t 100ºC │ СН3—СН2—СН2—СН3—————→ СН3—СН—СН3 бутан 2-метилпропан
Cлайд 9
 Отдельные представители алканов и их применение. СН4 – метан. Бесцветный газ, без запаха, малорастворим в воде, легче воздуха, называют его ”болотным газом”, так как образуется при гниении растительных остатков на дне болот без доступа воздуха, входит в состав нефтяного, природного газа, используется в органическом синтезе, как топливо. 2. С2Н6 – этан. Бесцветный газ, без запаха, мало растворим в воде, проявляет слабое наркотическое действие, используется как сырье в органическом синтезе. С3Н8 – пропан Бесцветные газы, легко сжимаются, в быту используются кактопливо (балонный газ), используется как автомобильное топливо. Бутан используют для получения бутадиена, С4Н10 – бутан который является сырьем для производства синтетического каучука.
Отдельные представители алканов и их применение. СН4 – метан. Бесцветный газ, без запаха, малорастворим в воде, легче воздуха, называют его ”болотным газом”, так как образуется при гниении растительных остатков на дне болот без доступа воздуха, входит в состав нефтяного, природного газа, используется в органическом синтезе, как топливо. 2. С2Н6 – этан. Бесцветный газ, без запаха, мало растворим в воде, проявляет слабое наркотическое действие, используется как сырье в органическом синтезе. С3Н8 – пропан Бесцветные газы, легко сжимаются, в быту используются кактопливо (балонный газ), используется как автомобильное топливо. Бутан используют для получения бутадиена, С4Н10 – бутан который является сырьем для производства синтетического каучука.
Cлайд 10
 4. Вазелиновое масло – смесь жидких алканов до С15. Бесцветная жидкость без запаха, без вкуса, используется в медицине и парфюмерии. Его используют в технике как основу кислотностойких и неокисляющихся смазочных масел. 5. Вазелин – смесь жидких и твердых алканов до С25. Используется в косметике и в медицине как мазевая основа, в физиотерапевтических процедурах. 6. Парафин – смесь твердых алканов с С18 до С35. Применяется для пропитки материалов (бумаги, ткани, древесины). В медицине используют для физиотерапевтических процедур. Озокерит, горный воск – природная смесь высших алканов. В медицине используют для физиотерапевтических процедур.
4. Вазелиновое масло – смесь жидких алканов до С15. Бесцветная жидкость без запаха, без вкуса, используется в медицине и парфюмерии. Его используют в технике как основу кислотностойких и неокисляющихся смазочных масел. 5. Вазелин – смесь жидких и твердых алканов до С25. Используется в косметике и в медицине как мазевая основа, в физиотерапевтических процедурах. 6. Парафин – смесь твердых алканов с С18 до С35. Применяется для пропитки материалов (бумаги, ткани, древесины). В медицине используют для физиотерапевтических процедур. Озокерит, горный воск – природная смесь высших алканов. В медицине используют для физиотерапевтических процедур.