X
Код презентации скопируйте его
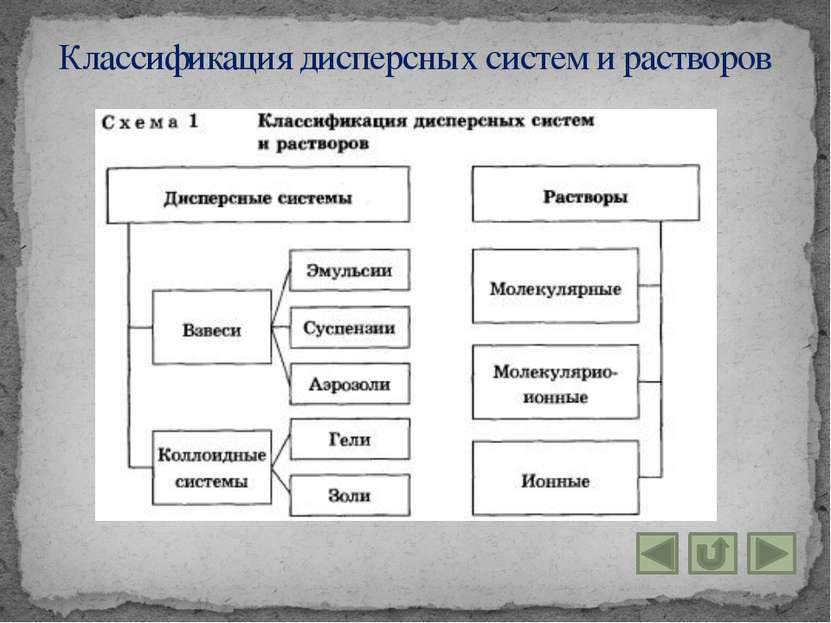
Дисперсные системы и растворы
Скачать эту презентациюПрезентация на тему Дисперсные системы и растворы
Скачать эту презентациюCлайд 1
 Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объёме другого. То вещество, которое присутствует в меньшем количестве и распределено в объёме другого, называют дисперсной фазой. Вещество, присутствующее в большем количестве, в объёме которого распределена дисперсная фаза, называют дисперсионной средой. Понятие дисперсной системы
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объёме другого. То вещество, которое присутствует в меньшем количестве и распределено в объёме другого, называют дисперсной фазой. Вещество, присутствующее в большем количестве, в объёме которого распределена дисперсная фаза, называют дисперсионной средой. Понятие дисперсной системы
Cлайд 4
 Взвеси – это дисперсные системы, в которых размер частиц фазы более 100 нм. 1. Эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Примеры: молоко, лимфа, водоэмульсионные краски. 2. Суспензии (среда – жидкость, а фаза – нерастворимое в ней твёрдое вещество). Примеры: “известковое молоко”, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде. 3. Аэрозоли – взвеси в газе. Мелких частиц жидкостей или твёрдых веществ. Различают пыли, дымы, туманы. Понятие взвеси
Взвеси – это дисперсные системы, в которых размер частиц фазы более 100 нм. 1. Эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Примеры: молоко, лимфа, водоэмульсионные краски. 2. Суспензии (среда – жидкость, а фаза – нерастворимое в ней твёрдое вещество). Примеры: “известковое молоко”, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде. 3. Аэрозоли – взвеси в газе. Мелких частиц жидкостей или твёрдых веществ. Различают пыли, дымы, туманы. Понятие взвеси
Cлайд 5
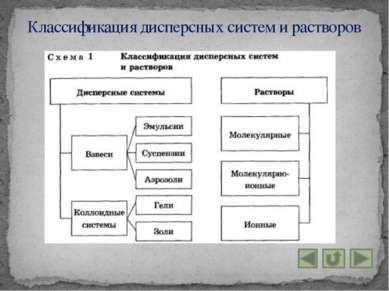 Коллоидные системы – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. 1. Коллоидные растворы, или золи: большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма и т. д.) и живого организма в целом (кровь, лимфа, тканевая жидкость и т. д.). Эффект Тиндаля: раствор отличают по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. 2. Гели или студни: представляют собой студенистые осадки, образующиеся при коагуляции золей. Понятие коллоидной системы
Коллоидные системы – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. 1. Коллоидные растворы, или золи: большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма и т. д.) и живого организма в целом (кровь, лимфа, тканевая жидкость и т. д.). Эффект Тиндаля: раствор отличают по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. 2. Гели или студни: представляют собой студенистые осадки, образующиеся при коагуляции золей. Понятие коллоидной системы
Cлайд 6
 Раствором называют гомогенную систему, состоящую из двух и более веществ. Растворы называют истинными, если требуется подчеркнуть их отличие от коллоидных растворов. Растворителем считают вещество, агрегатное состояние которого не изменяется при образовании раствора. Понятие раствора
Раствором называют гомогенную систему, состоящую из двух и более веществ. Растворы называют истинными, если требуется подчеркнуть их отличие от коллоидных растворов. Растворителем считают вещество, агрегатное состояние которого не изменяется при образовании раствора. Понятие раствора
Cлайд 7
 Массовая доля вещества в растворе – отношение массы растворённого вещества к массе раствора. Массовая доля вещества в растворе w
Массовая доля вещества в растворе – отношение массы растворённого вещества к массе раствора. Массовая доля вещества в растворе w
Cлайд 8
 Молярная концентрация – отношение количества вещества растворённого вещества к объёму раствора. Молярная концентрация С
Молярная концентрация – отношение количества вещества растворённого вещества к объёму раствора. Молярная концентрация С
Cлайд 9
 Моляльная концентрация – отношение количества растворённого вещества к массе растворителя. Моляльная концентрация
Моляльная концентрация – отношение количества растворённого вещества к массе растворителя. Моляльная концентрация
Cлайд 10
 Раствор – гомогенная (однородная) система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. 1. Молекулярные – это водные растворы неэлектролитов – органических веществ. 2. Молекулярно – ионные – это растворы слабых электролитов. 3. Ионные – это растворы сильных электролитов. Группы растворов
Раствор – гомогенная (однородная) система, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. 1. Молекулярные – это водные растворы неэлектролитов – органических веществ. 2. Молекулярно – ионные – это растворы слабых электролитов. 3. Ионные – это растворы сильных электролитов. Группы растворов