X
Код презентации скопируйте его
Сложные эфиры. Жиры
Скачать эту презентациюПрезентация на тему Сложные эфиры. Жиры
Скачать эту презентациюCлайд 2
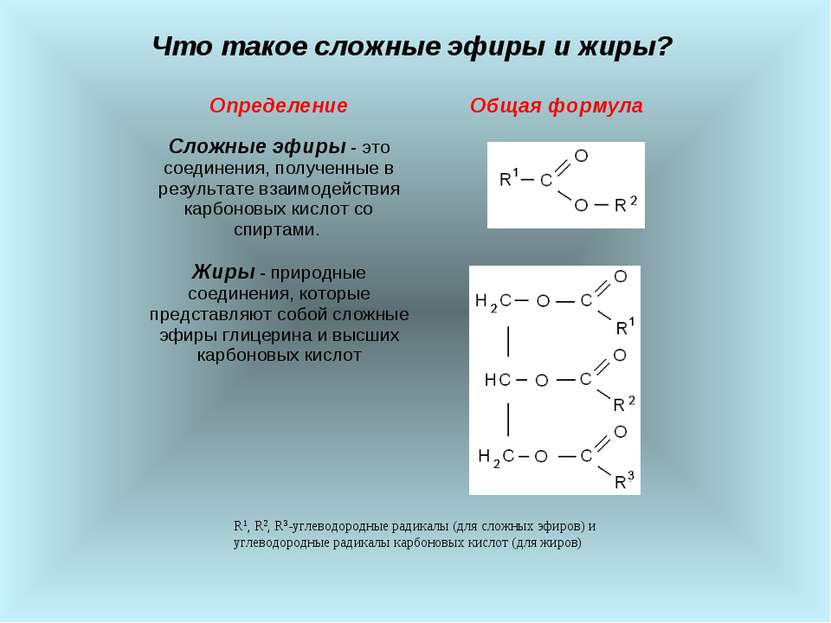
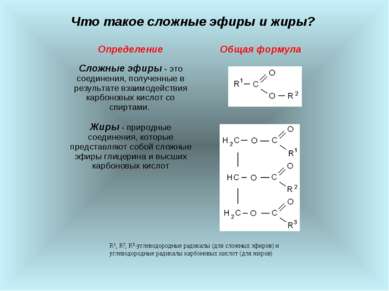 Что такое сложные эфиры и жиры? R1, R2, R3-углеводородные радикалы (для сложных эфиров) и углеводородные радикалы карбоновых кислот (для жиров) Определение Общая формула Сложные эфиры - это соединения, полученные в результате взаимодействия карбоновых кислот со спиртами. Жиры - природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот
Что такое сложные эфиры и жиры? R1, R2, R3-углеводородные радикалы (для сложных эфиров) и углеводородные радикалы карбоновых кислот (для жиров) Определение Общая формула Сложные эфиры - это соединения, полученные в результате взаимодействия карбоновых кислот со спиртами. Жиры - природные соединения, которые представляют собой сложные эфиры глицерина и высших карбоновых кислот
Cлайд 3
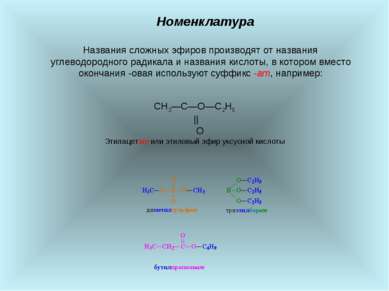 Номенклатура Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например: CH3―С―O―C2H5 || О Этилацетат или этиловый эфир уксусной кислоты
Номенклатура Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания -овая используют суффикс -ат, например: CH3―С―O―C2H5 || О Этилацетат или этиловый эфир уксусной кислоты
Cлайд 4
 Изомерия Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат. СН3―СН2―СН2―СН2―С―О―С2Н5 || О Этилбутират СН3―СН―СН2―C―О―С2Н5 | || CH3 O Этилизобутират СН3―С―O―СН2―СН2―СН3 || О Пропилацетат СН3―С―O―СН―СН3 || | O CH3 Изопропилацетат
Изомерия Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с пропилового спирта, например, этилбутирату изомерны этилизобутират, пропилацетат и изопропилацетат. СН3―СН2―СН2―СН2―С―О―С2Н5 || О Этилбутират СН3―СН―СН2―C―О―С2Н5 | || CH3 O Этилизобутират СН3―С―O―СН2―СН2―СН3 || О Пропилацетат СН3―С―O―СН―СН3 || | O CH3 Изопропилацетат
Cлайд 5
 2. Изомерия положения сложноэфирной группировки —СО—О— Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат. Изомерия СН3―СО―О―С2Н5 этилацетат С2Н5―СО―О―СН3 метилпропионат.
2. Изомерия положения сложноэфирной группировки —СО—О— Этот вид изомерии начинается со сложных эфиров, в молекулах которых содержится не менее 4 атомов углерода, например этилацетат и метилпропионат. Изомерия СН3―СО―О―С2Н5 этилацетат С2Н5―СО―О―СН3 метилпропионат.
Cлайд 6
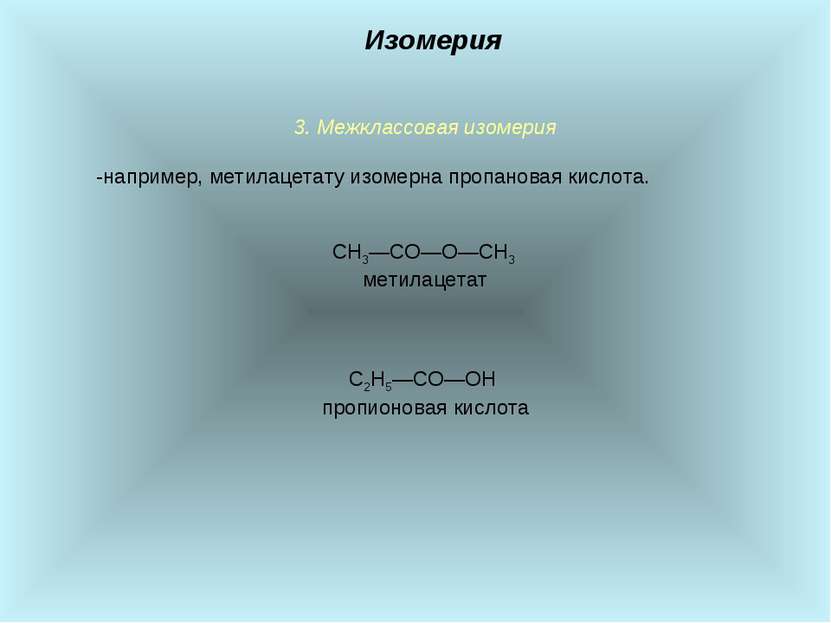
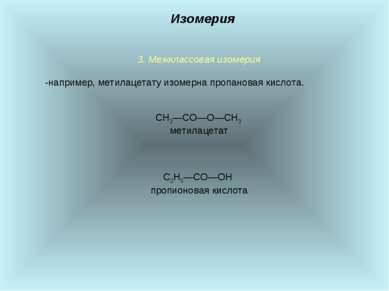 3. Межклассовая изомерия -например, метилацетату изомерна пропановая кислота. СН3―СО―О―СН3 метилацетат С2Н5―СО―ОН пропионовая кислота Изомерия
3. Межклассовая изомерия -например, метилацетату изомерна пропановая кислота. СН3―СО―О―СН3 метилацетат С2Н5―СО―ОН пропионовая кислота Изомерия
Cлайд 7
 4. Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи цистрансизомерия Изомерия
4. Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия положения кратной связи цистрансизомерия Изомерия
Cлайд 8
 Физические свойства сложных эфиров Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы. Формула сложного эфира Название Аромат СН3СООС4Н9 Бутилацетат грушевый С3Н7СООСН3 Метиловый эфир масляной кислоты яблочный С3Н7СООС2Н5 Этиловый эфир масляной кислоты ананасовый С4Н9СООС2Н5 Этиловый эфир изовалериановой кислоты малиновый С4Н9СООС5Н11 Изоамиловый эфир изовалериановой кислоты банановый СН3СООСН2С6Н5 Бензилацетат жасминовый С6Н5СООСН2С6Н5 Бензилбензоат цветочный
Физические свойства сложных эфиров Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в воде жидкости. Многие из них имеют приятный запах. Сложные эфиры высших жирных кислот и спиртов — воскообразные вещества, не имеют запаха, в воде не растворимы. Формула сложного эфира Название Аромат СН3СООС4Н9 Бутилацетат грушевый С3Н7СООСН3 Метиловый эфир масляной кислоты яблочный С3Н7СООС2Н5 Этиловый эфир масляной кислоты ананасовый С4Н9СООС2Н5 Этиловый эфир изовалериановой кислоты малиновый С4Н9СООС5Н11 Изоамиловый эфир изовалериановой кислоты банановый СН3СООСН2С6Н5 Бензилацетат жасминовый С6Н5СООСН2С6Н5 Бензилбензоат цветочный
Cлайд 9
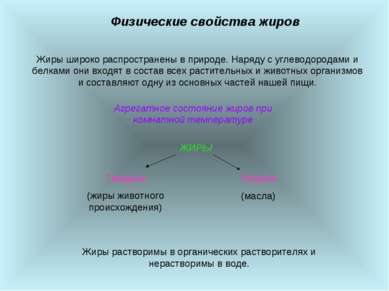 Физические свойства жиров Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи. Агрегатное состояние жиров при комнатной температуре Жиры растворимы в органических растворителях и нерастворимы в воде.
Физические свойства жиров Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в состав всех растительных и животных организмов и составляют одну из основных частей нашей пищи. Агрегатное состояние жиров при комнатной температуре Жиры растворимы в органических растворителях и нерастворимы в воде.
Cлайд 10
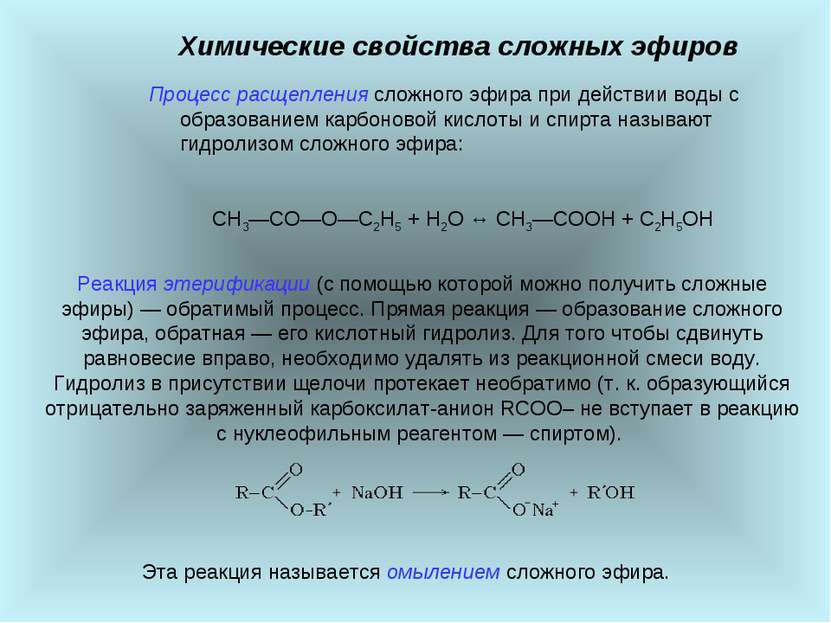
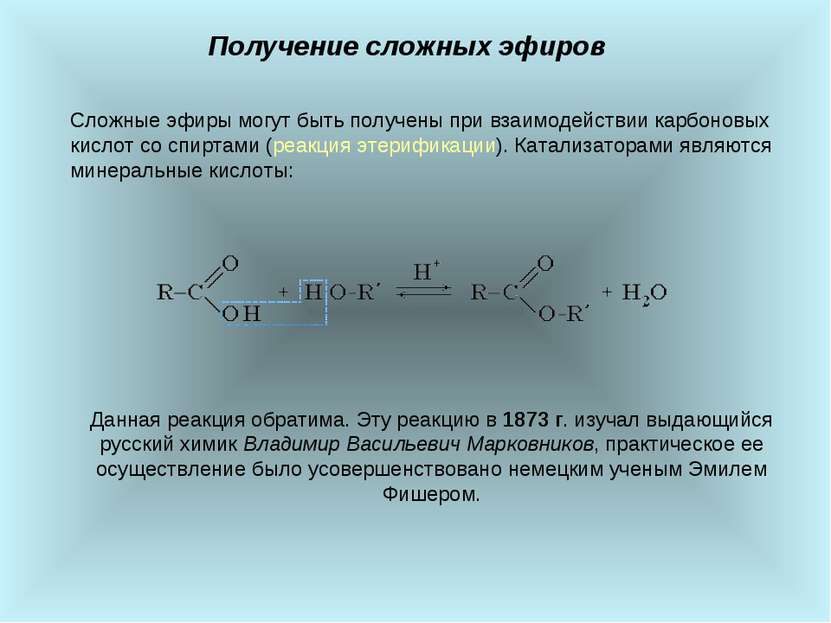
 Химические свойства сложных эфиров Процесс расщепления сложного эфира при действии воды с образованием карбоновой кислоты и спирта называют гидролизом сложного эфира: СН3―СО―О―С2Н5 + H2O ↔ СН3―СООН + С2Н5ОН Реакция этерификации (с помощью которой можно получить сложные эфиры) ― обратимый процесс. Прямая реакция ― образование сложного эфира, обратная ― его кислотный гидролиз. Для того чтобы сдвинуть равновесие вправо, необходимо удалять из реакционной смеси воду. Гидролиз в присутствии щелочи протекает необратимо (т. к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом ― спиртом). Эта реакция называется омылением сложного эфира.
Химические свойства сложных эфиров Процесс расщепления сложного эфира при действии воды с образованием карбоновой кислоты и спирта называют гидролизом сложного эфира: СН3―СО―О―С2Н5 + H2O ↔ СН3―СООН + С2Н5ОН Реакция этерификации (с помощью которой можно получить сложные эфиры) ― обратимый процесс. Прямая реакция ― образование сложного эфира, обратная ― его кислотный гидролиз. Для того чтобы сдвинуть равновесие вправо, необходимо удалять из реакционной смеси воду. Гидролиз в присутствии щелочи протекает необратимо (т. к. образующийся отрицательно заряженный карбоксилат-анион RCOO– не вступает в реакцию с нуклеофильным реагентом ― спиртом). Эта реакция называется омылением сложного эфира.
Cлайд 11
 Химические свойства сложных эфиров Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов: R'―CO―OR" + [H]→ R'―CH2―OH + R"OH Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты R'―CO―OR" + NH3 → R'―CO―NH2 + R"OH
Химические свойства сложных эфиров Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород. Реакция восстановления. Восстановление сложных эфиров водородом приводит к образованию двух спиртов: R'―CO―OR" + [H]→ R'―CH2―OH + R"OH Реакция образования амидов. Под действием аммиака сложные эфиры превращаются в амиды кислот и спирты R'―CO―OR" + NH3 → R'―CO―NH2 + R"OH
Cлайд 12
 Одно из важнейших свойств жиров ― их способность расщепляться на составляющие: глицерин и карбоновые кислоты. Если такая реакция осуществляется под действием воды в присутствии кислот, она называется гидролизом (гидро ― вода, лиз ― разрушение): Химические свойства жиров Приведенная выше реакция является обратимой. Но как сместить равновесие вправо? Один из способов ― удаление одного из конечных продуктов, например, превратить его в другое вещество (см. след. слайд)
Одно из важнейших свойств жиров ― их способность расщепляться на составляющие: глицерин и карбоновые кислоты. Если такая реакция осуществляется под действием воды в присутствии кислот, она называется гидролизом (гидро ― вода, лиз ― разрушение): Химические свойства жиров Приведенная выше реакция является обратимой. Но как сместить равновесие вправо? Один из способов ― удаление одного из конечных продуктов, например, превратить его в другое вещество (см. след. слайд)
Cлайд 13
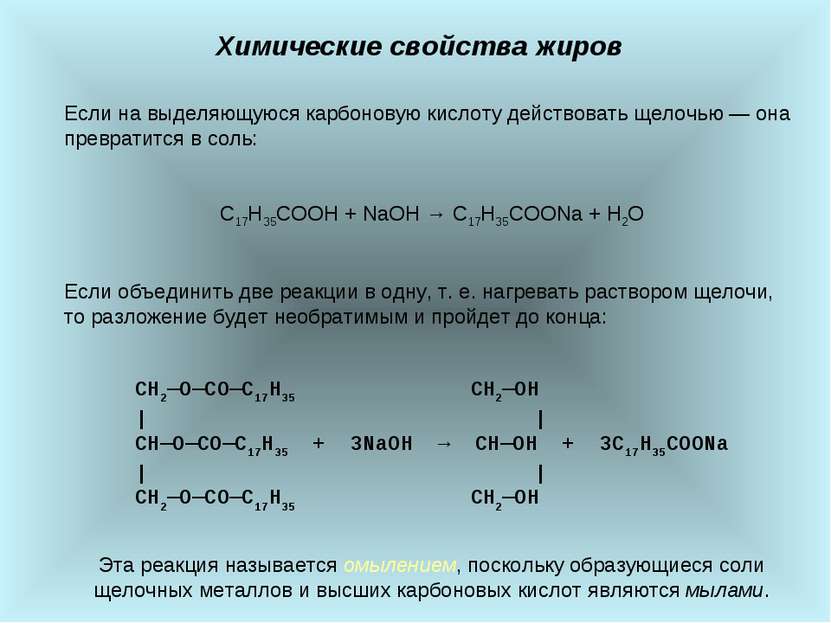
 Химические свойства жиров Если на выделяющуюся карбоновую кислоту действовать щелочью ― она превратится в соль: C17H35COOH + NaOH → C17H35COONa + H2O Если объединить две реакции в одну, т. е. нагревать раствором щелочи, то разложение будет необратимым и пройдет до конца: СН2―О―СО―С17Н35 CH2―OH | | СН―О―СO―С17H35 + 3NaOH → CH―OH + 3C17H35COONa | | СН2―О―СО―С17Н35 CH2―OH Эта реакция называется омылением, поскольку образующиеся соли щелочных металлов и высших карбоновых кислот являются мылами.
Химические свойства жиров Если на выделяющуюся карбоновую кислоту действовать щелочью ― она превратится в соль: C17H35COOH + NaOH → C17H35COONa + H2O Если объединить две реакции в одну, т. е. нагревать раствором щелочи, то разложение будет необратимым и пройдет до конца: СН2―О―СО―С17Н35 CH2―OH | | СН―О―СO―С17H35 + 3NaOH → CH―OH + 3C17H35COONa | | СН2―О―СО―С17Н35 CH2―OH Эта реакция называется омылением, поскольку образующиеся соли щелочных металлов и высших карбоновых кислот являются мылами.
Cлайд 14
 Химические свойства жиров Твердые животные жиры более ценны и дорогостоящи, чем растительные масла. Способ превращения непредельных жиров в предельные ― присоединение по двойной связи молекулы водорода. Такая реакция называется реакцией гидрирования. Например, реакция гидрирования триолеата глицерина до тристеарата: CH2―O―CO―C17H33 CH2―O―CO―C17H35 | | CH―O―CO―C17H33 + 3H2 → CH―O―CO―C17H35 | | CH2―O―CO―C17H33 CH2―O―CO―C17H35
Химические свойства жиров Твердые животные жиры более ценны и дорогостоящи, чем растительные масла. Способ превращения непредельных жиров в предельные ― присоединение по двойной связи молекулы водорода. Такая реакция называется реакцией гидрирования. Например, реакция гидрирования триолеата глицерина до тристеарата: CH2―O―CO―C17H33 CH2―O―CO―C17H35 | | CH―O―CO―C17H33 + 3H2 → CH―O―CO―C17H35 | | CH2―O―CO―C17H33 CH2―O―CO―C17H35
Cлайд 16
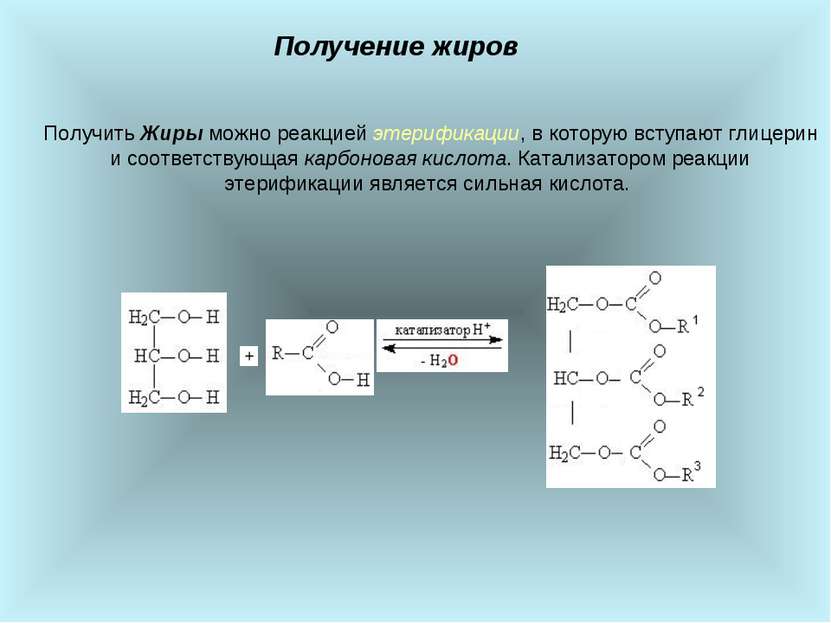
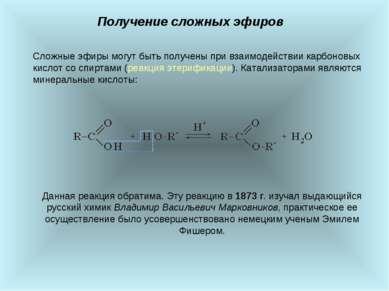
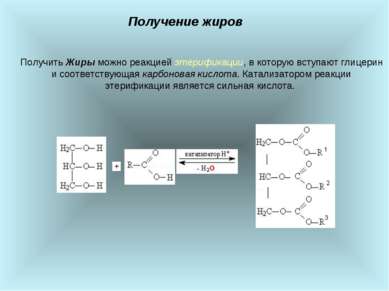 Получение жиров Получить Жиры можно реакцией этерификации, в которую вступают глицерин и соответствующая карбоновая кислота. Катализатором реакции этерификации является сильная кислота.
Получение жиров Получить Жиры можно реакцией этерификации, в которую вступают глицерин и соответствующая карбоновая кислота. Катализатором реакции этерификации является сильная кислота.
Cлайд 19
 Интересное о жирах Жиры являются одной из трех главных составляющих пищи человека и животных , наряду с углеводами и белками. При их окислении в организме выделяется энергия, необходимая для поддержания постоянной температуры тела и протекания других физиологических процессов (калорийность чистого жира 3770 кДж (900 ккал/100 г). Поступающие с пищей жиры в процессе пищеварения расщепляются на глицерин и жирные кислоты; эти вещества всасываются в кишечнике, затем из них вновь синтезируются жиры. Кроме того, жиры накапливаются в подкожных тканях и тканях, окружающих внутренние органы, и выполняют терморегулирующую и защитную функцию в организме. жиры
Интересное о жирах Жиры являются одной из трех главных составляющих пищи человека и животных , наряду с углеводами и белками. При их окислении в организме выделяется энергия, необходимая для поддержания постоянной температуры тела и протекания других физиологических процессов (калорийность чистого жира 3770 кДж (900 ккал/100 г). Поступающие с пищей жиры в процессе пищеварения расщепляются на глицерин и жирные кислоты; эти вещества всасываются в кишечнике, затем из них вновь синтезируются жиры. Кроме того, жиры накапливаются в подкожных тканях и тканях, окружающих внутренние органы, и выполняют терморегулирующую и защитную функцию в организме. жиры