X
Код презентации скопируйте его
Кислород. Общая характеристика кислорода. Нахождение в природе. Получение
Скачать эту презентациюПрезентация на тему Кислород. Общая характеристика кислорода. Нахождение в природе. Получение
Скачать эту презентациюCлайд 1
 Наш урок посвящен химическому элементу и веществу им образованному, который занимает особое место в жизни человека и всего живого. В чем горят дрова и газ, Фосфор, водород, алмаз? Дышит чем любой из нас Каждый миг и каждый час? Без чего мертва природа? Правильно без …
Наш урок посвящен химическому элементу и веществу им образованному, который занимает особое место в жизни человека и всего живого. В чем горят дрова и газ, Фосфор, водород, алмаз? Дышит чем любой из нас Каждый миг и каждый час? Без чего мертва природа? Правильно без …
Cлайд 2
 I.Кислород – химический элемент 1. Химический знак 2.Положение в периодической системе 3.Относительная атомная масса 4.Валентность 4.В состав каких веществ входит
I.Кислород – химический элемент 1. Химический знак 2.Положение в периодической системе 3.Относительная атомная масса 4.Валентность 4.В состав каких веществ входит
Cлайд 3
 I.Кислород – химический элемент Химический знак – О Положение в период. Сист.- Z=8, 2 период, IVA-Группа 2.Относительная атомная масса Аr(О)=16 3.Валентность – II 4.Входит в состав: воды ,некоторых солей ,кислот, оксидов, минералов, органических веществ веществ ...
I.Кислород – химический элемент Химический знак – О Положение в период. Сист.- Z=8, 2 период, IVA-Группа 2.Относительная атомная масса Аr(О)=16 3.Валентность – II 4.Входит в состав: воды ,некоторых солей ,кислот, оксидов, минералов, органических веществ веществ ...
Cлайд 4
 Содержание кислорода в природе Распространение элементов в природе (по массе, в %) 1 - кислород - 49 2 - алюминий - 7 3 - железо - 5 4 - кальций - 4 5 - натрий - 2 6 - калий - 2 7 - магний - 2 8 - водород - 1 9 - остальные - 2 10 - кремний - 26
Содержание кислорода в природе Распространение элементов в природе (по массе, в %) 1 - кислород - 49 2 - алюминий - 7 3 - железо - 5 4 - кальций - 4 5 - натрий - 2 6 - калий - 2 7 - магний - 2 8 - водород - 1 9 - остальные - 2 10 - кремний - 26
Cлайд 10
 II.Кислород –простое вещество 1.Химическая формула - О2 2.Молекулярная и молярная массы Mr(О2)=32; М =32 г/моль. 3.Получение 4.Физические свойства 5.Химические свойства 6.Применение
II.Кислород –простое вещество 1.Химическая формула - О2 2.Молекулярная и молярная массы Mr(О2)=32; М =32 г/моль. 3.Получение 4.Физические свойства 5.Химические свойства 6.Применение
Cлайд 11
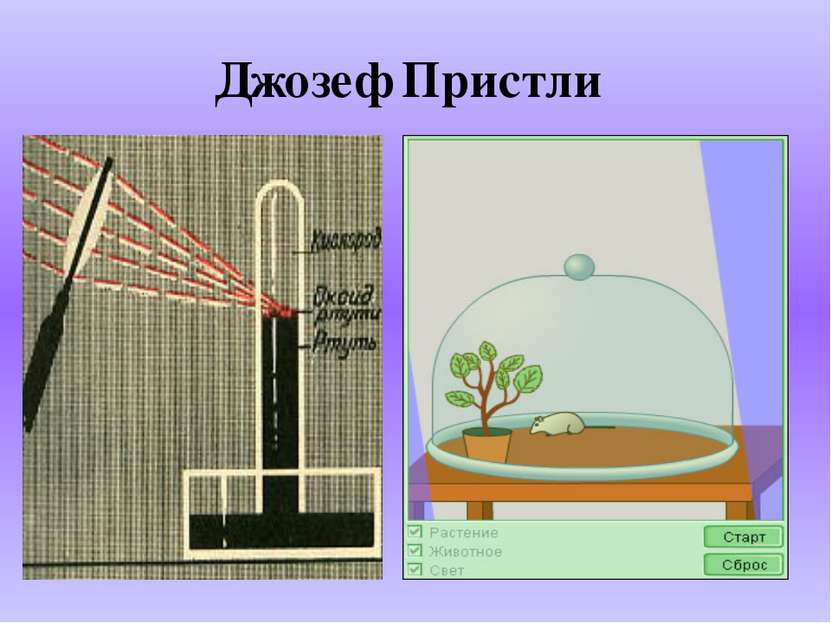
 Карл Шееле, Швеция 1772 год: «Атмосферный воздух состоит из двух частей: «огненный воздух» - поддерживает дыхание и горение, «испорченный воздух» - не поддерживает горения».
Карл Шееле, Швеция 1772 год: «Атмосферный воздух состоит из двух частей: «огненный воздух» - поддерживает дыхание и горение, «испорченный воздух» - не поддерживает горения».
Cлайд 14
 Антуан Лоран Лавуазье, Франция, 1777 год Подлинная природа этого газа была установлена во Франции. Название Oxygenium – кислотообразующий, предложено Лавуазье.
Антуан Лоран Лавуазье, Франция, 1777 год Подлинная природа этого газа была установлена во Франции. Название Oxygenium – кислотообразующий, предложено Лавуазье.
Cлайд 15
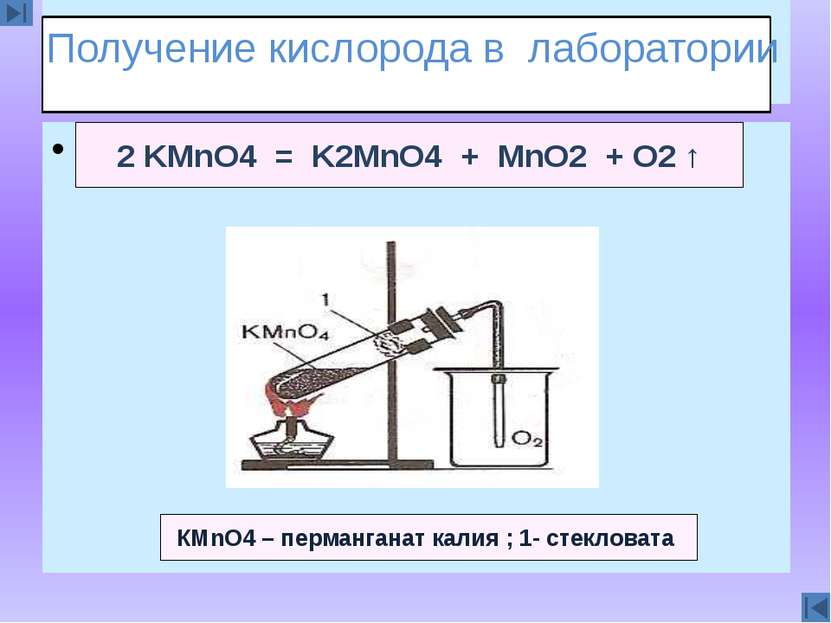
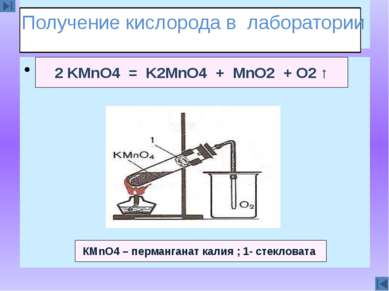
 Сказка 2 KMnO4 = K2MnO4 + MnO2 + O2 ↑ КМnO4 – перманганат калия ; 1- стекловата Получение кислорода в лаборатории
Сказка 2 KMnO4 = K2MnO4 + MnO2 + O2 ↑ КМnO4 – перманганат калия ; 1- стекловата Получение кислорода в лаборатории
Cлайд 16
 Физические войства: Газ Без цвета, запаха, вкуса Малорастворим в воде Һавадан бераз авыр 32> 29 тяж.возд. Суда аз эри Сжижается при -183 С- превращается в жидкость При температуре -218,8 C, превращается в кристаллическое состояние
Физические войства: Газ Без цвета, запаха, вкуса Малорастворим в воде Һавадан бераз авыр 32> 29 тяж.возд. Суда аз эри Сжижается при -183 С- превращается в жидкость При температуре -218,8 C, превращается в кристаллическое состояние
Cлайд 17
 Химические свойства Реакции горения неметаллов С+ O2 = С O2 S + O2 = S O2 4P + 5O2 = 2 P2O5 2H2 + O2 = 2H2O Реакции горения металлов 2Mg + O2 = 2MgO 3Fe + 2O2 = Fe3O4 2С a+ O2 = 2CaO
Химические свойства Реакции горения неметаллов С+ O2 = С O2 S + O2 = S O2 4P + 5O2 = 2 P2O5 2H2 + O2 = 2H2O Реакции горения металлов 2Mg + O2 = 2MgO 3Fe + 2O2 = Fe3O4 2С a+ O2 = 2CaO
Cлайд 18
 Химические свойства Реакции горения сложных веществ СН4+ 2O2 = СO2 + 2H2O СS2 + 3O2 = 2S O2 + СO2 C2H6О + 3O2 = 2CO2 + 3H2O
Химические свойства Реакции горения сложных веществ СН4+ 2O2 = СO2 + 2H2O СS2 + 3O2 = 2S O2 + СO2 C2H6О + 3O2 = 2CO2 + 3H2O
Cлайд 20
 Повторим 1. Охарактеризуйте кислород как химический элемент. 2.Где содержится кислород? 3. Кто открыл кислород? 4.Как получают кислород? 5.Какими физическими свойствами обладает кислород? 6.В какие реакции вступает кислород? 7.Где применяется?
Повторим 1. Охарактеризуйте кислород как химический элемент. 2.Где содержится кислород? 3. Кто открыл кислород? 4.Как получают кислород? 5.Какими физическими свойствами обладает кислород? 6.В какие реакции вступает кислород? 7.Где применяется?
Cлайд 21
 Задания для закрепления 1.Сколько молекул содержится в 2 моль кислорода? 2.В каком природном соединении больше кислорода ( % по массе) в известняке СаСО3 или поташе К2СО3 ? 3.Расставьте коэффициенты в следующих уравнениях хим.реакции: AgNO3 → Ag +NO2 +O2 Mg(NO3)2 → MgO + NO2 +O2 4. Составьте уравнения хим.реакции горения следующих веществ: С2Н4, Сu2S 5. Из предложенного перечня выпишите формулы всех кислородсодержащих соединении Н2О, МgS , SiO2, NaOH, F eS2, H2SO4, CaCO3, Al2S3, ZnO. Сайт http://flsh.ucoz.ru
Задания для закрепления 1.Сколько молекул содержится в 2 моль кислорода? 2.В каком природном соединении больше кислорода ( % по массе) в известняке СаСО3 или поташе К2СО3 ? 3.Расставьте коэффициенты в следующих уравнениях хим.реакции: AgNO3 → Ag +NO2 +O2 Mg(NO3)2 → MgO + NO2 +O2 4. Составьте уравнения хим.реакции горения следующих веществ: С2Н4, Сu2S 5. Из предложенного перечня выпишите формулы всех кислородсодержащих соединении Н2О, МgS , SiO2, NaOH, F eS2, H2SO4, CaCO3, Al2S3, ZnO. Сайт http://flsh.ucoz.ru