X
Код презентации скопируйте его
Химия, нефтехимия. Производство неорганических веществ
Скачать эту презентациюПрезентация на тему Химия, нефтехимия. Производство неорганических веществ
Скачать эту презентациюCлайд 2
 НПЗ вырабатывают: горючие и смазочные материалы, твердые и полужидкие смеси парафинов (парафин, церезин, вазелин), битумы, электродный кокс, растворители, индивидуальные парафиновые, олефиновые (алкены) углеводороды ароматические углеводороды.
НПЗ вырабатывают: горючие и смазочные материалы, твердые и полужидкие смеси парафинов (парафин, церезин, вазелин), битумы, электродный кокс, растворители, индивидуальные парафиновые, олефиновые (алкены) углеводороды ароматические углеводороды.
Cлайд 3
 1. Предварительная стадия обезвоживают, обессоливают, очищают от кокса путем продолжительного отстаивания в подогретом состоянии 180 гр.С воду отделяют термохимическим или электролитическим способом.
1. Предварительная стадия обезвоживают, обессоливают, очищают от кокса путем продолжительного отстаивания в подогретом состоянии 180 гр.С воду отделяют термохимическим или электролитическим способом.
Cлайд 4
 2. перегонка Насос Трубчатая печь 320 гр.С Ректификационная колонна Пары охлаждаются (флегмой) сгущение в конденсаторе Бензин Легроин Керосин Легкий газоиль Мазут 275 гр.С Тяж. Газоиль Веретенное масло Машинное масло Цилиндровое масло Гудрон – твердый осадок
2. перегонка Насос Трубчатая печь 320 гр.С Ректификационная колонна Пары охлаждаются (флегмой) сгущение в конденсаторе Бензин Легроин Керосин Легкий газоиль Мазут 275 гр.С Тяж. Газоиль Веретенное масло Машинное масло Цилиндровое масло Гудрон – твердый осадок
Cлайд 5
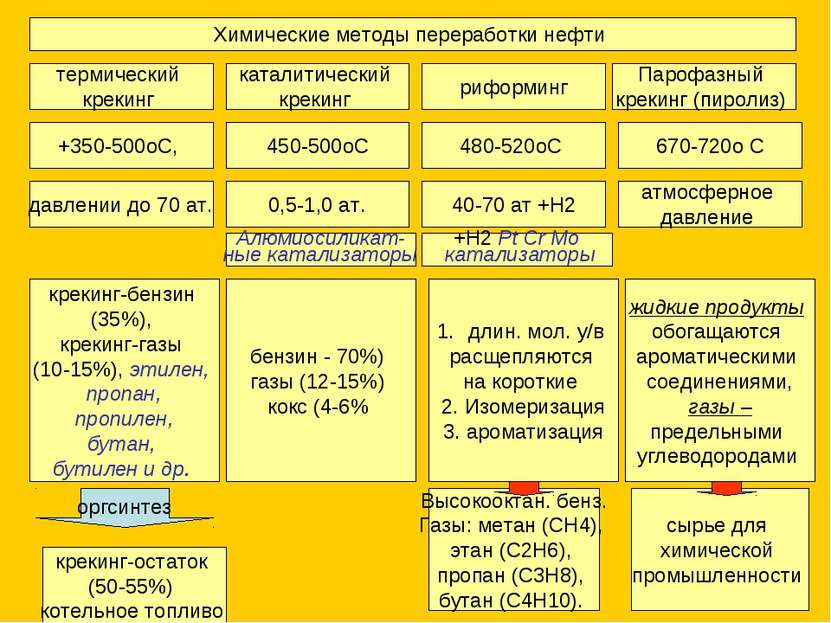
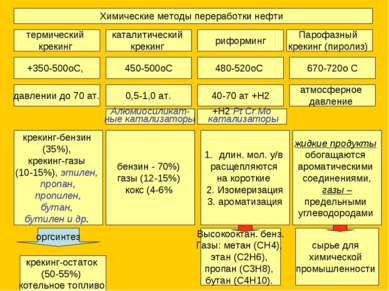 Химические методы переработки нефти термический крекинг каталитический крекинг риформинг Парофазный крекинг (пиролиз) +350-500оС, 450-500оС 480-520оС 670-720о С крекинг-бензин (35%), крекинг-газы (10-15%), этилен, пропан, пропилен, бутан, бутилен и др. давлении до 70 ат. 0,5-1,0 ат. 40-70 ат +H2 атмосферное давление крекинг-остаток (50-55%) котельное топливо оргсинтез Алюмиосиликат- ные катализаторы бензин - 70%) газы (12-15%) кокс (4-6% длин. мол. у/в расщепляются на короткие 2. Изомеризация 3. ароматизация +H2 Pt Cr Mo катализаторы Высокооктан. бенз. Газы: метан (СН4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). жидкие продукты обогащаются ароматическими соединениями, газы – предельными углеводородами сырье для химической промышленности
Химические методы переработки нефти термический крекинг каталитический крекинг риформинг Парофазный крекинг (пиролиз) +350-500оС, 450-500оС 480-520оС 670-720о С крекинг-бензин (35%), крекинг-газы (10-15%), этилен, пропан, пропилен, бутан, бутилен и др. давлении до 70 ат. 0,5-1,0 ат. 40-70 ат +H2 атмосферное давление крекинг-остаток (50-55%) котельное топливо оргсинтез Алюмиосиликат- ные катализаторы бензин - 70%) газы (12-15%) кокс (4-6% длин. мол. у/в расщепляются на короткие 2. Изомеризация 3. ароматизация +H2 Pt Cr Mo катализаторы Высокооктан. бенз. Газы: метан (СН4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). жидкие продукты обогащаются ароматическими соединениями, газы – предельными углеводородами сырье для химической промышленности
Cлайд 6
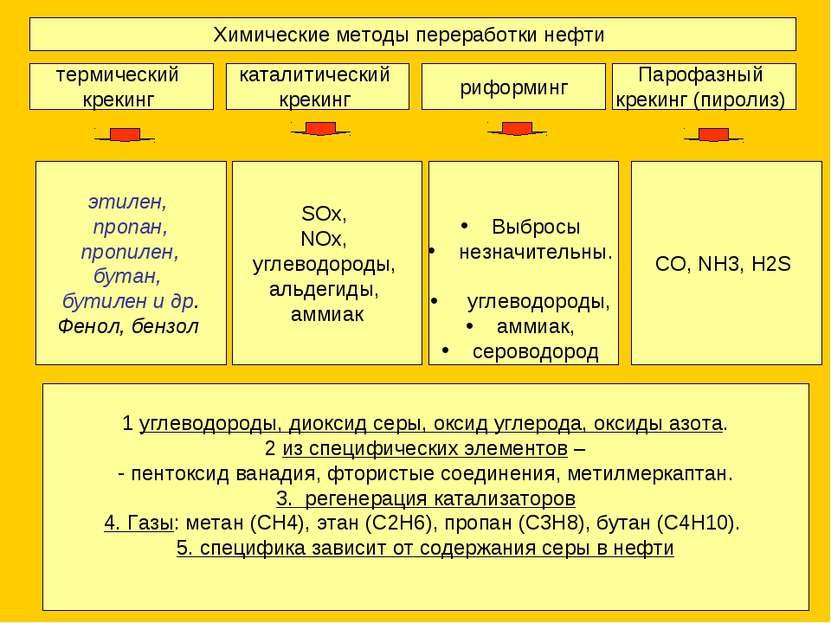
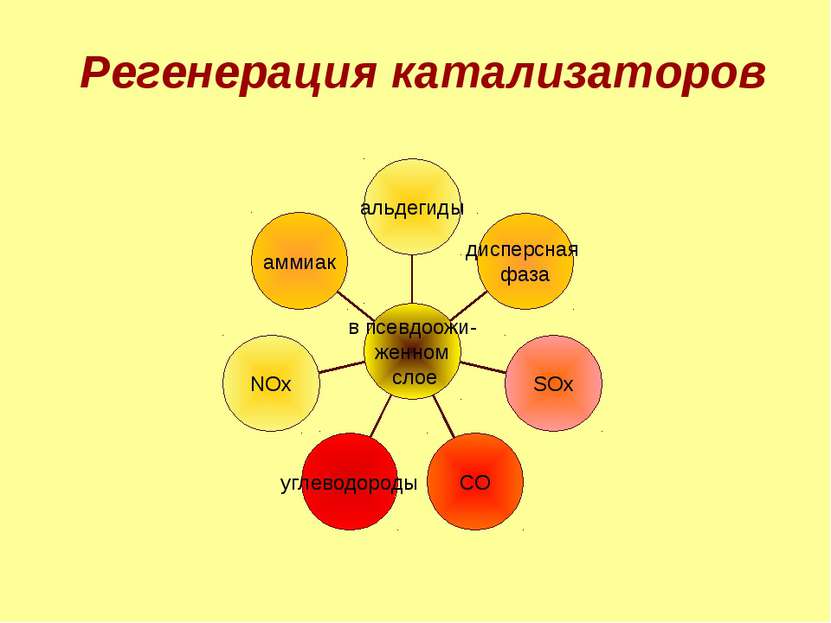
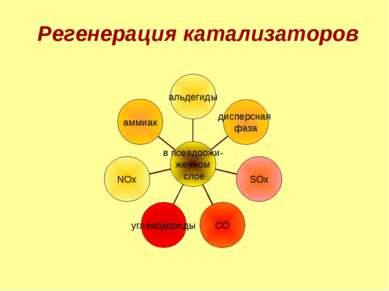
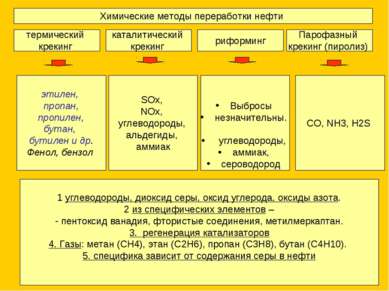 Химические методы переработки нефти термический крекинг каталитический крекинг риформинг Парофазный крекинг (пиролиз) этилен, пропан, пропилен, бутан, бутилен и др. Фенол, бензол SOx, NOx, углеводороды, альдегиды, аммиак Выбросы незначительны. углеводороды, аммиак, сероводород 1 углеводороды, диоксид серы, оксид углерода, оксиды азота. 2 из специфических элементов – пентоксид ванадия, фтористые соединения, метилмеркаптан. 3. регенерация катализаторов 4. Газы: метан (СН4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). 5. специфика зависит от содержания серы в нефти CO, NH3, H2S
Химические методы переработки нефти термический крекинг каталитический крекинг риформинг Парофазный крекинг (пиролиз) этилен, пропан, пропилен, бутан, бутилен и др. Фенол, бензол SOx, NOx, углеводороды, альдегиды, аммиак Выбросы незначительны. углеводороды, аммиак, сероводород 1 углеводороды, диоксид серы, оксид углерода, оксиды азота. 2 из специфических элементов – пентоксид ванадия, фтористые соединения, метилмеркаптан. 3. регенерация катализаторов 4. Газы: метан (СН4), этан (С2Н6), пропан (С3Н8), бутан (С4Н10). 5. специфика зависит от содержания серы в нефти CO, NH3, H2S
Cлайд 8
 Со сточными водами НПЗ в поверхностные воды поступает нефтепродукты, сульфаты, хлориды, соединения азота, фенолы, соли тяжелых металлов
Со сточными водами НПЗ в поверхностные воды поступает нефтепродукты, сульфаты, хлориды, соединения азота, фенолы, соли тяжелых металлов
Cлайд 9
 токсичные отходы состоят из: биологически активного газа, который остается после эксплуатации очистных сооружений, осадков из резервуаров, сернисто-щелочных стоков.
токсичные отходы состоят из: биологически активного газа, который остается после эксплуатации очистных сооружений, осадков из резервуаров, сернисто-щелочных стоков.
Cлайд 11
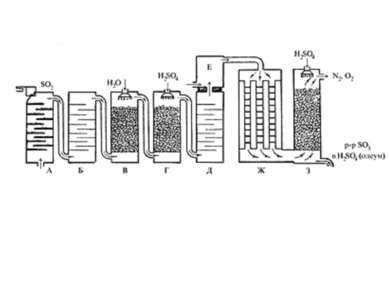
 Производство серной кислоты Серная кислота – H2SO4 бесцветная тяжелая маслянистая жидкость, кипящая при 304оС и кристаллизующаяся при 10,4оС. Исходное вещество в производстве серной кислоты является сернистый ангидрид SO2. Для получения SO2. применяется - серный колчедан, - элементарная сера, - сероводородные и сернистые газы, выделяемые при переработке руд цветных и черных металлов, очистке нефти.
Производство серной кислоты Серная кислота – H2SO4 бесцветная тяжелая маслянистая жидкость, кипящая при 304оС и кристаллизующаяся при 10,4оС. Исходное вещество в производстве серной кислоты является сернистый ангидрид SO2. Для получения SO2. применяется - серный колчедан, - элементарная сера, - сероводородные и сернистые газы, выделяемые при переработке руд цветных и черных металлов, очистке нефти.
Cлайд 12
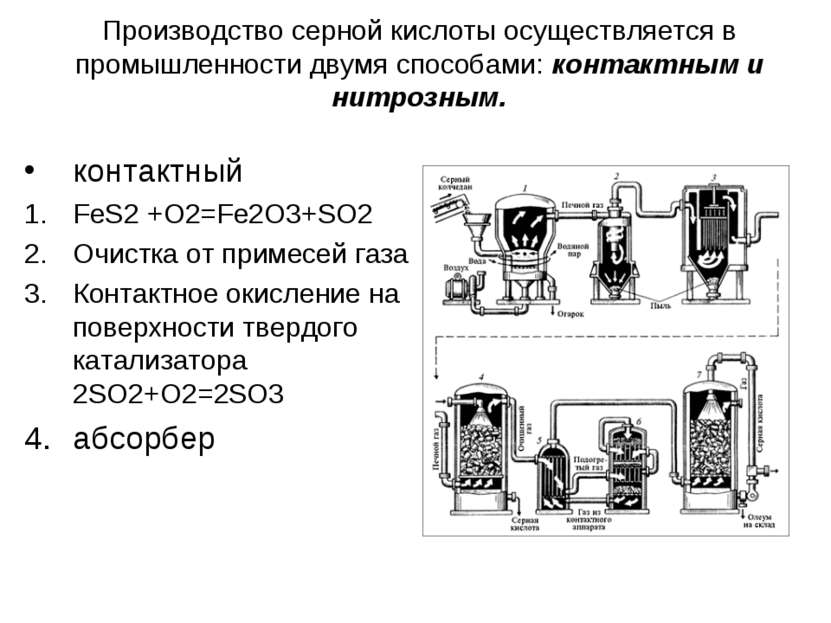
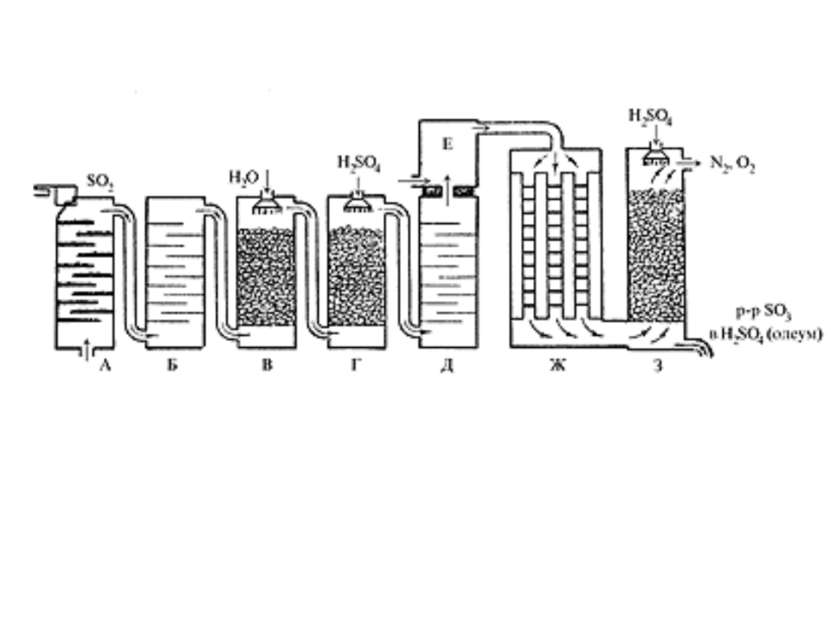
 Производство серной кислоты осуществляется в промышленности двумя способами: контактным и нитрозным. контактный FeS2 +O2=Fe2O3+SO2 Очистка от примесей газа Контактное окисление на поверхности твердого катализатора 2SO2+O2=2SO3 абсорбер
Производство серной кислоты осуществляется в промышленности двумя способами: контактным и нитрозным. контактный FeS2 +O2=Fe2O3+SO2 Очистка от примесей газа Контактное окисление на поверхности твердого катализатора 2SO2+O2=2SO3 абсорбер
Cлайд 14
 Нитрозный способ – известен с середины 18 в. 1. 2SO2+H2O+NO2=H2SO4+NO ОКИСЛИТЕЛЕМ ЯВЛЯЕТСЯ NO2, ОН ВОССТАНАВЛИВАЕТСЯ 2. ОКИСЛЕНИЕ КИСЛОРОДОМ ВОЗДУХА 2NO+O2=2NO2 До 20-х гг. нашего века он осуществлялся в больших свинцовых камерах, сейчас в специальных башнях
Нитрозный способ – известен с середины 18 в. 1. 2SO2+H2O+NO2=H2SO4+NO ОКИСЛИТЕЛЕМ ЯВЛЯЕТСЯ NO2, ОН ВОССТАНАВЛИВАЕТСЯ 2. ОКИСЛЕНИЕ КИСЛОРОДОМ ВОЗДУХА 2NO+O2=2NO2 До 20-х гг. нашего века он осуществлялся в больших свинцовых камерах, сейчас в специальных башнях
Cлайд 21
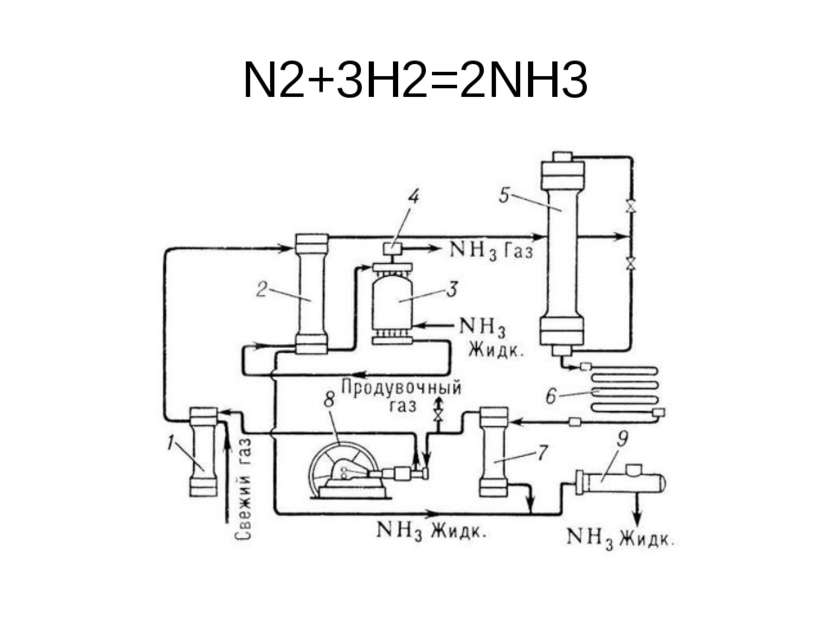
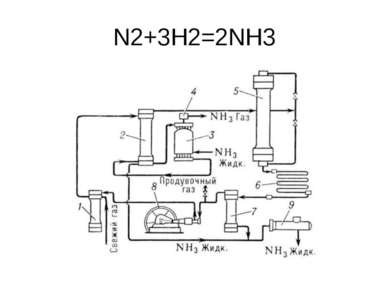
 Получение слабой азотной кислоты имеет три стадии: 1. окисление аммиака до окиси азота NO; (аммиак и избыток воздуха пропускают над нагретым до 800-900 гр. Pt катализатор 4NH3 + 5 O2 = 4 NO + 6 H2O 2. окисление оксида азота до двуокиси NO2; 2NO + O2 = 2NO2 3. поглощение NO2 водой с образованием азотной кислоты. 3NO2 + H2O = 2HNO3 + NO
Получение слабой азотной кислоты имеет три стадии: 1. окисление аммиака до окиси азота NO; (аммиак и избыток воздуха пропускают над нагретым до 800-900 гр. Pt катализатор 4NH3 + 5 O2 = 4 NO + 6 H2O 2. окисление оксида азота до двуокиси NO2; 2NO + O2 = 2NO2 3. поглощение NO2 водой с образованием азотной кислоты. 3NO2 + H2O = 2HNO3 + NO
Cлайд 22
 Окисление аммиака проводится при температуре 800-900оС в присутствии катализатора, изготовленного из сплава платины и родия.
Окисление аммиака проводится при температуре 800-900оС в присутствии катализатора, изготовленного из сплава платины и родия.
Cлайд 23
 Кроме платины, могут применяться менее активные катализаторы на основе окиси кобальта или железа с активирующими добавками.
Кроме платины, могут применяться менее активные катализаторы на основе окиси кобальта или железа с активирующими добавками.
Cлайд 24
 Для получения 1 т разбавленной азотной кислоты в установках с нормальным атмосферным давлением расходуется 300 кг аммиака, 100 м3 воды и 80 кВт.ч электроэнергии.
Для получения 1 т разбавленной азотной кислоты в установках с нормальным атмосферным давлением расходуется 300 кг аммиака, 100 м3 воды и 80 кВт.ч электроэнергии.
Cлайд 26
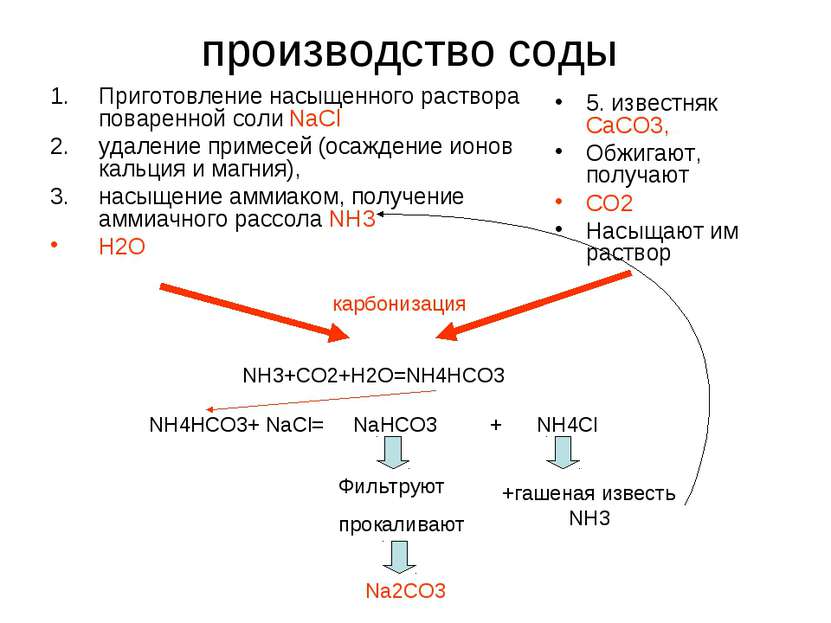
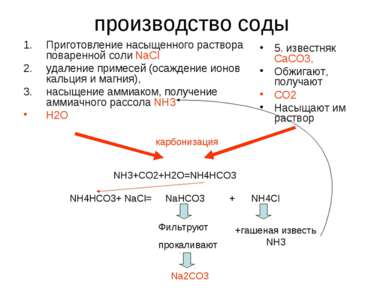 производство соды Приготовление насыщенного раствора поваренной соли NaCl удаление примесей (oсаждение ионов кальция и магния), насыщение аммиаком, получение аммиачного рассола NH3 H2O 5. известняк СаСО3, Обжигают, получают СО2 Насыщают им раствор карбонизация NH3+CO2+H2O=NH4HCO3 NH4HCO3+ NaCl= NaHCO3 + NH4Cl Фильтруют прокаливают +гашеная известь NH3 Na2CO3
производство соды Приготовление насыщенного раствора поваренной соли NaCl удаление примесей (oсаждение ионов кальция и магния), насыщение аммиаком, получение аммиачного рассола NH3 H2O 5. известняк СаСО3, Обжигают, получают СО2 Насыщают им раствор карбонизация NH3+CO2+H2O=NH4HCO3 NH4HCO3+ NaCl= NaHCO3 + NH4Cl Фильтруют прокаливают +гашеная известь NH3 Na2CO3
Cлайд 27
 При получении 1 т соды - образуется около 1 т NH4Cl, раствор которого обрабатывают известковым молоком для регенерации аммиака. Образующуюся дистиллярную жидкость – суспензию нерастворимых соединений в растворе CaCl2 и NaCl направляют в отстойники – шламонакопители. Их называют “белыми морями”. Один только содовый завод может занимать до 3-4 га под шламонакопитель
При получении 1 т соды - образуется около 1 т NH4Cl, раствор которого обрабатывают известковым молоком для регенерации аммиака. Образующуюся дистиллярную жидкость – суспензию нерастворимых соединений в растворе CaCl2 и NaCl направляют в отстойники – шламонакопители. Их называют “белыми морями”. Один только содовый завод может занимать до 3-4 га под шламонакопитель
Cлайд 28
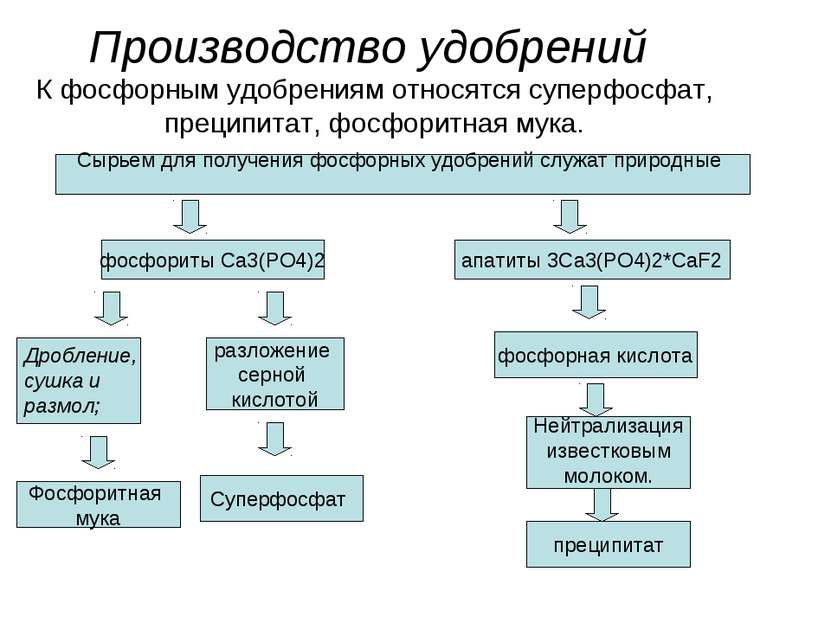
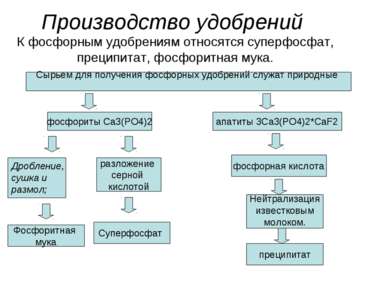 Производство удобрений К фосфорным удобрениям относятся суперфосфат, преципитат, фосфоритная мука. Сырьем для получения фосфорных удобрений служат природные фосфориты Ca3(PO4)2 апатиты 3Ca3(PO4)2*CaF2 Дробление, сушка и размол; Фосфоритная мука разложение серной кислотой Суперфосфат фосфорная кислота Нейтрализация известковым молоком. преципитат
Производство удобрений К фосфорным удобрениям относятся суперфосфат, преципитат, фосфоритная мука. Сырьем для получения фосфорных удобрений служат природные фосфориты Ca3(PO4)2 апатиты 3Ca3(PO4)2*CaF2 Дробление, сушка и размол; Фосфоритная мука разложение серной кислотой Суперфосфат фосфорная кислота Нейтрализация известковым молоком. преципитат
Cлайд 29
 Главный загрязнитель при производстве фосфорных удобрений – фтористые соединения. Фториды присутствуют как в газообразном состоянии, так и в виде аэрозолей. Нормы выброса фторидов при производстве фосфорных удобрений обычно пропорциональны к количеству P2O5, введенному в производство. Например, в штате Флорида, где производят основную часть фосфорных удобрений, нормируется 1 г фторида на 1 т P2O5, используемого в производстве.
Главный загрязнитель при производстве фосфорных удобрений – фтористые соединения. Фториды присутствуют как в газообразном состоянии, так и в виде аэрозолей. Нормы выброса фторидов при производстве фосфорных удобрений обычно пропорциональны к количеству P2O5, введенному в производство. Например, в штате Флорида, где производят основную часть фосфорных удобрений, нормируется 1 г фторида на 1 т P2O5, используемого в производстве.
Cлайд 30
 Калийные удобрения это хлорид калия (KCl), сульфат калия (K2SO4) сульфат калия-магния (K2SO4*2MgSO4). Сырьем для получения хлористого калия является сильвинит KCl+NaCl и карналит MgCl2* KCl *6H2O.
Калийные удобрения это хлорид калия (KCl), сульфат калия (K2SO4) сульфат калия-магния (K2SO4*2MgSO4). Сырьем для получения хлористого калия является сильвинит KCl+NaCl и карналит MgCl2* KCl *6H2O.
Cлайд 31
 Производство калийных удобрений включает: 1 отделение хлористого калия от хлорида натрия и глины. 2. Сильвинит размалывают, растворяют, раствор охлаждают, отделяют соли и сушат их. 3. если флотируют, обогащая КCl, то образуются галитовые отвалы
Производство калийных удобрений включает: 1 отделение хлористого калия от хлорида натрия и глины. 2. Сильвинит размалывают, растворяют, раствор охлаждают, отделяют соли и сушат их. 3. если флотируют, обогащая КCl, то образуются галитовые отвалы
Cлайд 32
 В технологии изготовления хлорида калия можно выделить 4 этапа, при которых происходят наиболее существенные выбросы в атмосферу мелких частиц: 1 прессование, 2 дробление, 3 сортировка 4 транспортировка.
В технологии изготовления хлорида калия можно выделить 4 этапа, при которых происходят наиболее существенные выбросы в атмосферу мелких частиц: 1 прессование, 2 дробление, 3 сортировка 4 транспортировка.
Cлайд 33
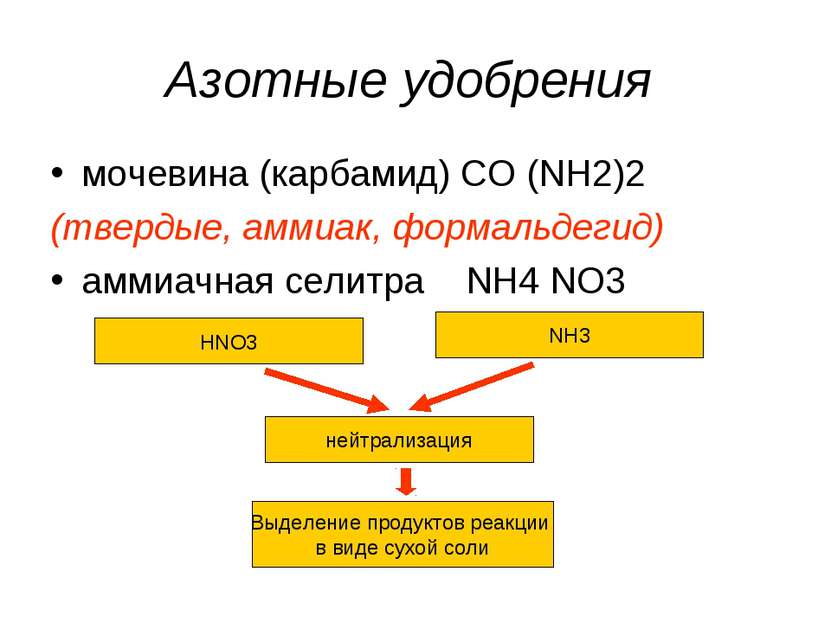
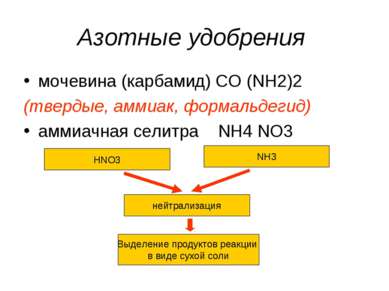 Азотные удобрения мочевина (карбамид) CO (NH2)2 (твердые, аммиак, формальдегид) аммиачная селитра NH4 NO3 HNO3 NH3 нейтрализация Выделение продуктов реакции в виде сухой соли
Азотные удобрения мочевина (карбамид) CO (NH2)2 (твердые, аммиак, формальдегид) аммиачная селитра NH4 NO3 HNO3 NH3 нейтрализация Выделение продуктов реакции в виде сухой соли
Cлайд 34
 ядохимикаты Инсектициды: 1. парижская зелень 3 Сu(AsO2)2*Cu(CH3COO)2 Cырье - As2O3 руды обжигают соли 2. Фтористый и кремнефтористый натрий Получают из отходов производст. суперфосфата 3. Гексахлоран C6H6Cl6 получается присоединением Cl к бензолу 4. ДДТ, тиофос
ядохимикаты Инсектициды: 1. парижская зелень 3 Сu(AsO2)2*Cu(CH3COO)2 Cырье - As2O3 руды обжигают соли 2. Фтористый и кремнефтористый натрий Получают из отходов производст. суперфосфата 3. Гексахлоран C6H6Cl6 получается присоединением Cl к бензолу 4. ДДТ, тиофос
Cлайд 35
 II. Фунгициды (грибковые заболевания) Бордосская жидкость (медь содерж.) Получается смешиванием медного купороса с известковым молоком 2. Серосодержащие (получаются при очистке коксового газа от H2S) 3. Формалин 4. Гранозан (получается при взаимодействии диэтилртути с сулемой в спиртовом растворе) III. Гербициды Хлор и нитропроизводные фенола
II. Фунгициды (грибковые заболевания) Бордосская жидкость (медь содерж.) Получается смешиванием медного купороса с известковым молоком 2. Серосодержащие (получаются при очистке коксового газа от H2S) 3. Формалин 4. Гранозан (получается при взаимодействии диэтилртути с сулемой в спиртовом растворе) III. Гербициды Хлор и нитропроизводные фенола
Cлайд 36
 Для производств неорганической химии: 1. в целом 3 основных загрязнителя – SO2, NOx, взвешенные частицы. 2. легко испаряющиеся неорганические соединения – Pb, HF, SiF4, HCl и др. галогеноводородные кислоты. 3. аммиак – в производстве аммиака, нитрата аммония, фосфата аммония, сульфата аммония около 400 ненормируемых загрязнителей, имеющих широкий диапазон опасных свойств, т.к. называемые некритериальные загрязнители хлорводород – в производстве соляной кислоты фтороводород – в производстве фосфора, фосфорной кислоты. Диоксины - Основными источниками поступления диоксинов в окружающую среду являются хлорфеноловые производства, заводы по производству химических удобрений, полихлорированных бифенилов (ПХБ), массовой хлорной продукции
Для производств неорганической химии: 1. в целом 3 основных загрязнителя – SO2, NOx, взвешенные частицы. 2. легко испаряющиеся неорганические соединения – Pb, HF, SiF4, HCl и др. галогеноводородные кислоты. 3. аммиак – в производстве аммиака, нитрата аммония, фосфата аммония, сульфата аммония около 400 ненормируемых загрязнителей, имеющих широкий диапазон опасных свойств, т.к. называемые некритериальные загрязнители хлорводород – в производстве соляной кислоты фтороводород – в производстве фосфора, фосфорной кислоты. Диоксины - Основными источниками поступления диоксинов в окружающую среду являются хлорфеноловые производства, заводы по производству химических удобрений, полихлорированных бифенилов (ПХБ), массовой хлорной продукции