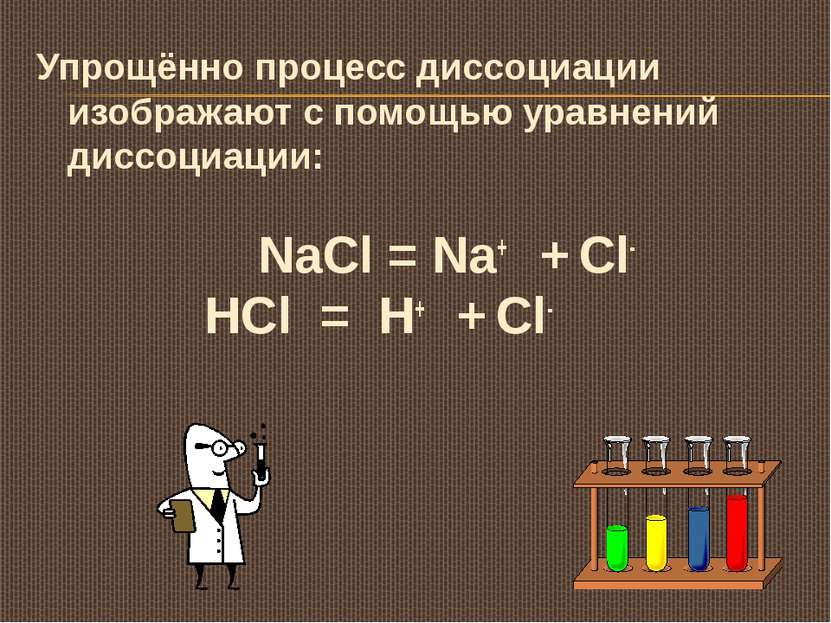X
Код презентации скопируйте его
Основные положения ТЭД
Скачать эту презентациюПрезентация на тему Основные положения ТЭД
Скачать эту презентациюCлайд 2
 Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и неэлектролиты
Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и неэлектролиты
Cлайд 3
 Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества с ионной и ковалентной полярной связью Все растворимые кислоты, основания (щёлочи) и соли Вещества с ковалентной неполярной и слабополярной связью Все простые вещества, все оксиды и н/р кислоты, основания и соли.
Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества с ионной и ковалентной полярной связью Все растворимые кислоты, основания (щёлочи) и соли Вещества с ковалентной неполярной и слабополярной связью Все простые вещества, все оксиды и н/р кислоты, основания и соли.
Cлайд 4
 Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам: KCl, O2 , HNO3 ,CuO. Назовите из перечня веществ электролиты (не забудьте воспользоваться таблицей растворимости !): BaCl2 , CaO, H2 SO4 , NaOH, Cl2 , Zn(OH)2
Укажите вид связи и принадлежность данных веществ к электролитам и неэлектролитам: KCl, O2 , HNO3 ,CuO. Назовите из перечня веществ электролиты (не забудьте воспользоваться таблицей растворимости !): BaCl2 , CaO, H2 SO4 , NaOH, Cl2 , Zn(OH)2
Cлайд 5
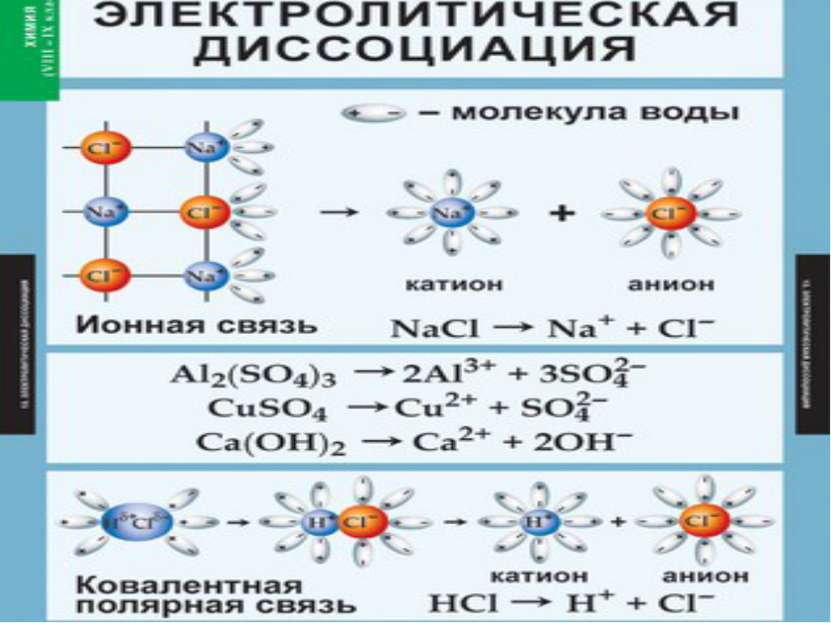
 В РАСТВОРАХ ЭЛЕКТРОЛИТЫ ДИССОЦИИРУЮТ, Т.Е. РАСПАДАЮТСЯ НА ИОНЫ. Ионы – ЭТО ПОЛОЖИТЕЛЬНО ИЛИ ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫЕ ЧАСТИЦЫ, В КОТОРЫЕ ПРЕВРАЩАЮТСЯ АТОМЫ ИЛИ ГРУППЫ АТОМОВ ОДНОГО ИЛИ НЕСКОЛЬКИХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В РЕЗУЛЬТАТЕ ОТДАЧИ ИЛИ ПРИСОЕДИНЕНИЯ ЭЛЕКТРОНОВ.
В РАСТВОРАХ ЭЛЕКТРОЛИТЫ ДИССОЦИИРУЮТ, Т.Е. РАСПАДАЮТСЯ НА ИОНЫ. Ионы – ЭТО ПОЛОЖИТЕЛЬНО ИЛИ ОТРИЦАТЕЛЬНО ЗАРЯЖЕННЫЕ ЧАСТИЦЫ, В КОТОРЫЕ ПРЕВРАЩАЮТСЯ АТОМЫ ИЛИ ГРУППЫ АТОМОВ ОДНОГО ИЛИ НЕСКОЛЬКИХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ В РЕЗУЛЬТАТЕ ОТДАЧИ ИЛИ ПРИСОЕДИНЕНИЯ ЭЛЕКТРОНОВ.
Cлайд 7
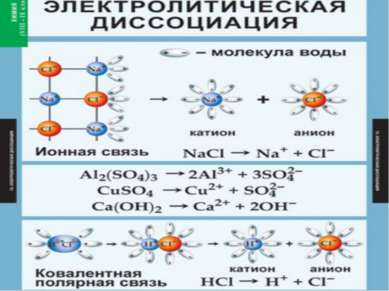
 Вещества с ионной связью: Ориентация диполей воды гидратация диссоциация. Вещества с ковалентной связью: Ориентация диполей воды гидратация ионизация диссоциация
Вещества с ионной связью: Ориентация диполей воды гидратация диссоциация. Вещества с ковалентной связью: Ориентация диполей воды гидратация ионизация диссоциация
Cлайд 9
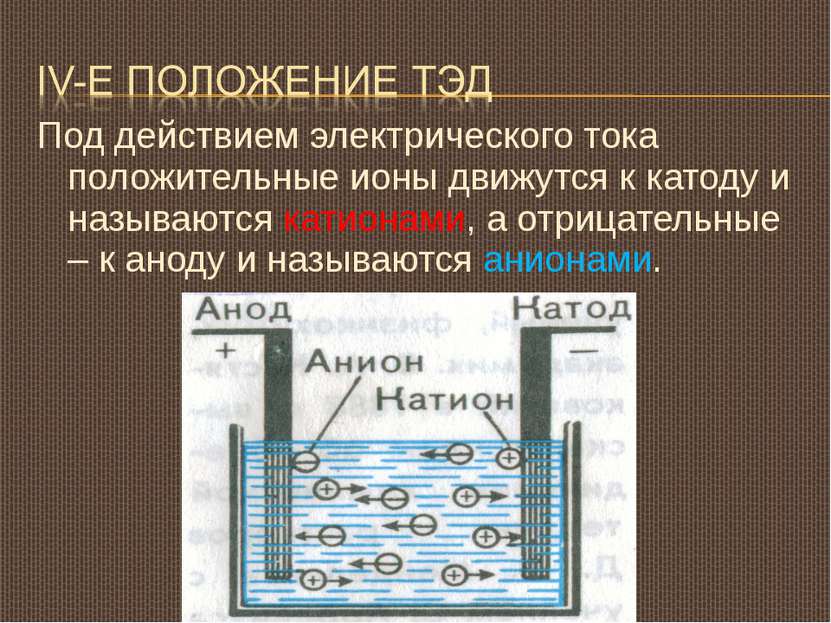
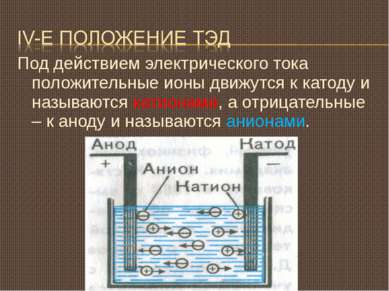 Под действием электрического тока положительные ионы движутся к катоду и называются катионами, а отрицательные – к аноду и называются анионами.
Под действием электрического тока положительные ионы движутся к катоду и называются катионами, а отрицательные – к аноду и называются анионами.
Cлайд 10
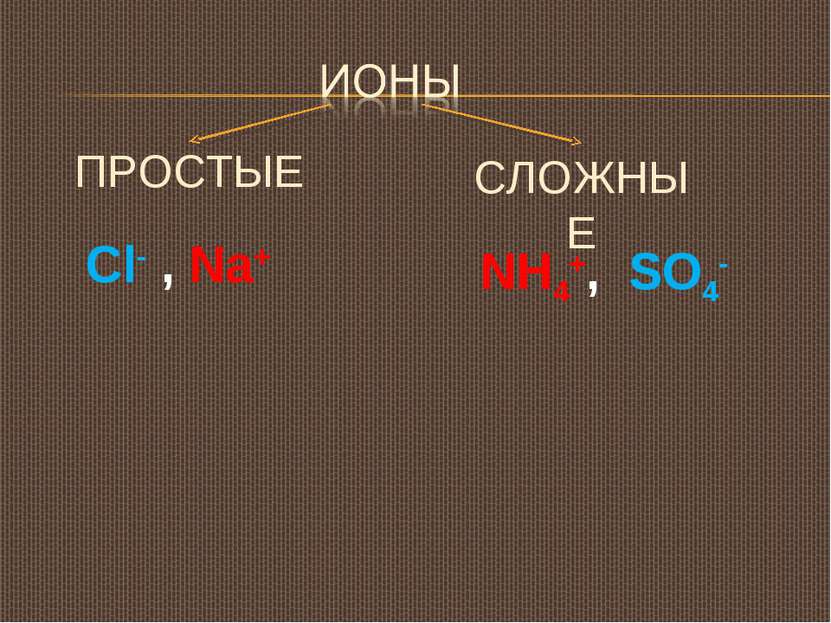
 Типы ионов По заряду: положительные, или катионы: Катионы металлов ( Мn+ ) Катион водорода (H+) Катион аммония (NH4+) Отрицательные, или анионы: Анион гидроксогруппы, или гидроксид-анион (OH-) Анионы кислотных остатков (SO4-, Cl-, NO3-) По отношению к воде: Гидратированные Негидратированные ( в безводных средах)
Типы ионов По заряду: положительные, или катионы: Катионы металлов ( Мn+ ) Катион водорода (H+) Катион аммония (NH4+) Отрицательные, или анионы: Анион гидроксогруппы, или гидроксид-анион (OH-) Анионы кислотных остатков (SO4-, Cl-, NO3-) По отношению к воде: Гидратированные Негидратированные ( в безводных средах)
Cлайд 11
 Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+ + Cl-
Упрощённо процесс диссоциации изображают с помощью уравнений диссоциации: NaCl = Na+ + Cl- HCl = H+ + Cl-
Cлайд 12
 Назовите частицы: а) H, H2 , H+ ; б) Cl2 , Cl, Cl- . Назовите катионы и анионы в соединениях, формулы которых: CuCl2 , AgNO3 , Ca(OH)2 , H3 PO4 .
Назовите частицы: а) H, H2 , H+ ; б) Cl2 , Cl, Cl- . Назовите катионы и анионы в соединениях, формулы которых: CuCl2 , AgNO3 , Ca(OH)2 , H3 PO4 .
Cлайд 13
 Разные электролиты по-разному диссоциируют на ионы и поэтому делятся на: Сильные (соли, щелочи, некоторые кислоты – HCl, HNO3, H2SO4, у которых ά → 1; Слабые (гидрат аммиака NH4*H2O, некоторые кислоты – HNO2, H2SO3, H2S, H2CO3 , у которых ά → 0.
Разные электролиты по-разному диссоциируют на ионы и поэтому делятся на: Сильные (соли, щелочи, некоторые кислоты – HCl, HNO3, H2SO4, у которых ά → 1; Слабые (гидрат аммиака NH4*H2O, некоторые кислоты – HNO2, H2SO3, H2S, H2CO3 , у которых ά → 0.
Cлайд 14
 Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. По характеру образующихся ионов различают три типа электролитов: Кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.
Свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. По характеру образующихся ионов различают три типа электролитов: Кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.
Cлайд 15
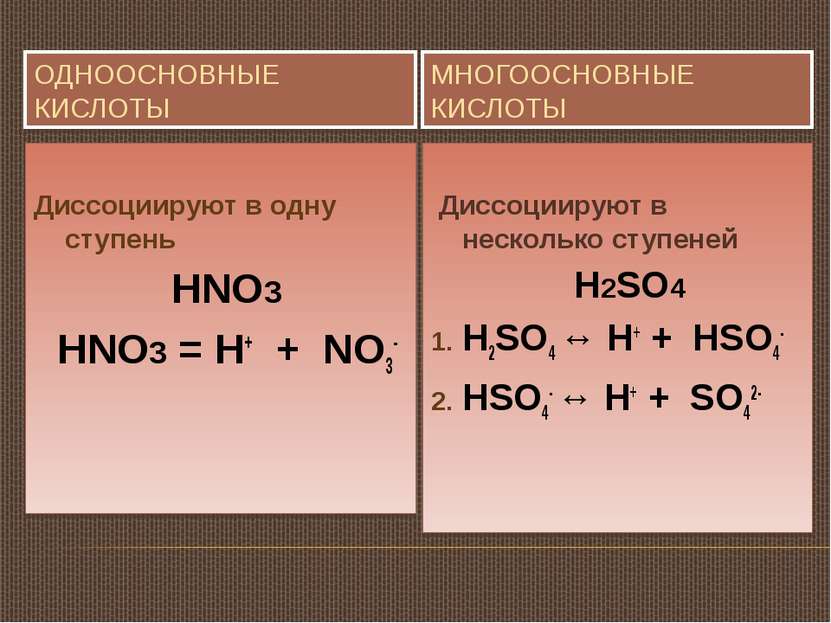
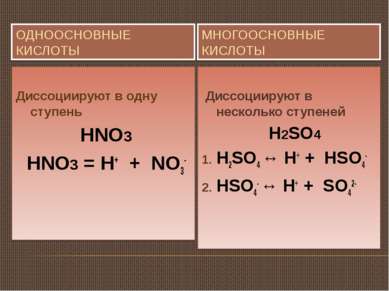 ОДНООСНОВНЫЕ КИСЛОТЫ МНОГООСНОВНЫЕ КИСЛОТЫ Диссоциируют в одну ступень HNO3 HNO3 = H+ + NO3- Диссоциируют в несколько ступеней H2SO4 H2SO4 ↔ H+ + HSO4- HSO4- ↔ H+ + SO42-
ОДНООСНОВНЫЕ КИСЛОТЫ МНОГООСНОВНЫЕ КИСЛОТЫ Диссоциируют в одну ступень HNO3 HNO3 = H+ + NO3- Диссоциируют в несколько ступеней H2SO4 H2SO4 ↔ H+ + HSO4- HSO4- ↔ H+ + SO42-
Cлайд 16
 ОДНОКИСЛОТНЫЕ ОСНОВАНИЯ МНОГОКИСЛОТНЫЕ ОСНОВАНИЯ диссоциируют в одну ступень NaOH NaOH ↔ Na+ + OH- диссоциируют ступенчато Ba(OH)2 Ba(OH)2 ↔ BaOH+ + OH- BaOH+ ↔ Ba2+ + OH-
ОДНОКИСЛОТНЫЕ ОСНОВАНИЯ МНОГОКИСЛОТНЫЕ ОСНОВАНИЯ диссоциируют в одну ступень NaOH NaOH ↔ Na+ + OH- диссоциируют ступенчато Ba(OH)2 Ba(OH)2 ↔ BaOH+ + OH- BaOH+ ↔ Ba2+ + OH-