X
Код презентации скопируйте его
Основные положения молекулярно-кинетической теории
Скачать эту презентациюПрезентация на тему Основные положения молекулярно-кинетической теории
Скачать эту презентациюCлайд 1
 УРОК ФИЗИКИ В 10 КЛАССЕ Основные положения МКТ Учитель Кононов Геннадий Григорьевич СОШ № 29 Славянский район Краснодарского края
УРОК ФИЗИКИ В 10 КЛАССЕ Основные положения МКТ Учитель Кононов Геннадий Григорьевич СОШ № 29 Славянский район Краснодарского края
Cлайд 2
 Тема урока. Микропараметры вещества 1. Молекулярная физика 1.1. Основы МКТ План урока 2. Размеры молекул. 3. Число молекул. 4. Масса молекулы. 5. Количество вещества. 6. Молярная масса. 7. Формулы. 1. Микро- и макропараметры.
Тема урока. Микропараметры вещества 1. Молекулярная физика 1.1. Основы МКТ План урока 2. Размеры молекул. 3. Число молекул. 4. Масса молекулы. 5. Количество вещества. 6. Молярная масса. 7. Формулы. 1. Микро- и макропараметры.
Cлайд 4
 ПЕРВОЕ ПОЛОЖЕНИЕ 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, атомов, ионов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
ПЕРВОЕ ПОЛОЖЕНИЕ 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц – молекул, атомов, ионов. Молекулы и атомы представляют собой электрически нейтральные частицы. При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Cлайд 5
 Основные положения МКТ • Все тела состоят из малых частиц, между которыми есть промежутки. • Частицы тел постоянно и беспорядочно движутся. • Частицы тел взаимодействуют друг с другом: притягиваются и отталкиваются.
Основные положения МКТ • Все тела состоят из малых частиц, между которыми есть промежутки. • Частицы тел постоянно и беспорядочно движутся. • Частицы тел взаимодействуют друг с другом: притягиваются и отталкиваются.
Cлайд 6
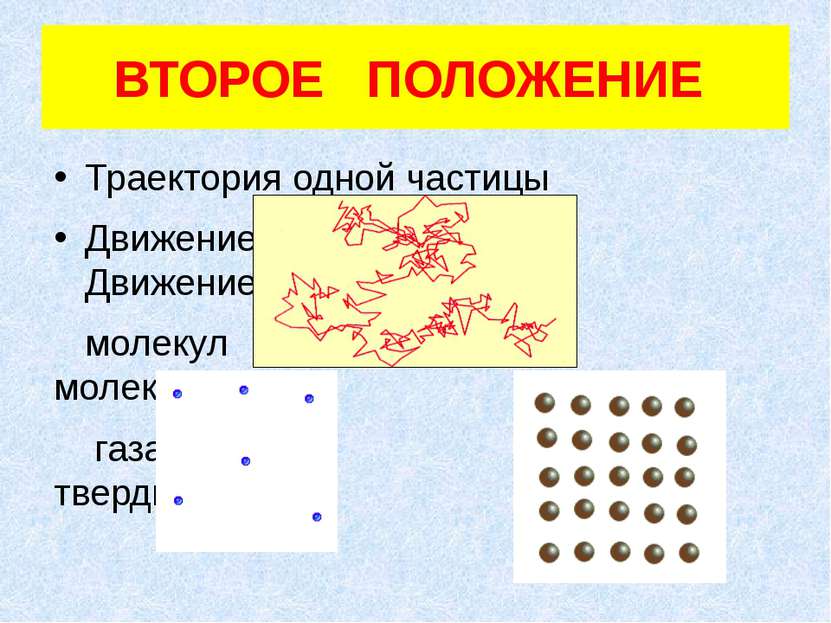
 ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение Движение молекул молекул газа твердых тел
ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение Движение молекул молекул газа твердых тел
Cлайд 7
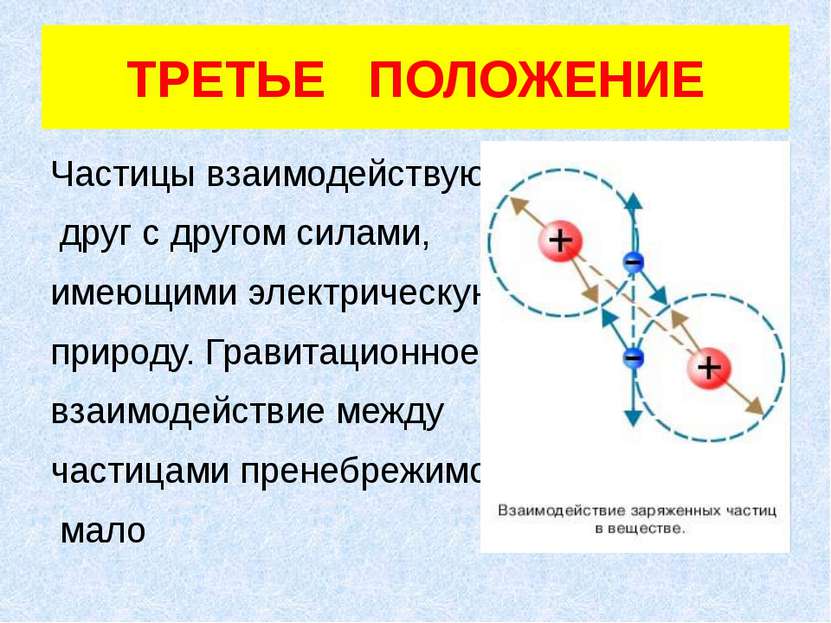
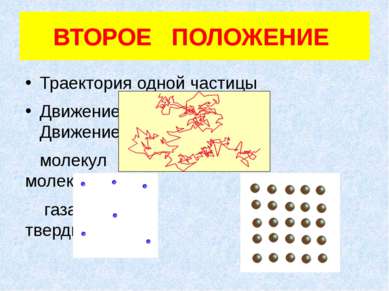 ТРЕТЬЕ ПОЛОЖЕНИЕ Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало
ТРЕТЬЕ ПОЛОЖЕНИЕ Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало
Cлайд 8
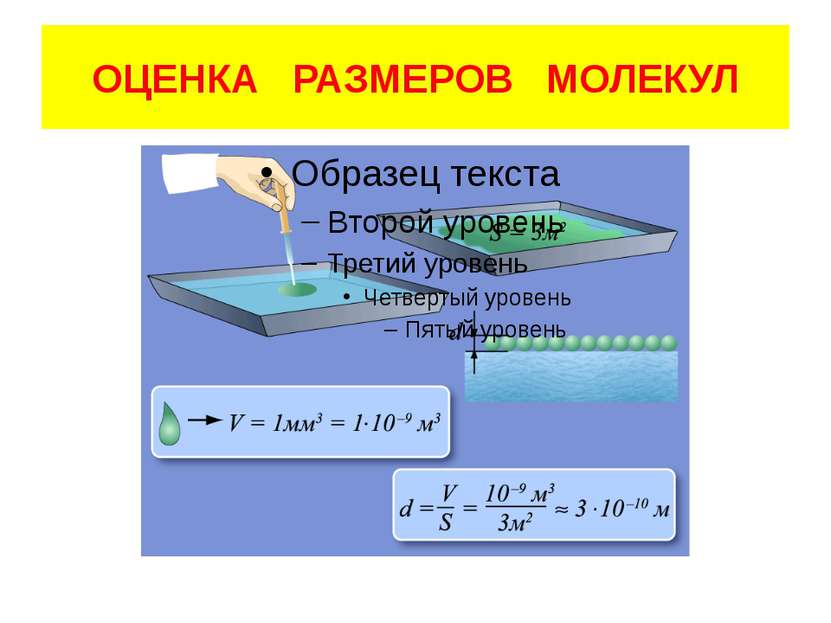
 ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ I положение 1. Дробление вещества 2. Испарение жидкостей 3. Расширение тел при нагревании
ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ I положение 1. Дробление вещества 2. Испарение жидкостей 3. Расширение тел при нагревании
Cлайд 9
 II положение 1. Диффузия – перемешивание молекул разных веществ 2.Броуновское движение – движение взвешенных в жидкости частиц ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
II положение 1. Диффузия – перемешивание молекул разных веществ 2.Броуновское движение – движение взвешенных в жидкости частиц ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
Cлайд 10
 III положение Силы упругости Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
III положение Силы упругости Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
Cлайд 12
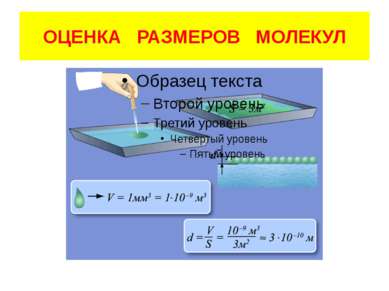 Количество вещества В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул. Зависит это количество частиц от рода вещества. А в единице количества вещества - 1 моле, находится одинаковое количество частиц. 1 кг Алюминий 1 кг Золото 1 кг Лед N=2,2 1025 атомов N=3 1024 атомов N=3,3 1025 молекул N = 6 1023 атомов N = 6 1023 атомов N = 6 1023 молекул Алюминий Золото Лед 1 моль 1 моль 1 моль
Количество вещества В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул. Зависит это количество частиц от рода вещества. А в единице количества вещества - 1 моле, находится одинаковое количество частиц. 1 кг Алюминий 1 кг Золото 1 кг Лед N=2,2 1025 атомов N=3 1024 атомов N=3,3 1025 молекул N = 6 1023 атомов N = 6 1023 атомов N = 6 1023 молекул Алюминий Золото Лед 1 моль 1 моль 1 моль
Cлайд 13
 КОЛИЧЕСТВО ВЕЩЕСТВА В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль). Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C.
КОЛИЧЕСТВО ВЕЩЕСТВА В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется молем (моль). Моль – это количество вещества, содержащее столько же частиц (молекул), сколько содержится атомов в 0,012 кг углерода 12C.
Cлайд 15
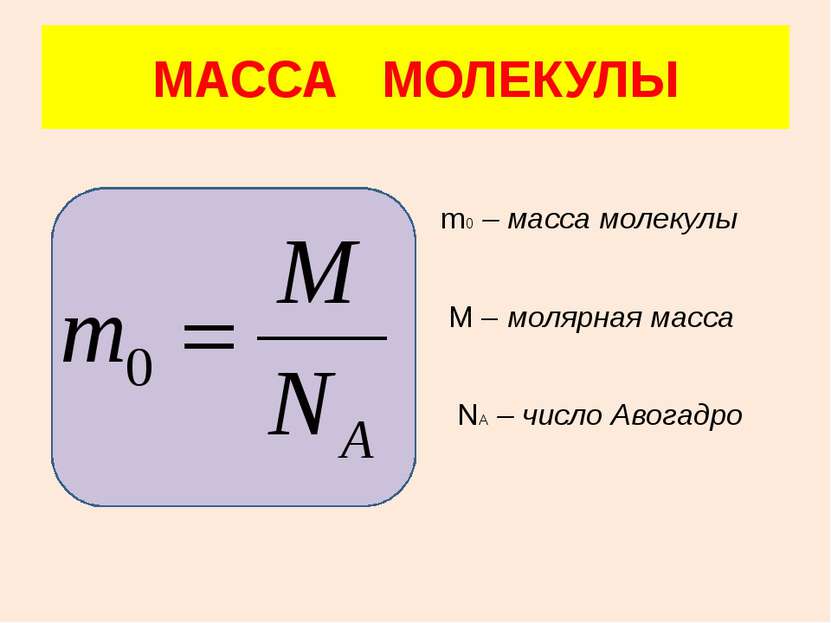
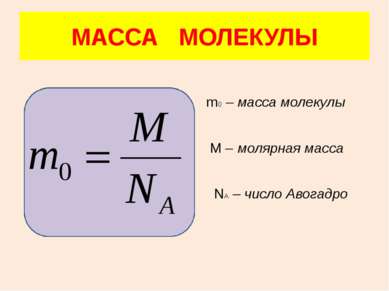
 В одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NA: NA = 6·1023 моль–1 Все газы двухатомны, кроме инертных М(Н2) = 2г/моль М(О2) = 32г/моль М(N2) = 28г/моль М(Не) = 4г/моль МОЛЯРНАЯ МАССА
В одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется постоянной Авогадро NA: NA = 6·1023 моль–1 Все газы двухатомны, кроме инертных М(Н2) = 2г/моль М(О2) = 32г/моль М(N2) = 28г/моль М(Не) = 4г/моль МОЛЯРНАЯ МАССА
Cлайд 18
 2. Сколько молекул содержится в 50г Аℓ? М(Аℓ) = 27г/моль N = νNA ν = m/M ν = 50г:27г/моль = 1,85моль N = 1,85·6·10²³ = 11·10²³ ЗАДАЧИ
2. Сколько молекул содержится в 50г Аℓ? М(Аℓ) = 27г/моль N = νNA ν = m/M ν = 50г:27г/моль = 1,85моль N = 1,85·6·10²³ = 11·10²³ ЗАДАЧИ