X
Код презентации скопируйте его
Уравнение состояния идеального газа. Газовые законы
Скачать эту презентациюПрезентация на тему Уравнение состояния идеального газа. Газовые законы
Скачать эту презентациюCлайд 1
 Тема «Уравнение состояния идеального газа. Газовые законы» Учитель физики МБОУ ЗСОШ №1 Пожарицкая Т.Г,
Тема «Уравнение состояния идеального газа. Газовые законы» Учитель физики МБОУ ЗСОШ №1 Пожарицкая Т.Г,
Cлайд 3
 Состояние газа данной массы характеризуется тремя макроскопическими параметрами: давлением– р, объемом – V и температурой – Т.
Состояние газа данной массы характеризуется тремя макроскопическими параметрами: давлением– р, объемом – V и температурой – Т.
Cлайд 8
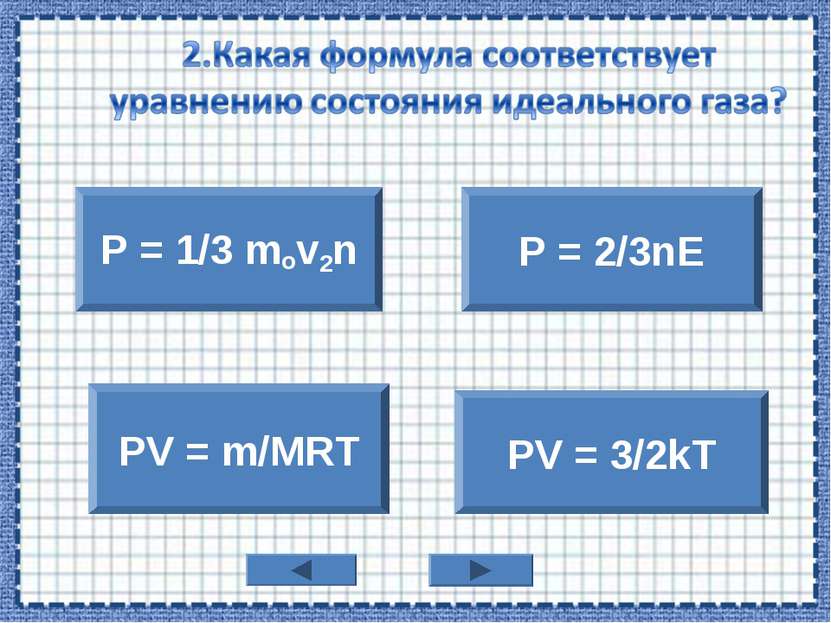
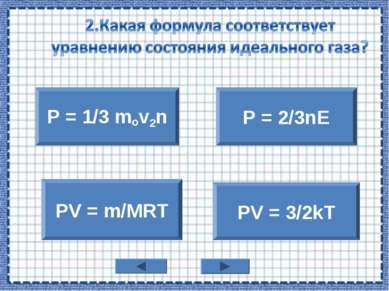
 Уравнение, связывающее все три макроскопических параметра р, V и T, характеризующие состояние достаточно разряженного газа данной массы, называют уравнением состояния идеального газа pv = RT
Уравнение, связывающее все три макроскопических параметра р, V и T, характеризующие состояние достаточно разряженного газа данной массы, называют уравнением состояния идеального газа pv = RT
Cлайд 13
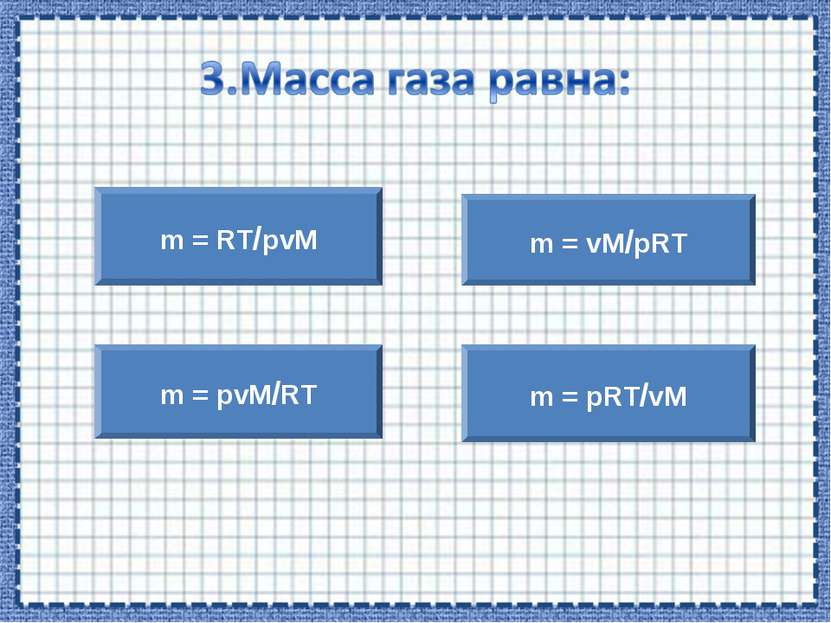
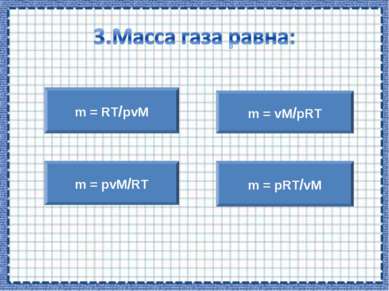
 pv = m/MRT Чтобы выразить неизвестную величину из уравнения Менделеева – Клапейрона, умножь левую и правую часть уравнения на знаменатель (М), получишь: рvM = mRT, найди неизвестный множитель, разделив произведение на известные множители.
pv = m/MRT Чтобы выразить неизвестную величину из уравнения Менделеева – Клапейрона, умножь левую и правую часть уравнения на знаменатель (М), получишь: рvM = mRT, найди неизвестный множитель, разделив произведение на известные множители.
Cлайд 17
 Произведение постоянной Больцмана к и постоянной Авогадро Na называют универсальной газовой постоянной и обозначают буквой R . R =к* Na = 1,38 *10-23ДЖ/К *6,02 *10231/моль = 8,31 Дж/(моль*К)
Произведение постоянной Больцмана к и постоянной Авогадро Na называют универсальной газовой постоянной и обозначают буквой R . R =к* Na = 1,38 *10-23ДЖ/К *6,02 *10231/моль = 8,31 Дж/(моль*К)
Cлайд 19
 pv = const Согласно уравнению состояния газа в любом состоянии с неизменной температурой произведение давления газа на его объем остается постоянным. Процесс изотермический. T = const Закон Бойля-Мариотта
pv = const Согласно уравнению состояния газа в любом состоянии с неизменной температурой произведение давления газа на его объем остается постоянным. Процесс изотермический. T = const Закон Бойля-Мариотта
Cлайд 25
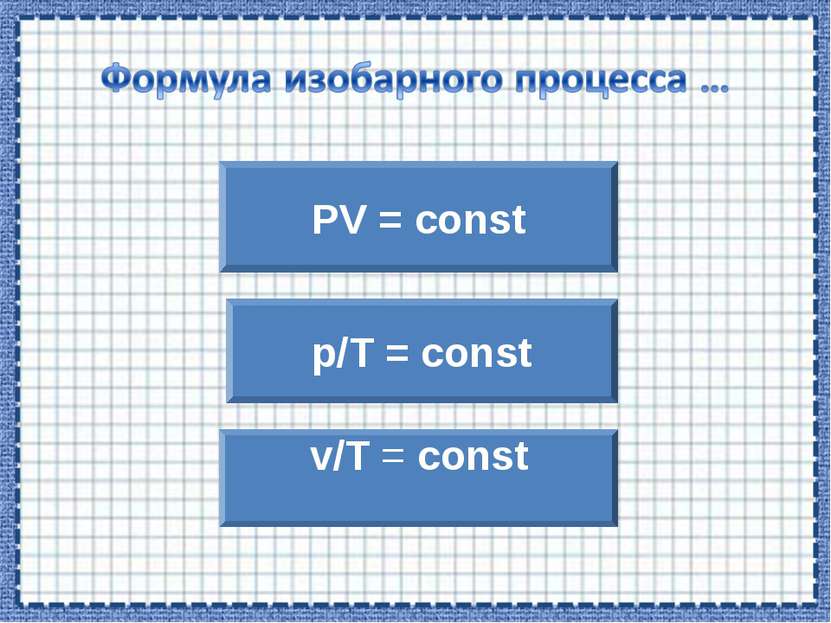
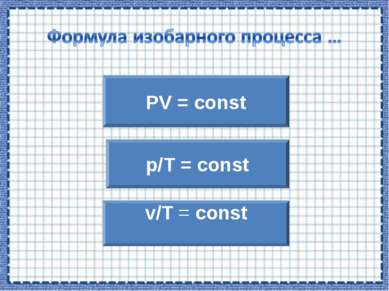
 P = const Для данной массы газа отношение объема к температуре постоянно, если давление газа не меняется. v/T = const Закон Гей-Люссака.
P = const Для данной массы газа отношение объема к температуре постоянно, если давление газа не меняется. v/T = const Закон Гей-Люссака.
Cлайд 29
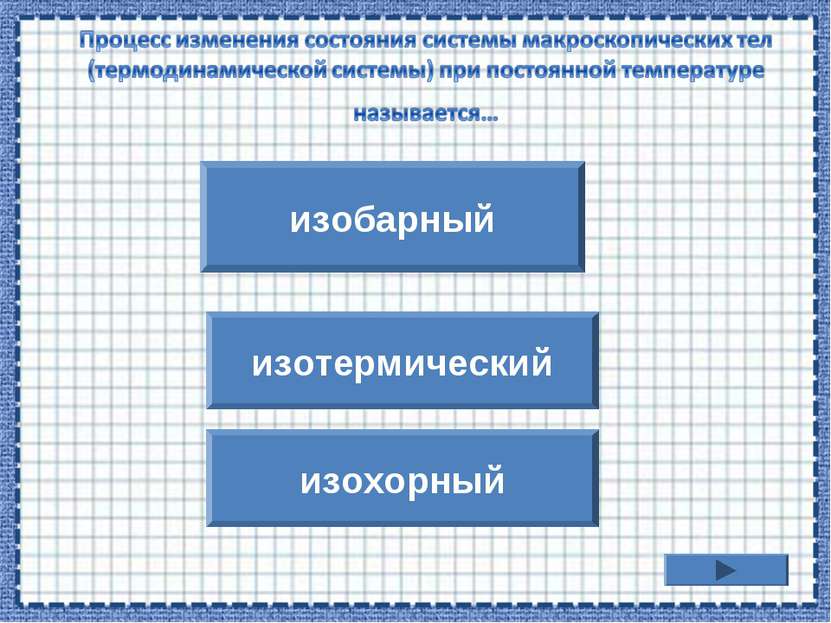
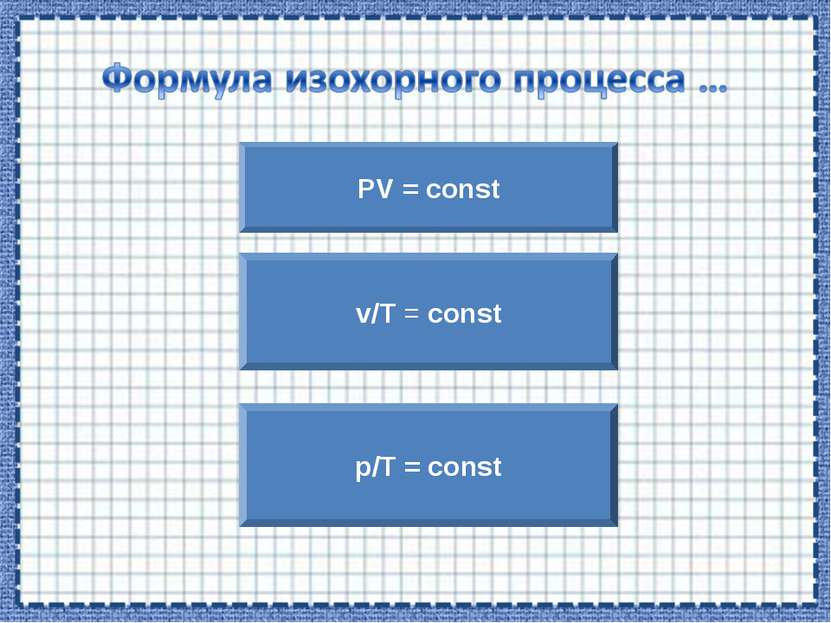
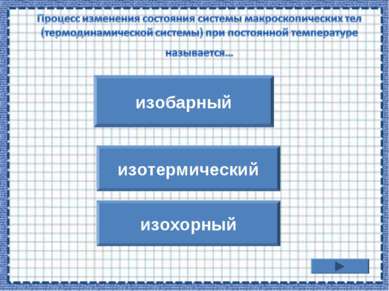
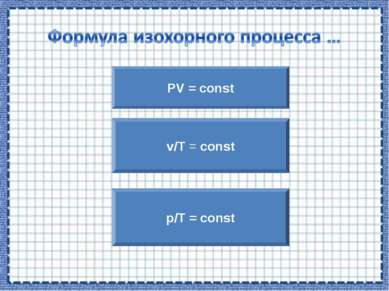
 p/T = const Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Газовый закон Шарля. V = const.
p/T = const Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Газовый закон Шарля. V = const.
Cлайд 33
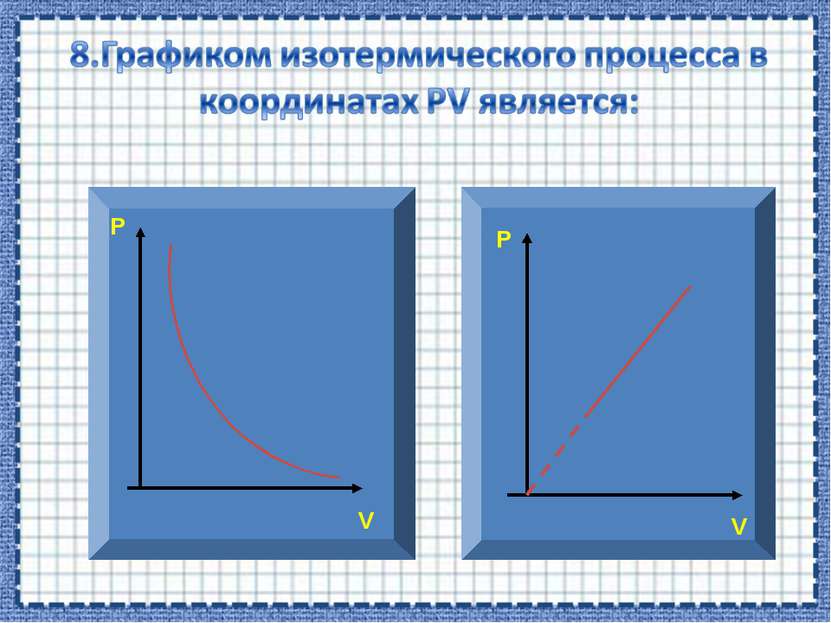
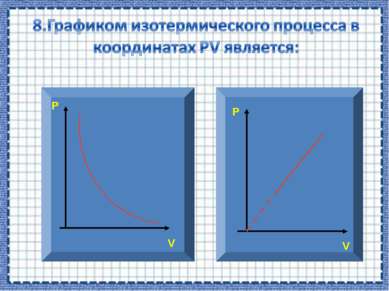
 Р V Зависимость между давлением и объемом в изотермическом процессе обратно пропорциональная. Графиком в координатах PV является изотерма – гипербола.
Р V Зависимость между давлением и объемом в изотермическом процессе обратно пропорциональная. Графиком в координатах PV является изотерма – гипербола.
Cлайд 37
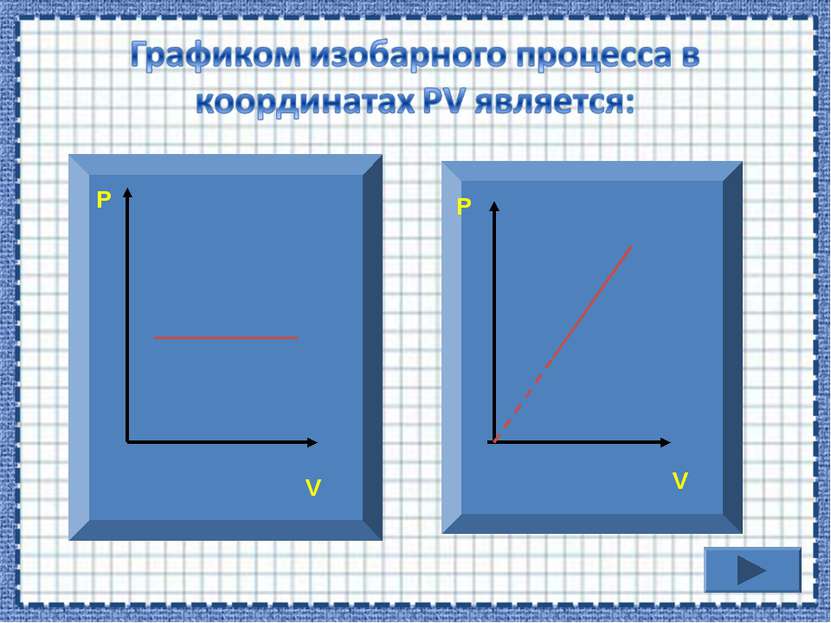
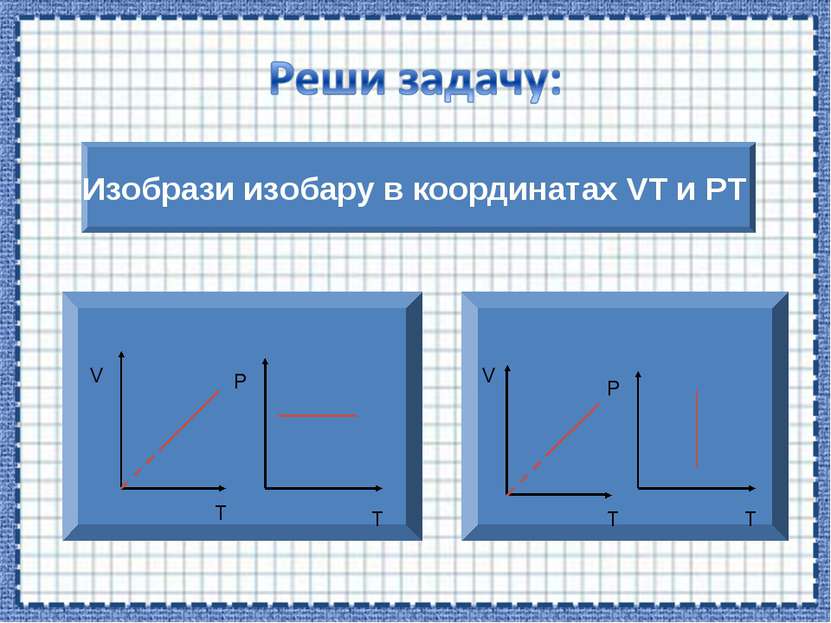
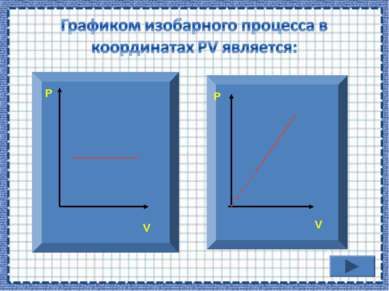
 Если процесс изобарный давление постоянно, в координатах PV график прямая линия параллельная оси объема. Р V
Если процесс изобарный давление постоянно, в координатах PV график прямая линия параллельная оси объема. Р V
Cлайд 41
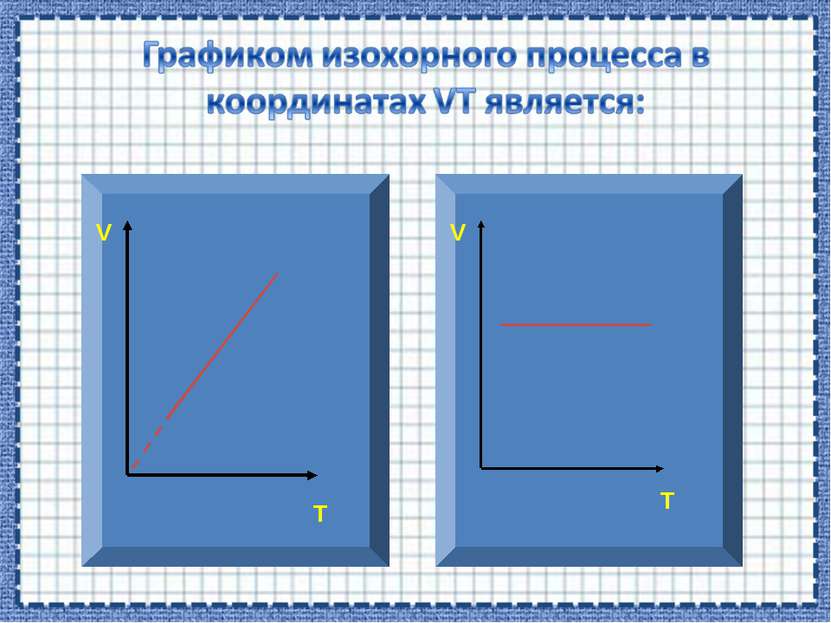
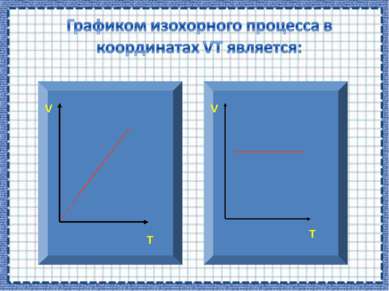
 V T Если процесс изохорный объем постоянный, в координатах VT график - прямая линия параллельная оси температуры.
V T Если процесс изохорный объем постоянный, в координатах VT график - прямая линия параллельная оси температуры.
Cлайд 42
 В сосуде вместимостью 500 см3 содержится 0,89 г водорода при температуре 170С. Определите давление газа. 2,14 МПа 12кПа
В сосуде вместимостью 500 см3 содержится 0,89 г водорода при температуре 170С. Определите давление газа. 2,14 МПа 12кПа