X
Код презентации скопируйте его
Атомная физика (11 класс)
Скачать эту презентациюПрезентация на тему Атомная физика (11 класс)
Скачать эту презентациюCлайд 1
 Атомная физика 11 класс Разработала: Двойнишникова Антонина Геннадьевна, учитель физики МОУ СОШ №91 города Новокузнецка
Атомная физика 11 класс Разработала: Двойнишникова Антонина Геннадьевна, учитель физики МОУ СОШ №91 города Новокузнецка
Cлайд 2
 План урока 1. Из истории физики 2. Модель Томсона 3. Опыт Резерфорда 4. Противоречия 5.Постулаты Бора 6.Энергетическая диаграмма атома водорода 7. Сообщения о Э.Резерфорде и Н. Боре
План урока 1. Из истории физики 2. Модель Томсона 3. Опыт Резерфорда 4. Противоречия 5.Постулаты Бора 6.Энергетическая диаграмма атома водорода 7. Сообщения о Э.Резерфорде и Н. Боре
Cлайд 3
 Конец XIX века. Из истории физики… 1869г. Д.Менделеев открыл периодический закон 1896 г. А.Беккерель открыл явление радиоактивности 1897 г. Томсон открыл электрон 1903 г. Томсон предложил модель атома
Конец XIX века. Из истории физики… 1869г. Д.Менделеев открыл периодический закон 1896 г. А.Беккерель открыл явление радиоактивности 1897 г. Томсон открыл электрон 1903 г. Томсон предложил модель атома
Cлайд 5
 Эрнест Резерфорд (1871-1937) – великий английский физик Науки делятся на две группы - на физику и собирание марок
Эрнест Резерфорд (1871-1937) – великий английский физик Науки делятся на две группы - на физику и собирание марок
Cлайд 6
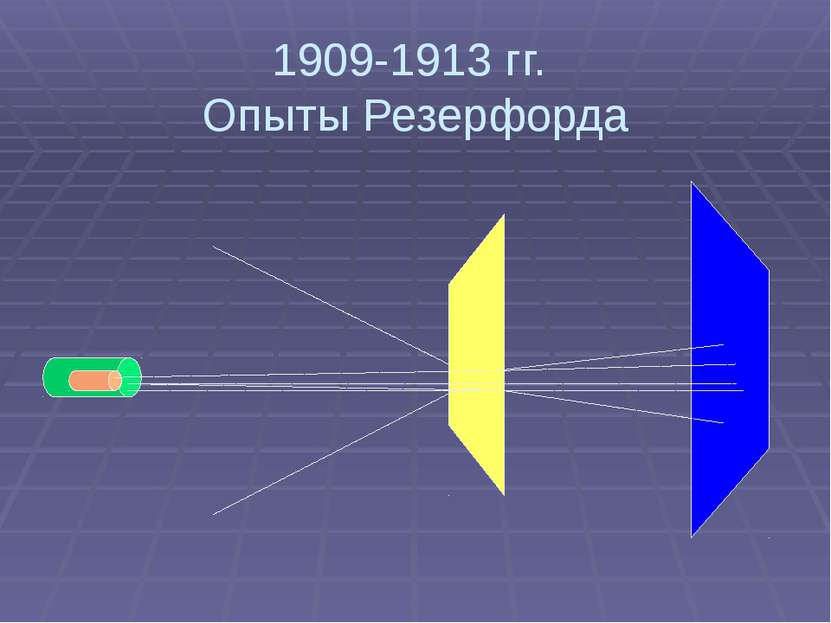
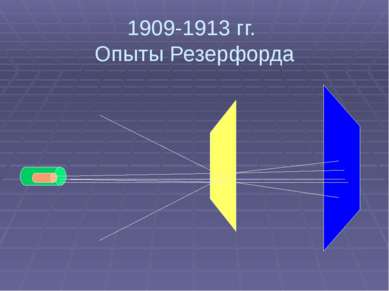
 1909-1913 гг. Опыты Резерфорда Цель: 1. Исследование распределения положительного заряда 2. Исследование распределения массы внутри атома
1909-1913 гг. Опыты Резерфорда Цель: 1. Исследование распределения положительного заряда 2. Исследование распределения массы внутри атома
Cлайд 8
 1909-1913 гг. Опыты Резерфорда Результаты: 1. Большинство частиц проходит через фольгу не отклоняясь 2. Небольшое число альфа частиц (примерно 1 из 2000) отклонилось на углы, больше 90°
1909-1913 гг. Опыты Резерфорда Результаты: 1. Большинство частиц проходит через фольгу не отклоняясь 2. Небольшое число альфа частиц (примерно 1 из 2000) отклонилось на углы, больше 90°
Cлайд 9
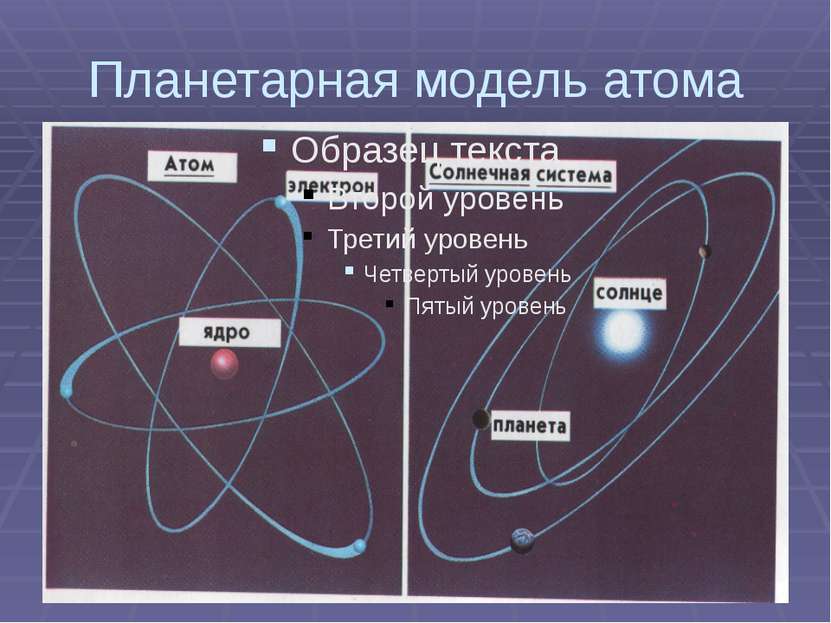
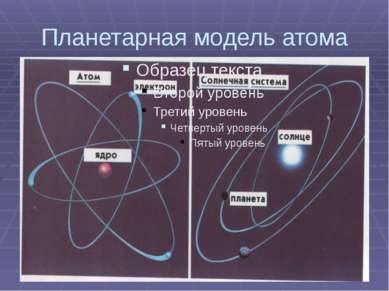
 1909-1913 гг. Опыты Резерфорда. Выводы: 1. Положительный заряд атома и его масса сконцентрированы в очень малой области пространства – ядро 2. Предложена новая модель атома – планетарная 3. Ядро имеет диаметр 10 -12 -10 -13 см 4. Размер атома 10 -8 см 5. Заряд ядра равен номеру химического элемента по таблице Д.И.Менделеева
1909-1913 гг. Опыты Резерфорда. Выводы: 1. Положительный заряд атома и его масса сконцентрированы в очень малой области пространства – ядро 2. Предложена новая модель атома – планетарная 3. Ядро имеет диаметр 10 -12 -10 -13 см 4. Размер атома 10 -8 см 5. Заряд ядра равен номеру химического элемента по таблице Д.И.Менделеева
Cлайд 11
 Противоречие между экспериментальными данными и теорией Ускоренное движение электрона по орбите должно сопровождаться постоянным излучением Излучение сопровождается излучением энергии и электрон должен двигаться по спирали в итоге должен упасть на ядро
Противоречие между экспериментальными данными и теорией Ускоренное движение электрона по орбите должно сопровождаться постоянным излучением Излучение сопровождается излучением энергии и электрон должен двигаться по спирали в итоге должен упасть на ядро
Cлайд 12
 Нильс Бор (1885-1962) великий датский физик Есть два вида истины - тривиальная, которую отрицать нелепо, и глубокая, для которой обратное утверждение - тоже глубокая истина
Нильс Бор (1885-1962) великий датский физик Есть два вида истины - тривиальная, которую отрицать нелепо, и глубокая, для которой обратное утверждение - тоже глубокая истина
Cлайд 13
 1913 г. Нильс Бор Разрешая противоречия, учёл: 1. Линейчатый спектр атомов 2. Модель атома Резерфорда 3. Квантовый характер испускания и поглощения энергии
1913 г. Нильс Бор Разрешая противоречия, учёл: 1. Линейчатый спектр атомов 2. Модель атома Резерфорда 3. Квантовый характер испускания и поглощения энергии
Cлайд 14
 Постулаты Бора 1. Атомная система может находиться только в особых стационарных, или квантовых состояниях, каждому из которых соответствует определенная энергия Е n ; в стационарном состоянии атом не излучает Е1 Е2 + +
Постулаты Бора 1. Атомная система может находиться только в особых стационарных, или квантовых состояниях, каждому из которых соответствует определенная энергия Е n ; в стационарном состоянии атом не излучает Е1 Е2 + +
Cлайд 15
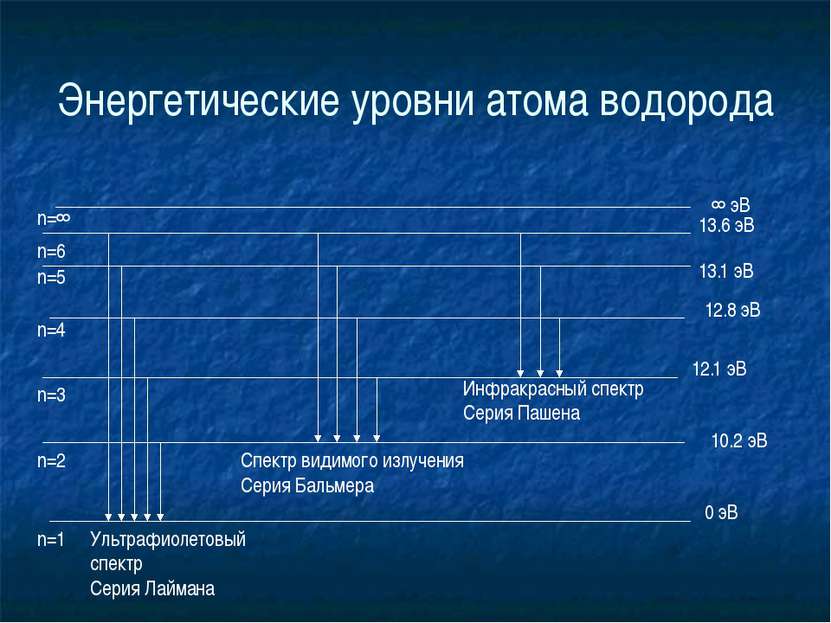
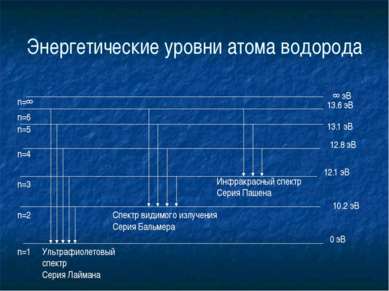
 Постулаты Бора 2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией Еk в стационарное состояние с меньшей энергией Еn Энергия излученного фотона равна разности энергий стационарных состояний: hv =E k– En hv + hv hv
Постулаты Бора 2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией Еk в стационарное состояние с меньшей энергией Еn Энергия излученного фотона равна разности энергий стационарных состояний: hv =E k– En hv + hv hv
Cлайд 16
 Постулаты Бора 3. Возможен дискретный ряд орбит по которым электрон может двигаться в стационарном состоянии: m v r = n h, m-масса электрона, v -скорость электрона, r-радиус данной орбиты, n-номер орбиты, h-постоянная (1,05•10-34 Дж•с)
Постулаты Бора 3. Возможен дискретный ряд орбит по которым электрон может двигаться в стационарном состоянии: m v r = n h, m-масса электрона, v -скорость электрона, r-радиус данной орбиты, n-номер орбиты, h-постоянная (1,05•10-34 Дж•с)