X
Код презентации скопируйте его
Атоми і молекули
Скачать эту презентациюПрезентация на тему Атоми і молекули
Скачать эту презентациюCлайд 2
 ядро електрони “+” “-” Атом (з грецької “неподільний”) – найдрібніша, хімічно неподільна частинка речовини. ДЕМОКРИТ (близько 460- 360 рр. до н.е.) Ернест РЕЗЕРФОРД (1871-1937) “Увесь світ складається з атомів та пустоти”, – вважав давньогрецький філософ Демокрит. Атоми неподільні, вічні, непорушні, різні за формою, розмірами та положенням у пустоті. Від їхнього руху виникають тіла та усі світи. Атом має складну будову. Планетарну будову атома у 1911 р. запропонував англійський фізик Ернест Резерфорд.
ядро електрони “+” “-” Атом (з грецької “неподільний”) – найдрібніша, хімічно неподільна частинка речовини. ДЕМОКРИТ (близько 460- 360 рр. до н.е.) Ернест РЕЗЕРФОРД (1871-1937) “Увесь світ складається з атомів та пустоти”, – вважав давньогрецький філософ Демокрит. Атоми неподільні, вічні, непорушні, різні за формою, розмірами та положенням у пустоті. Від їхнього руху виникають тіла та усі світи. Атом має складну будову. Планетарну будову атома у 1911 р. запропонував англійський фізик Ернест Резерфорд.
Cлайд 3
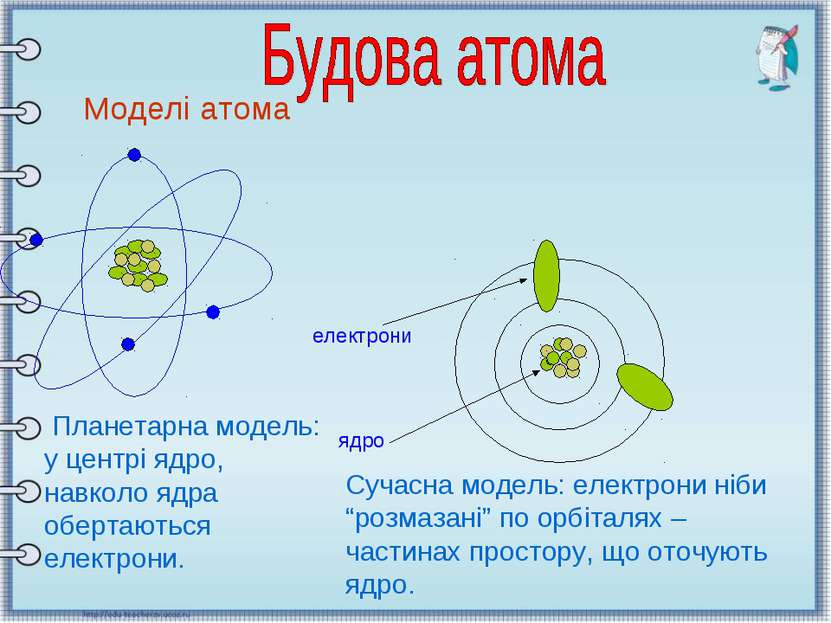
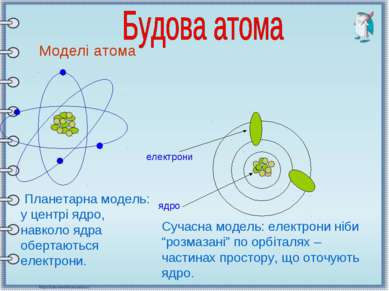 Моделі атома Планетарна модель: у центрі ядро, навколо ядра обертаються електрони. електрони ядро Сучасна модель: електрони ніби “розмазані” по орбіталях – частинах простору, що оточують ядро.
Моделі атома Планетарна модель: у центрі ядро, навколо ядра обертаються електрони. електрони ядро Сучасна модель: електрони ніби “розмазані” по орбіталях – частинах простору, що оточують ядро.
Cлайд 4
 Атоми надзвичайно малі, а їх ядро ще у 10-100 разів менші за сам атом. У крапці, поставленій на папері графітовим стрижнем олівця їх більше, ніж зірок на небі (тобто кілька тисяч). Атоми неоднакові за будовою. Вони мають різну кількість протонів, нейтронів та електронів.
Атоми надзвичайно малі, а їх ядро ще у 10-100 разів менші за сам атом. У крапці, поставленій на папері графітовим стрижнем олівця їх більше, ніж зірок на небі (тобто кілька тисяч). Атоми неоднакові за будовою. Вони мають різну кількість протонів, нейтронів та електронів.
Cлайд 5
 Ім’я: Атом – найдрібніша частинка речовини. Батьки: Демокріт, Левкіпп – 2500р. тому, давньогрецькі вчені (гіпотеза про існування атомів). Існують: різні види – 116 видів атомів. Спосіб існування: окремо або в молекулах. Місце проживання: будь-яке тіло. Характеристика: надзвичайно малі та легкі. Улюблені справи: безперервно та безладно рухаються, притягуються або відштовхуються. Призначення в природі: визначити відмінні від інших певні властивості речовини.
Ім’я: Атом – найдрібніша частинка речовини. Батьки: Демокріт, Левкіпп – 2500р. тому, давньогрецькі вчені (гіпотеза про існування атомів). Існують: різні види – 116 видів атомів. Спосіб існування: окремо або в молекулах. Місце проживання: будь-яке тіло. Характеристика: надзвичайно малі та легкі. Улюблені справи: безперервно та безладно рухаються, притягуються або відштовхуються. Призначення в природі: визначити відмінні від інших певні властивості речовини.
Cлайд 6
 Розміри атомів приблизно дорівнюють 0,0000000001м. Якби всі люди нашої планети проводили все життя, займаючись тільки лічбою, усі разом ми змогли б полічити атоми тільки в головці однієї малої шпильки.
Розміри атомів приблизно дорівнюють 0,0000000001м. Якби всі люди нашої планети проводили все життя, займаючись тільки лічбою, усі разом ми змогли б полічити атоми тільки в головці однієї малої шпильки.
Cлайд 7
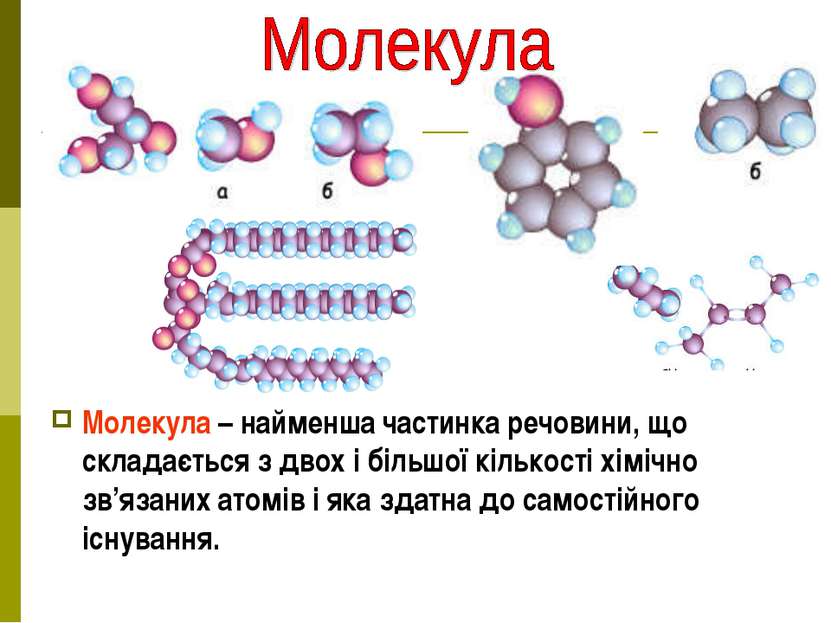
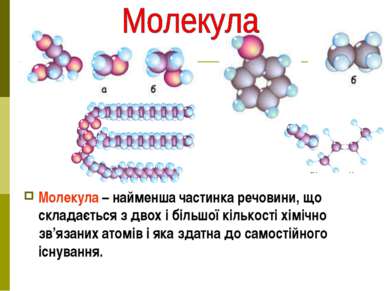 Молекула – найменша частинка речовини, що складається з двох і більшої кількості хімічно зв’язаних атомів і яка здатна до самостійного існування.
Молекула – найменша частинка речовини, що складається з двох і більшої кількості хімічно зв’язаних атомів і яка здатна до самостійного існування.
Cлайд 8
 Молекула (зменшене від латинського moles – “маса”) – найменша частинка речовини, що має її властивості й здатна самостійно існувати. Атоми найчастіше сполучаються між собою й утворюють молекули. Хімічна формула – зображення будови речовини хімічними знаками. Молекула кисню О2 Молекула водню Н2 Молекула азоту N2 Молекула хлору Cl2 Молекула води Н2O Молекула вуглекислого газу CO2 Молекула метану CH4
Молекула (зменшене від латинського moles – “маса”) – найменша частинка речовини, що має її властивості й здатна самостійно існувати. Атоми найчастіше сполучаються між собою й утворюють молекули. Хімічна формула – зображення будови речовини хімічними знаками. Молекула кисню О2 Молекула водню Н2 Молекула азоту N2 Молекула хлору Cl2 Молекула води Н2O Молекула вуглекислого газу CO2 Молекула метану CH4
Cлайд 9
 Молекула кисню Молекула водню Молекула азоту Молекула хлору О2 Н2 N2 Cl2 Молекула води Н2O Молекула вуглекислого газу CO2
Молекула кисню Молекула водню Молекула азоту Молекула хлору О2 Н2 N2 Cl2 Молекула води Н2O Молекула вуглекислого газу CO2
Cлайд 10
 1. Всі тіла складаються з частинок. 2. Ці частинки перебувають у безперервному хаотичному русі. 3. Частинки взаємодіють одна з одною.
1. Всі тіла складаються з частинок. 2. Ці частинки перебувають у безперервному хаотичному русі. 3. Частинки взаємодіють одна з одною.
Cлайд 11
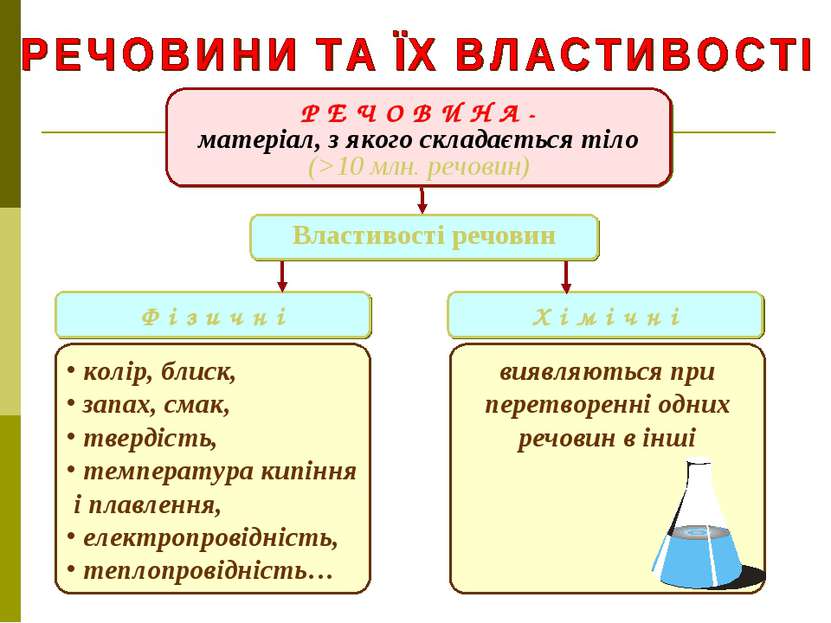
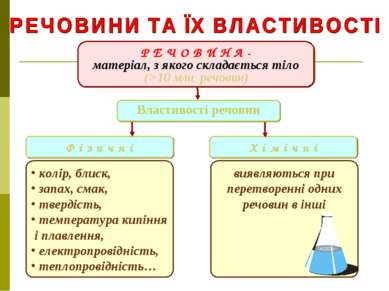 Р Е Ч О В И Н А - матеріал, з якого складається тіло (>10 млн. речовин) Ф і з и ч н і Х і м і ч н і колір, блиск, запах, смак, твердість, температура кипіння і плавлення, електропровідність, теплопровідність… виявляються при перетворенні одних речовин в інші Властивості речовин
Р Е Ч О В И Н А - матеріал, з якого складається тіло (>10 млн. речовин) Ф і з и ч н і Х і м і ч н і колір, блиск, запах, смак, твердість, температура кипіння і плавлення, електропровідність, теплопровідність… виявляються при перетворенні одних речовин в інші Властивості речовин
Cлайд 12
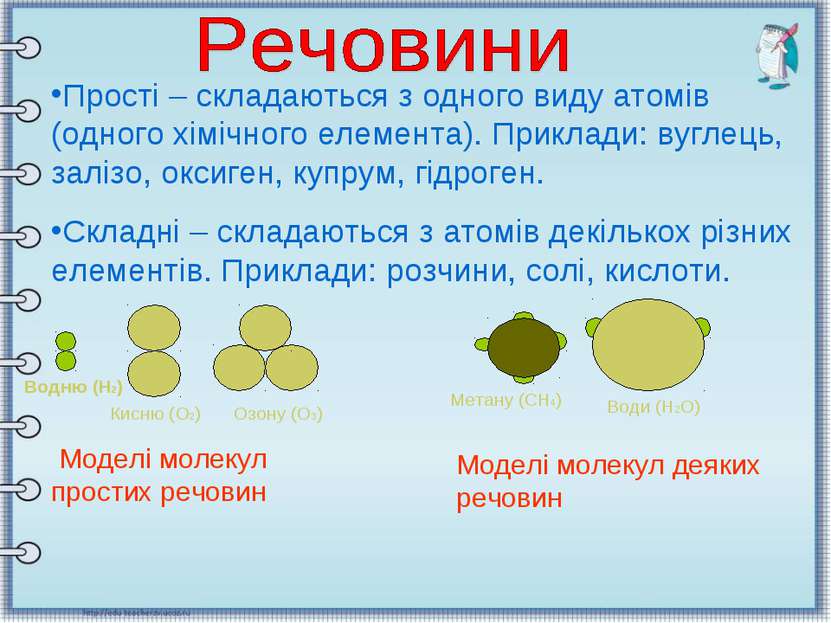
 Прості – складаються з одного виду атомів (одного хімічного елемента). Приклади: вуглець, залізо, оксиген, купрум, гідроген. Складні – складаються з атомів декількох різних елементів. Приклади: розчини, солі, кислоти. Кисню (О2) Озону (О3) Метану (СН4) Води (Н2О) Водню (Н2) Моделі молекул простих речовин Моделі молекул деяких речовин
Прості – складаються з одного виду атомів (одного хімічного елемента). Приклади: вуглець, залізо, оксиген, купрум, гідроген. Складні – складаються з атомів декількох різних елементів. Приклади: розчини, солі, кислоти. Кисню (О2) Озону (О3) Метану (СН4) Води (Н2О) Водню (Н2) Моделі молекул простих речовин Моделі молекул деяких речовин
Cлайд 13
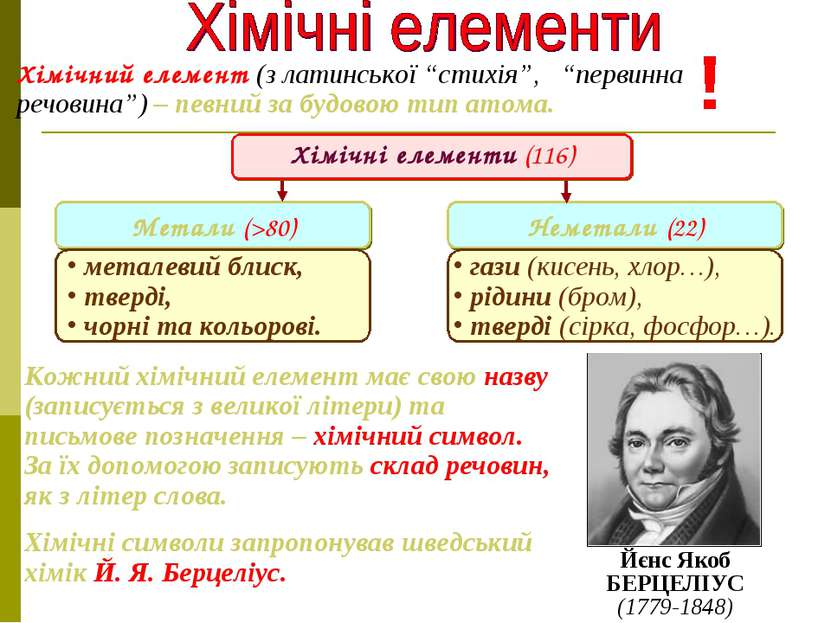
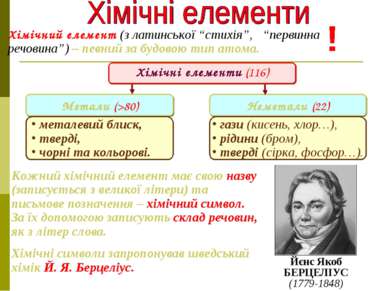 Хімічний елемент (з латинської “стихія”, “первинна речовина”) – певний за будовою тип атома. Йєнс Якоб БЕРЦЕЛІУС (1779-1848) Кожний хімічний елемент має свою назву (записується з великої літери) та письмове позначення – хімічний символ. За їх допомогою записують склад речовин, як з літер слова. Хімічні символи запропонував шведський хімік Й. Я. Берцеліус. Метали (>80) Неметали (22) Хімічні елементи (116) металевий блиск, тверді, чорні та кольорові. гази (кисень, хлор…), рідини (бром), тверді (сірка, фосфор…).
Хімічний елемент (з латинської “стихія”, “первинна речовина”) – певний за будовою тип атома. Йєнс Якоб БЕРЦЕЛІУС (1779-1848) Кожний хімічний елемент має свою назву (записується з великої літери) та письмове позначення – хімічний символ. За їх допомогою записують склад речовин, як з літер слова. Хімічні символи запропонував шведський хімік Й. Я. Берцеліус. Метали (>80) Неметали (22) Хімічні елементи (116) металевий блиск, тверді, чорні та кольорові. гази (кисень, хлор…), рідини (бром), тверді (сірка, фосфор…).
Cлайд 14
 Англійський ботанік Броун (ХІХст.) Дифузією називають взаємне проникнення дотичних речовин одна в одну, що відбувається в результаті теплового руху молекул.
Англійський ботанік Броун (ХІХст.) Дифузією називають взаємне проникнення дотичних речовин одна в одну, що відбувається в результаті теплового руху молекул.
Cлайд 15
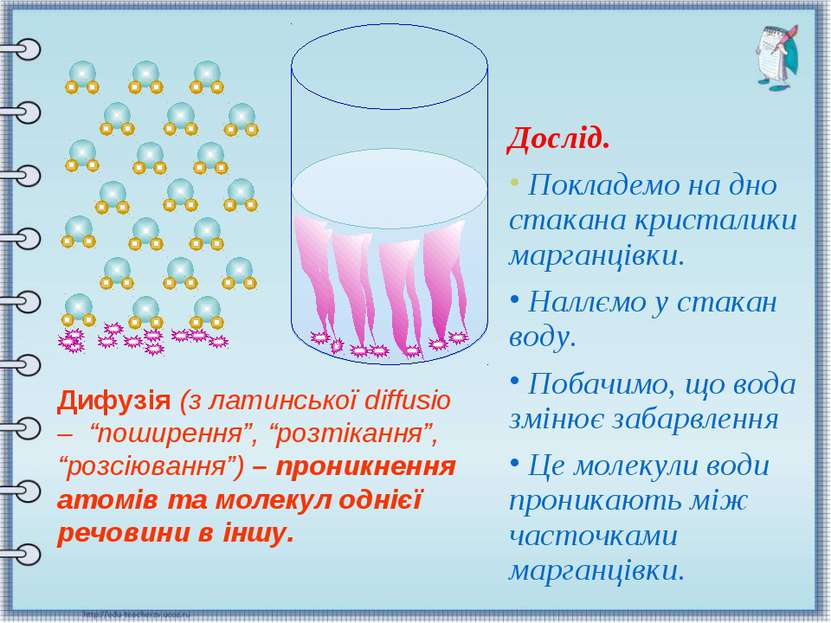
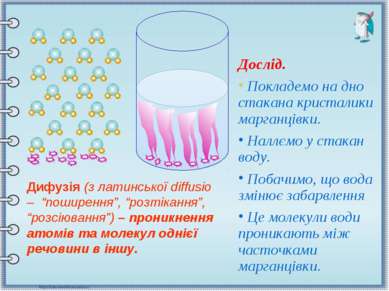 Дослід. Покладемо на дно стакана кристалики марганцівки. Наллємо у стакан воду. Побачимо, що вода змінює забарвлення Це молекули води проникають між часточками марганцівки. Дифузія (з латинської diffusio – “поширення”, “розтікання”, “розсіювання”) – проникнення атомів та молекул однієї речовини в іншу.
Дослід. Покладемо на дно стакана кристалики марганцівки. Наллємо у стакан воду. Побачимо, що вода змінює забарвлення Це молекули води проникають між часточками марганцівки. Дифузія (з латинської diffusio – “поширення”, “розтікання”, “розсіювання”) – проникнення атомів та молекул однієї речовини в іншу.
Cлайд 16
 Між молекулами є проміжки. Молекули рухаються хаотично. Зі збільшенням температури збільшується швидкість молекул. Явище дифузії існує в усіх агрегатних станах. Швидкість дифузії залежить від температури і стану речовини.
Між молекулами є проміжки. Молекули рухаються хаотично. Зі збільшенням температури збільшується швидкість молекул. Явище дифузії існує в усіх агрегатних станах. Швидкість дифузії залежить від температури і стану речовини.