X
Код презентации скопируйте его
Составление уравнений ОВР
Скачать эту презентациюПрезентация на тему Составление уравнений ОВР
Скачать эту презентациюCлайд 2
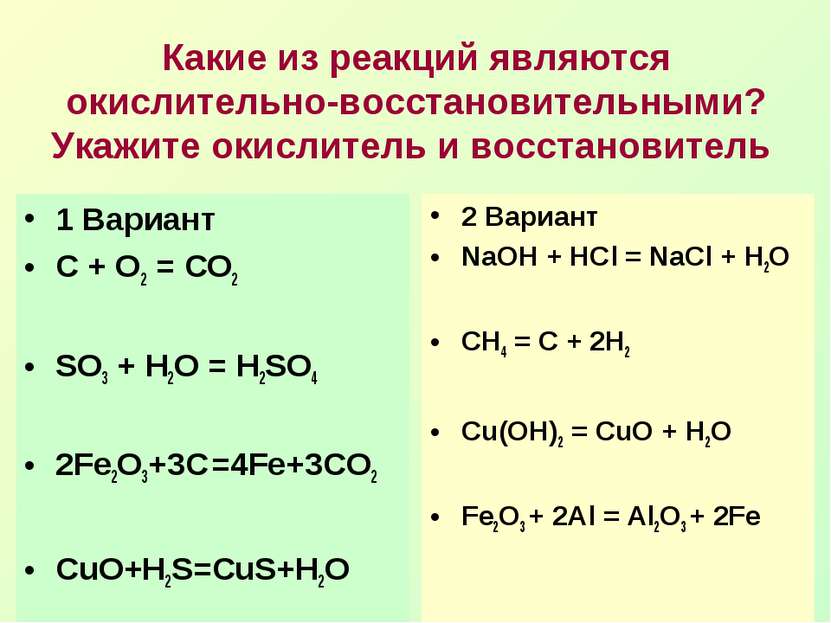
 Какие из реакций являются окислительно-восстановительными? Укажите окислитель и восстановитель 1 Вариант С + О2 = СО2 SO3 + H2O = H2SO4 2Fe2O3+3C =4Fe+3CO2 CuO+H2S=CuS+H2O 2 Вариант NaOH + HCl = NaCl + H2O CH4 = C + 2H2 Сu(OH)2 = CuO + H2O Fe2O3 + 2Al = Al2O3 + 2Fe
Какие из реакций являются окислительно-восстановительными? Укажите окислитель и восстановитель 1 Вариант С + О2 = СО2 SO3 + H2O = H2SO4 2Fe2O3+3C =4Fe+3CO2 CuO+H2S=CuS+H2O 2 Вариант NaOH + HCl = NaCl + H2O CH4 = C + 2H2 Сu(OH)2 = CuO + H2O Fe2O3 + 2Al = Al2O3 + 2Fe
Cлайд 3
 1 Вариант С0 + О20 = С+4О2-2 C0 - 4e = C+4 - ок-ие, в-ль O0 + 2e = O-2 - в-ие, ок-ль 2Fe2+3O3+3C0 =4Fe0 +3C+4O2 C0 - 4e = C+4- ок-ие, в-ль Fe+3 +3e = Fe0-в-ие, ок-ль 2 Вариант C-4H4+ = C0 + 2H20 C-4 – 4e = C0 - ок-ие, в-ль H+ + 1e = H0 - в-ие, ок-ль Fe2+3O3 + 2Al0 = Al2+3O3 + 2Fe0 Al0 -3e =Al+3 - ок-ие, в-ль Fe+3 + 3e = Fe0 - в-ие, ок-ль
1 Вариант С0 + О20 = С+4О2-2 C0 - 4e = C+4 - ок-ие, в-ль O0 + 2e = O-2 - в-ие, ок-ль 2Fe2+3O3+3C0 =4Fe0 +3C+4O2 C0 - 4e = C+4- ок-ие, в-ль Fe+3 +3e = Fe0-в-ие, ок-ль 2 Вариант C-4H4+ = C0 + 2H20 C-4 – 4e = C0 - ок-ие, в-ль H+ + 1e = H0 - в-ие, ок-ль Fe2+3O3 + 2Al0 = Al2+3O3 + 2Fe0 Al0 -3e =Al+3 - ок-ие, в-ль Fe+3 + 3e = Fe0 - в-ие, ок-ль