X
Код презентации скопируйте его
Аминокислоты
Скачать эту презентациюПрезентация на тему Аминокислоты
Скачать эту презентациюCлайд 3
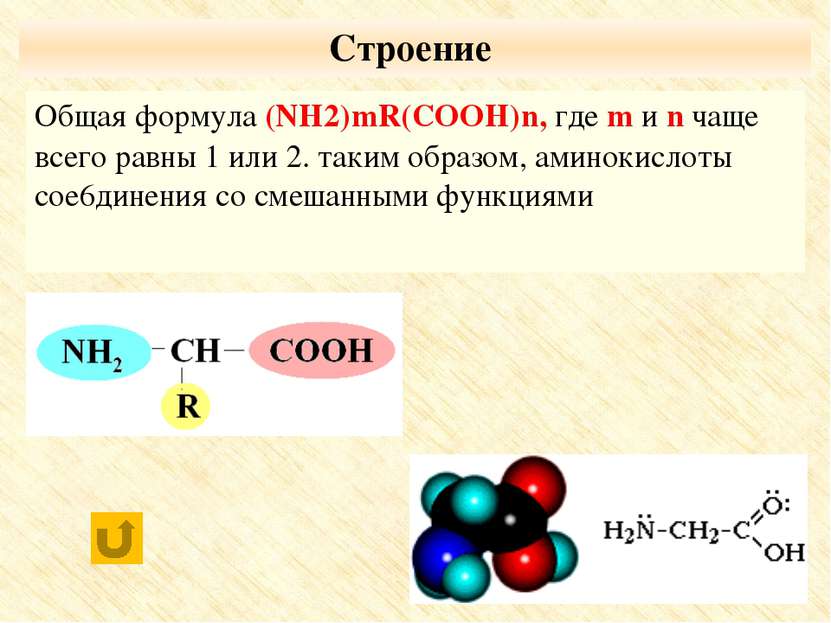
 Классификация По числу функциональных групп: По взаимному расположению карбоксильной и аминогруппы По строению углеводородного радикала Аминокислоты организма
Классификация По числу функциональных групп: По взаимному расположению карбоксильной и аминогруппы По строению углеводородного радикала Аминокислоты организма
Cлайд 5
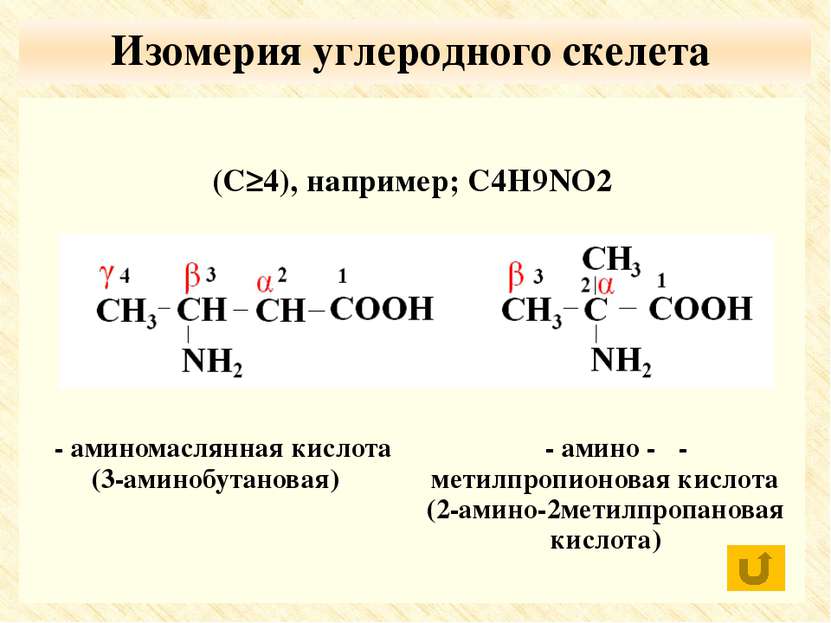
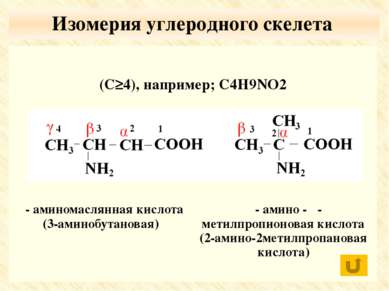
 По числу функциональных групп моноаминомонокарбоновые кислоты; диаминомонокарбоновые кислоты моноаминодикарбоновые кислоты
По числу функциональных групп моноаминомонокарбоновые кислоты; диаминомонокарбоновые кислоты моноаминодикарбоновые кислоты
Cлайд 6
 Аминокислоты делят на: Природные Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот –незаменимые (не синтезируются в организме человека), они поступают с пищей. Синтетические Получают кислотным гидролизом белков, либо из карбоновых кислот, воздействуя на них галогенном и, далее, аммиаком.
Аминокислоты делят на: Природные Их около 150, они были обнаружены в живых организмах, около 20 из них входят в состав белков. Половина этих аминокислот –незаменимые (не синтезируются в организме человека), они поступают с пищей. Синтетические Получают кислотным гидролизом белков, либо из карбоновых кислот, воздействуя на них галогенном и, далее, аммиаком.
Cлайд 7
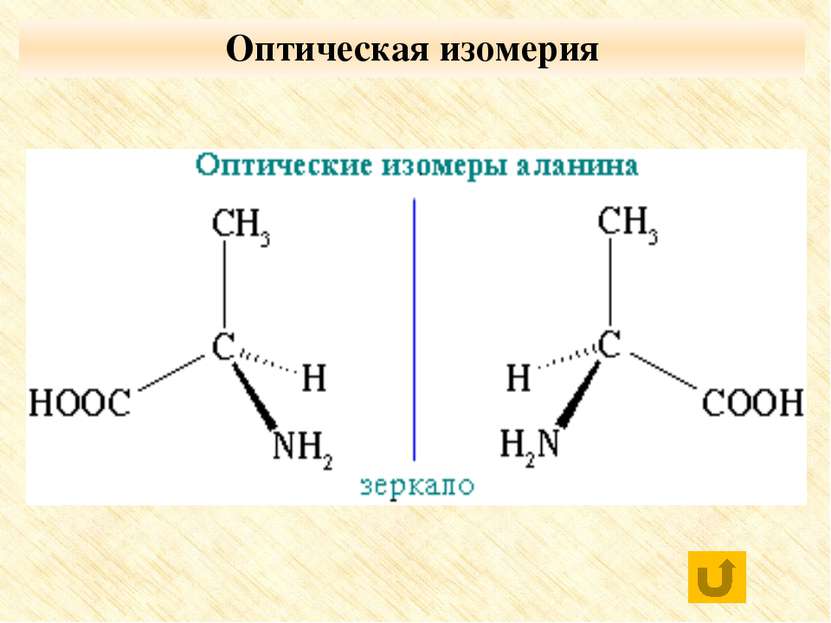
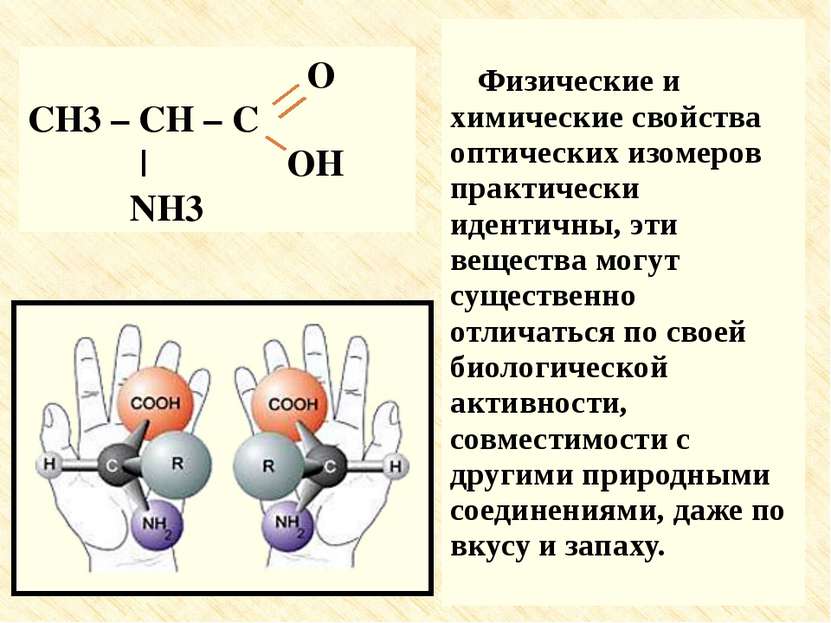
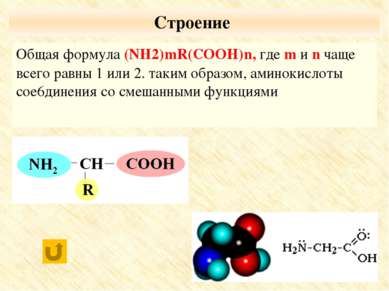
 Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху. O CH3 – CH – C | OH NH3
Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху. O CH3 – CH – C | OH NH3
Cлайд 8
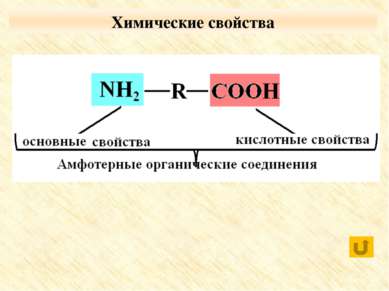
 Реакции с участием карбоксильной группы С активными металлами Оксидами металлов Гидроксидами металлов С солями слабых летучих кислот Со спиртами
Реакции с участием карбоксильной группы С активными металлами Оксидами металлов Гидроксидами металлов С солями слабых летучих кислот Со спиртами
Cлайд 9
 1. Mg + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2 Глицинат магния 2. MgO + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2O 3. 2Na + 2NH2 – CH2 – COOH → 2NH2 – CH2 – COONa + H2 Глицинат натрия 4. Na2CO3 + 2NH2 – CH2 – COOH → 2NH2 – CH2 – COONa + H2O + CO2 5. NH2 – CH2 – COOH + HOC2H5 → NH2 – CH2 – CO - OC2H5 + H2O этиловый эфир аминоуксусной кислоты
1. Mg + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2 Глицинат магния 2. MgO + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2O 3. 2Na + 2NH2 – CH2 – COOH → 2NH2 – CH2 – COONa + H2 Глицинат натрия 4. Na2CO3 + 2NH2 – CH2 – COOH → 2NH2 – CH2 – COONa + H2O + CO2 5. NH2 – CH2 – COOH + HOC2H5 → NH2 – CH2 – CO - OC2H5 + H2O этиловый эфир аминоуксусной кислоты
Cлайд 10
 Реакции с участием аминогруппы Взаимодействуют с кислотами: H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-
Реакции с участием аминогруппы Взаимодействуют с кислотами: H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-
Cлайд 11
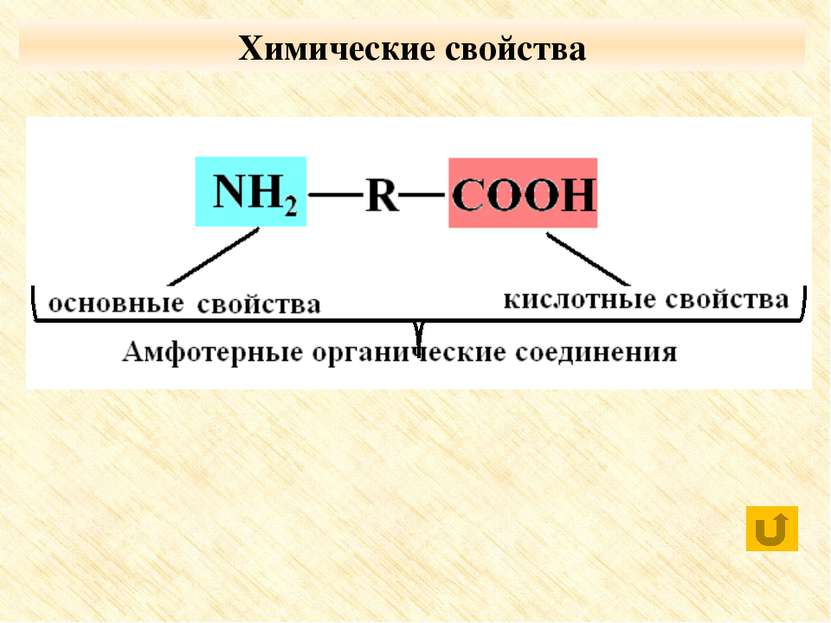
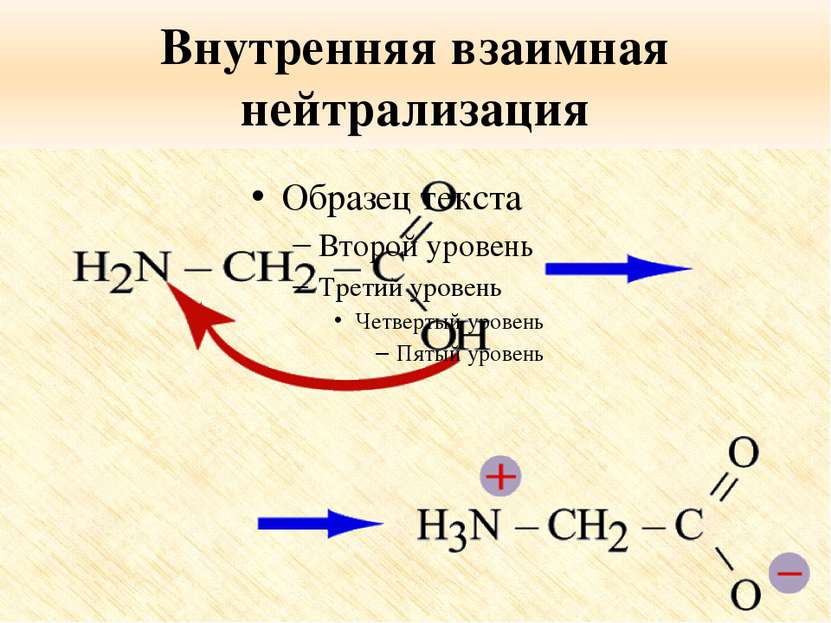
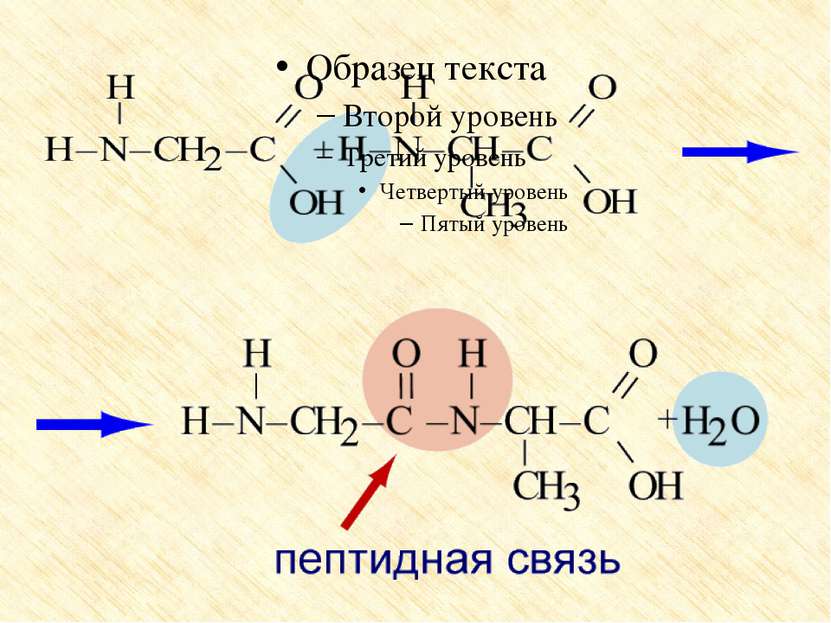
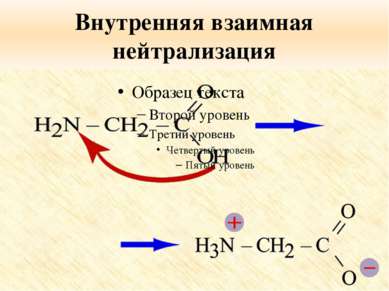
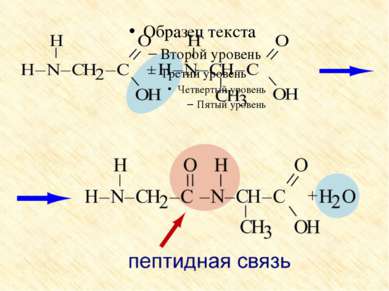
 Особые свойства аминокислот Образование внутренней соли при диссоциации NH2 – CH2 – COOH ⇄ +NH3 – CH2 – COO 2. Образование пептидов (реакция поликонденсации)
Особые свойства аминокислот Образование внутренней соли при диссоциации NH2 – CH2 – COOH ⇄ +NH3 – CH2 – COO 2. Образование пептидов (реакция поликонденсации)
Cлайд 14
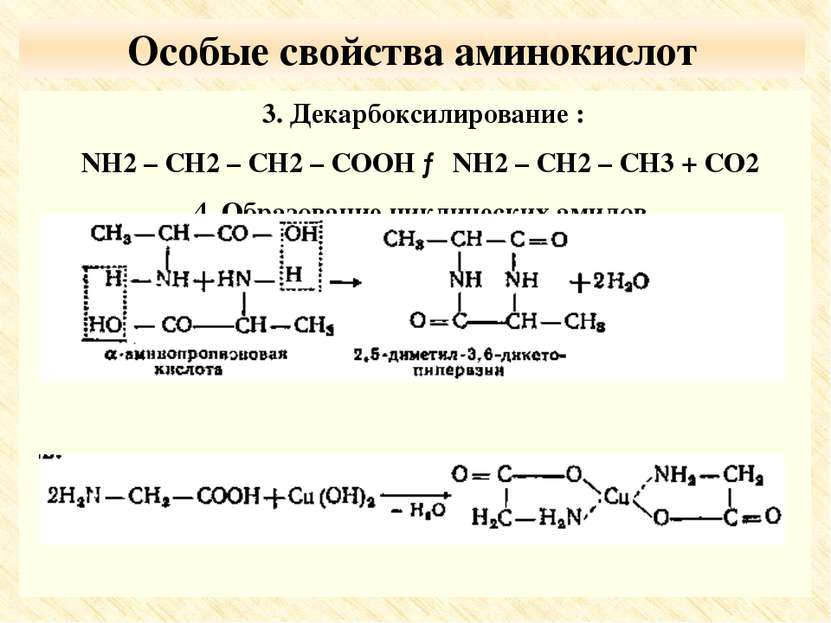
 Особые свойства аминокислот 3. Декарбоксилирование : NH2 – CH2 – CH2 – COOH → NH2 – CH2 – CH3 + CO2 4. Образование циклических амидов. 5. Образование комплексных солей
Особые свойства аминокислот 3. Декарбоксилирование : NH2 – CH2 – CH2 – COOH → NH2 – CH2 – CH3 + CO2 4. Образование циклических амидов. 5. Образование комплексных солей
Cлайд 15
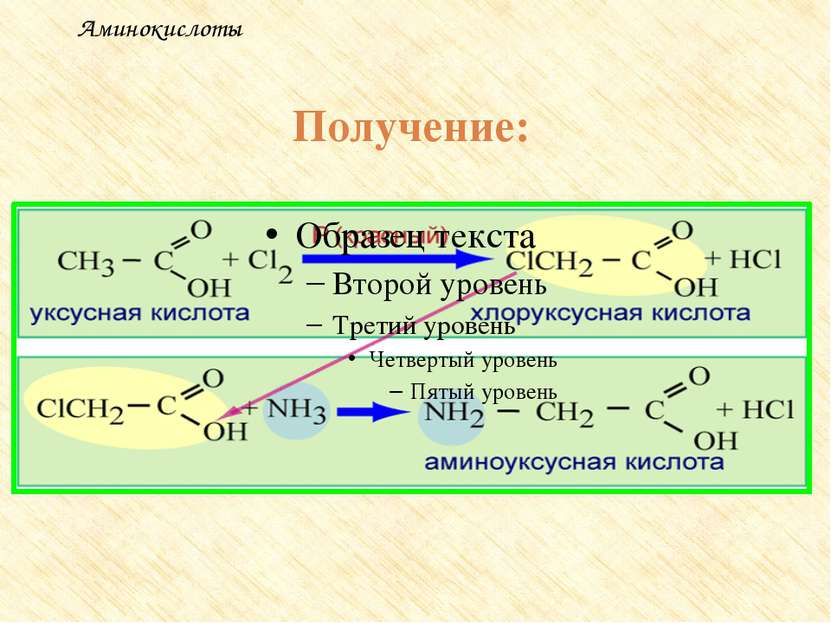
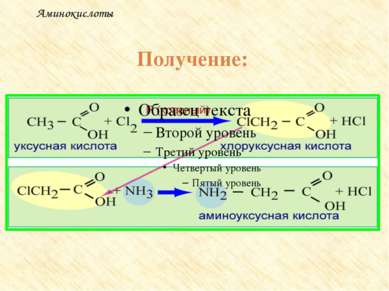
 Получение аминокислот Гидролиз белков под влиянием ферментов, кислот или щелочей. Действие аммиака на хлорзамещенные органические кислоты: CH3 – CH(Cl) – COOH + NH3 → CH3 – CH(NH2) – COOH + NH4Cl Действие цианистого аммония на оксосоединения (реакция Н.Д.Зелинского) IV. Присоединение аммиака к непредельным кислотам CH2 = CH – COOH + 2NH3 → H2N –CH2 – CH2 – COONH4 V. Микробиологический синтез
Получение аминокислот Гидролиз белков под влиянием ферментов, кислот или щелочей. Действие аммиака на хлорзамещенные органические кислоты: CH3 – CH(Cl) – COOH + NH3 → CH3 – CH(NH2) – COOH + NH4Cl Действие цианистого аммония на оксосоединения (реакция Н.Д.Зелинского) IV. Присоединение аммиака к непредельным кислотам CH2 = CH – COOH + 2NH3 → H2N –CH2 – CH2 – COONH4 V. Микробиологический синтез
Cлайд 16
 Получение: 1. Гидролиз белков. Белок – полимер под действием воды распадается на мономеры - аминокислоты Аминокислоты
Получение: 1. Гидролиз белков. Белок – полимер под действием воды распадается на мономеры - аминокислоты Аминокислоты
Cлайд 19
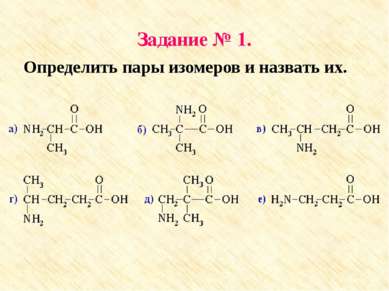
 Задача. Определите формулу аминокислоты, если массовые доли углерода, водорода, кислорода и азота соответственно равны: 48%, 9,34%, 42,67% и 18, 67%. Напишите все возможные структурные формулы и назовите их.
Задача. Определите формулу аминокислоты, если массовые доли углерода, водорода, кислорода и азота соответственно равны: 48%, 9,34%, 42,67% и 18, 67%. Напишите все возможные структурные формулы и назовите их.
Cлайд 20
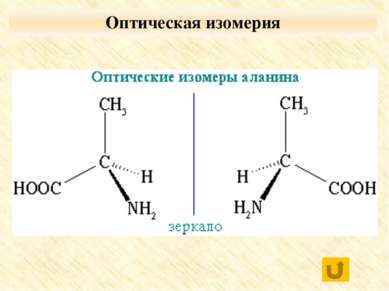 Задание №1 1. а: 2-аминопропановая кислота е: 3-аминопропановая кислота 2. б: 2-амино-2-метилпропановая кислота в: 3-аминобутановая кислота 3. г: 4-аминопентановая кислота д: 3-амино-2,2-диметилпропановая кислота Проверь себя:
Задание №1 1. а: 2-аминопропановая кислота е: 3-аминопропановая кислота 2. б: 2-амино-2-метилпропановая кислота в: 3-аминобутановая кислота 3. г: 4-аминопентановая кислота д: 3-амино-2,2-диметилпропановая кислота Проверь себя:
Cлайд 21
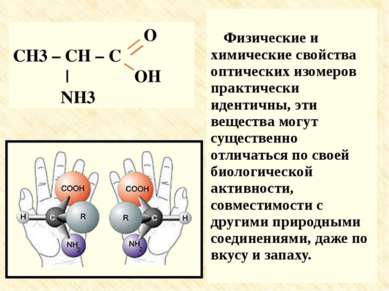 Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху. Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху.
Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху. Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической активности, совместимости с другими природными соединениями, даже по вкусу и запаху.
Cлайд 22
 Физические свойства Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления. Плавятся с разложением, нелетучие. Хорошо растворимы в воде и плохо растворимы во многих органических растворителях. водные растворы электропроводны В большинстве аминокислоты D-ряда сладкие на вкус, L-ряда горькие или безвкусные.
Физические свойства Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления. Плавятся с разложением, нелетучие. Хорошо растворимы в воде и плохо растворимы во многих органических растворителях. водные растворы электропроводны В большинстве аминокислоты D-ряда сладкие на вкус, L-ряда горькие или безвкусные.
Cлайд 24
 Реакции с участием карбоксильной группы С активными металлами Оксидами металлов Гидроксидами металлов С солями слабых летучих кислот Со спиртами
Реакции с участием карбоксильной группы С активными металлами Оксидами металлов Гидроксидами металлов С солями слабых летучих кислот Со спиртами
Cлайд 25
 1. Mg + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2 1. Mg + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2 Глицинат магния 2. MgO + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2O 3. 2Na + 2NH2 – CH2 – COOH → 2NH2 – CH2 – COONa + H2 Глицинат натрия 4. Na2CO3 + 2NH2 – CH2 – COOH → 2NH2 – CH2 – COONa + H2O + CO2 5. NH2 – CH2 – COOH + HOC2H5 → NH2 – CH2 – CO - OC2H5 + H2O этиловый эфир аминоуксусной кислоты
1. Mg + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2 1. Mg + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2 Глицинат магния 2. MgO + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2O 3. 2Na + 2NH2 – CH2 – COOH → 2NH2 – CH2 – COONa + H2 Глицинат натрия 4. Na2CO3 + 2NH2 – CH2 – COOH → 2NH2 – CH2 – COONa + H2O + CO2 5. NH2 – CH2 – COOH + HOC2H5 → NH2 – CH2 – CO - OC2H5 + H2O этиловый эфир аминоуксусной кислоты
Cлайд 26
 Реакции с участием аминогруппы Взаимодействуют с кислотами: H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-
Реакции с участием аминогруппы Взаимодействуют с кислотами: H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-
Cлайд 27
 Особые свойства аминокислот Образование внутренней соли при диссоциации NH2 – CH2 – COOH ⇄ +NH3 – CH2 – COO 2. Образование пептидов (реакция поликонденсации)
Особые свойства аминокислот Образование внутренней соли при диссоциации NH2 – CH2 – COOH ⇄ +NH3 – CH2 – COO 2. Образование пептидов (реакция поликонденсации)
Cлайд 30
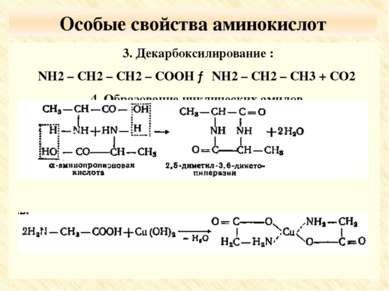 Особые свойства аминокислот 3. Декарбоксилирование : NH2 – CH2 – CH2 – COOH → NH2 – CH2 – CH3 + CO2 4. Образование циклических амидов. 5. Образование комплексных солей
Особые свойства аминокислот 3. Декарбоксилирование : NH2 – CH2 – CH2 – COOH → NH2 – CH2 – CH3 + CO2 4. Образование циклических амидов. 5. Образование комплексных солей
Cлайд 31
 Получение аминокислот Гидролиз белков под влиянием ферментов, кислот или щелочей. Действие аммиака на хлорзамещенные органические кислоты: CH3 – CH(Cl) – COOH + NH3 → CH3 – CH(NH2) – COOH + NH4Cl Действие цианистого аммония на оксосоединения (реакция Н.Д.Зелинского) IV. Присоединение аммиака к непредельным кислотам CH2 = CH – COOH + 2NH3 → H2N –CH2 – CH2 – COONH4 V. Микробиологический синтез
Получение аминокислот Гидролиз белков под влиянием ферментов, кислот или щелочей. Действие аммиака на хлорзамещенные органические кислоты: CH3 – CH(Cl) – COOH + NH3 → CH3 – CH(NH2) – COOH + NH4Cl Действие цианистого аммония на оксосоединения (реакция Н.Д.Зелинского) IV. Присоединение аммиака к непредельным кислотам CH2 = CH – COOH + 2NH3 → H2N –CH2 – CH2 – COONH4 V. Микробиологический синтез