X
Код презентации скопируйте его
Основания 11 класс
Скачать эту презентациюПрезентация на тему Основания 11 класс
Скачать эту презентациюCлайд 2
 Основания - это… Основания — (основные гидроксиды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН-. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами. Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов. В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
Основания - это… Основания — (основные гидроксиды) — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы (гидроксида) -OH. В водном растворе диссоциируют с образованием катионов и анионов ОН-. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами. Согласно другому определению, основания — один из основных классов химических соединений, вещества, молекулы которых являются акцепторами протонов. В органической химии по традиции основаниями называют также вещества, способные давать аддукты («соли») с сильными кислотами, например, многие алкалоиды описывают как в форме «алкалоид-основание», так и в виде «солей алкалоидов».
Cлайд 3
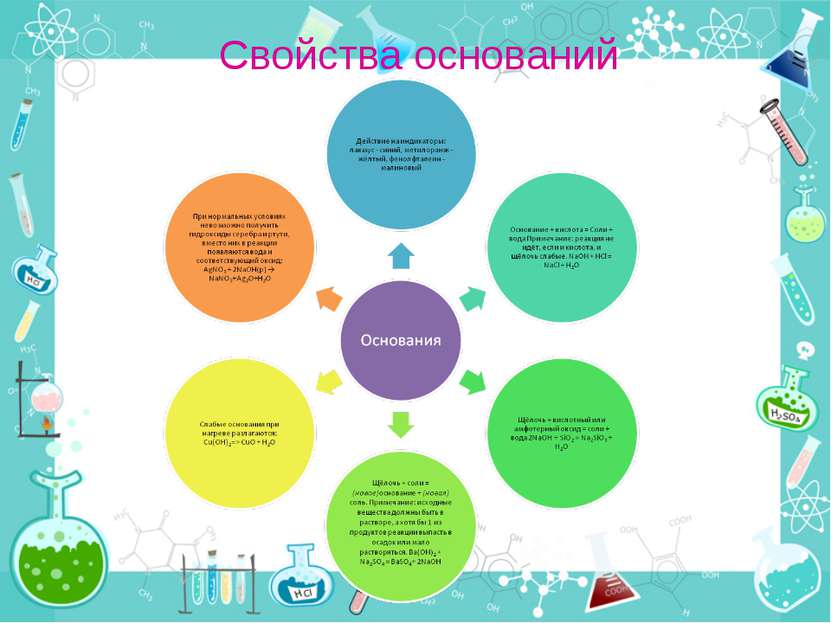
 Классификация оснований 1. Растворимые в воде основания (щёлочи) 2. Малорастворимые в воде гидроксиды 3. Нерастворимые в воде основания Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды типичных и не типичных металлов.
Классификация оснований 1. Растворимые в воде основания (щёлочи) 2. Малорастворимые в воде гидроксиды 3. Нерастворимые в воде основания Деление на растворимые и нерастворимые основания практически полностью совпадает с делением на сильные и слабые основания, или гидроксиды типичных и не типичных металлов.
Cлайд 4
 Классификация оснований В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают: Основные гидроксиды (основания) — гидроксиды, проявляющие основные свойства (например, гидроксид кальция Ca(ОН)2, гидроксид калия KOH, гидроксид натрия NaOH и др.); Кислотные гидроксиды (кислородосодержащие кислоты) — гидроксиды, проявляющие кислотные свойства (например, азотная кислота HNO3, серная кислота H2SO4, сернистая кислота H2SO3 и др.) Амфотерные гидроксиды, проявляющие в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия Al(ОН)3, гидроксид цинка Zn(ОН)2).
Классификация оснований В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают: Основные гидроксиды (основания) — гидроксиды, проявляющие основные свойства (например, гидроксид кальция Ca(ОН)2, гидроксид калия KOH, гидроксид натрия NaOH и др.); Кислотные гидроксиды (кислородосодержащие кислоты) — гидроксиды, проявляющие кислотные свойства (например, азотная кислота HNO3, серная кислота H2SO4, сернистая кислота H2SO3 и др.) Амфотерные гидроксиды, проявляющие в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия Al(ОН)3, гидроксид цинка Zn(ОН)2).
Cлайд 5
 Способы получения оснований Получение щелочи при реакции сильноосновного оксида с водой Так как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей. CaO(т) + H2O(ж) → Ca(OH)2(p) Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя
Способы получения оснований Получение щелочи при реакции сильноосновного оксида с водой Так как только сильноосновные оксиды способны реагировать с водой, этот способ можно использовать исключительно для получения сильных оснований или щелочей. CaO(т) + H2O(ж) → Ca(OH)2(p) Слабоосновные и амфотерные оксиды с водой не реагируют, и поэтому соответствующие им гидроксиды таким способом получить нельзя
Cлайд 6
 Способы получения оснований Косвенное получение основания (гидроксида) при реакции соли со щелочью Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы. CuSO4(p) + 2NaOH(p) → Cu(OH)2(т)↓ + Na2SO4(p) Получение щелочи при реакции замещения типичного металла с водой. Ca+2H2O=Ca(OH)2+H2
Способы получения оснований Косвенное получение основания (гидроксида) при реакции соли со щелочью Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. Так как растворимость слабоосновных гидроксидов в воде очень мала, гидроксид выпадает из раствора в виде студнеобразной массы. CuSO4(p) + 2NaOH(p) → Cu(OH)2(т)↓ + Na2SO4(p) Получение щелочи при реакции замещения типичного металла с водой. Ca+2H2O=Ca(OH)2+H2
Cлайд 8
 Щёлочи Щёлочи — гидроксиды щелочных и щелочноземельных металлов и аммония. К щелочам относят хорошо растворимые в воде основания. При диссоциации щелочи образуют ионы OH− и ион металла. К щелочам относятся гидроксиды металлов подгрупп I-ой и II-ой периодической системы, например NaOH (едкий натр), KOH (едкое кали), Ba(OH)2. Едкие щёлочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH.
Щёлочи Щёлочи — гидроксиды щелочных и щелочноземельных металлов и аммония. К щелочам относят хорошо растворимые в воде основания. При диссоциации щелочи образуют ионы OH− и ион металла. К щелочам относятся гидроксиды металлов подгрупп I-ой и II-ой периодической системы, например NaOH (едкий натр), KOH (едкое кали), Ba(OH)2. Едкие щёлочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH.
Cлайд 9
 Физические свойства щелочей Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Кроме того, едкие щёлочи растворимы в этаноле и метаноле.
Физические свойства щелочей Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Кроме того, едкие щёлочи растворимы в этаноле и метаноле.