X
Код презентации скопируйте его
Биополимеры
Скачать эту презентациюПрезентация на тему Биополимеры
Скачать эту презентациюCлайд 4
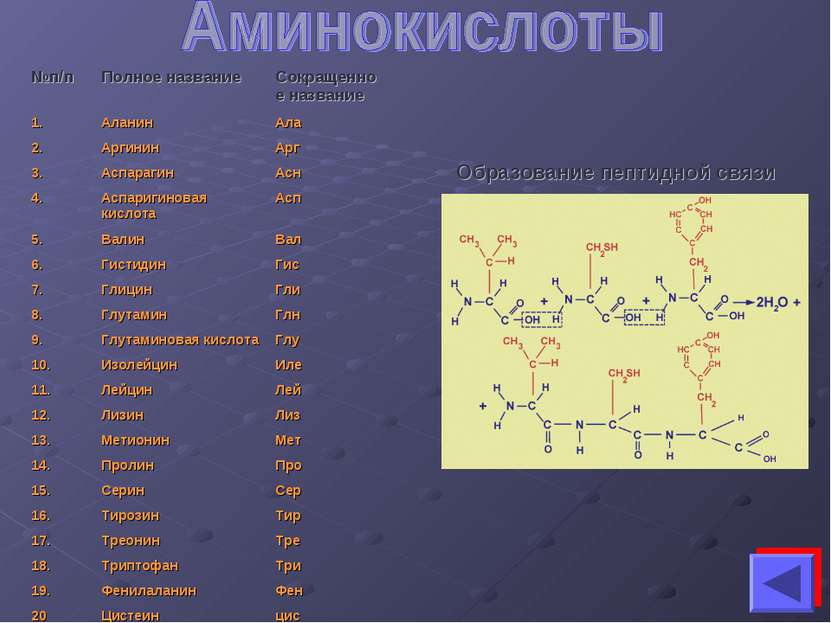
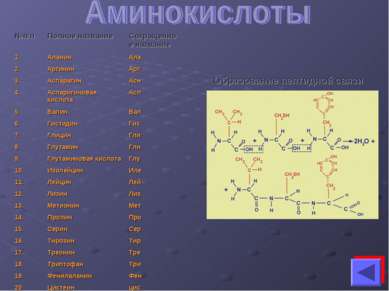
 Белки – это высокомолекулярные азотистые соединения, состоящие из аминокислот, связанных пептидными связями. Элементарный состав белков: С - 50%-55% Н – 6,3%-7,5% О – 21,5%-23,5% N – 15%-18% S - 0%-2,4% Р – 0%-2% Наиболее важным показателем является содержание N в белках. По содержанию N можно определить содержание белка в том или ином объекте: %белка = %N x 6,25 Как и любой биополимер белки также состоят из мономеров. Мономером белков является аминокислота. Выделяют примерно 170 аминокислот. Только 20 из них входят в состав белков. Они называются протеиногенными. NH2 – CH – COOH NH2 - аминогруппа СOOH – карбоксильная группа R Аминокислоты отличаются друг от друга только радикалами (R). Аминокислоты можно разделить на 2 группы: 1) заменимые (при отсутствии этих аминокислот они могут быть заменены другой аминокислотой близкой по строению); 2) незаменимые (при отсутствии этих аминокислот они не могут быть заменены другой аминокислотой (триптофан, метионин, лизин и др.). Они синтезируются только в автотрофных организмах.
Белки – это высокомолекулярные азотистые соединения, состоящие из аминокислот, связанных пептидными связями. Элементарный состав белков: С - 50%-55% Н – 6,3%-7,5% О – 21,5%-23,5% N – 15%-18% S - 0%-2,4% Р – 0%-2% Наиболее важным показателем является содержание N в белках. По содержанию N можно определить содержание белка в том или ином объекте: %белка = %N x 6,25 Как и любой биополимер белки также состоят из мономеров. Мономером белков является аминокислота. Выделяют примерно 170 аминокислот. Только 20 из них входят в состав белков. Они называются протеиногенными. NH2 – CH – COOH NH2 - аминогруппа СOOH – карбоксильная группа R Аминокислоты отличаются друг от друга только радикалами (R). Аминокислоты можно разделить на 2 группы: 1) заменимые (при отсутствии этих аминокислот они могут быть заменены другой аминокислотой близкой по строению); 2) незаменимые (при отсутствии этих аминокислот они не могут быть заменены другой аминокислотой (триптофан, метионин, лизин и др.). Они синтезируются только в автотрофных организмах.
Cлайд 7
 Последовательное расположение аминокислотных остатков в полипептидной цепи. …- ала – лиз – вал – вал – иле - … Первичная структура белков может быть использована для систематической номенклатуры белков.
Последовательное расположение аминокислотных остатков в полипептидной цепи. …- ала – лиз – вал – вал – иле - … Первичная структура белков может быть использована для систематической номенклатуры белков.
Cлайд 8
 Происходит пространственное расположение полипептидной цепи. В зависимости от торсионных углов возможно образование 3 основных типов вторичной структуры: 1) α – спираль. Торсионный угол колеблется от 45 до 60 градусов. Нативные (действующие) белки образуют правозакрученную α – спираль. Шаг спирали (один виток) – 0,54 нм, в шаге спирали 3,6 аминокислоты. Диаметр спирали – 0, 5 нм. Стабилизация α – спирали осуществляется за счет водородных связей, возникающих между соседними витками. 2) β – спираль. Торсионный угол от 120 до 130 градусов. Характерная особенность: они образуют складчатые слои. Диаметр спирали – 0,1 нм, шаг спирали – 0,33 нм, в шаге спирали 2,6 аминокислоты. Стабилизация осуществляется за счет межмолекулярных водородных связей между соседними молекулами. 3) β – изгиб. В состав может входить до 4 аминокислотных остатков. Происходит определенная укладка полипептидной цепи. Существуют также другие виды вторичной структуры: π – спираль (отличается от α - спирали линейными группами. И др.
Происходит пространственное расположение полипептидной цепи. В зависимости от торсионных углов возможно образование 3 основных типов вторичной структуры: 1) α – спираль. Торсионный угол колеблется от 45 до 60 градусов. Нативные (действующие) белки образуют правозакрученную α – спираль. Шаг спирали (один виток) – 0,54 нм, в шаге спирали 3,6 аминокислоты. Диаметр спирали – 0, 5 нм. Стабилизация α – спирали осуществляется за счет водородных связей, возникающих между соседними витками. 2) β – спираль. Торсионный угол от 120 до 130 градусов. Характерная особенность: они образуют складчатые слои. Диаметр спирали – 0,1 нм, шаг спирали – 0,33 нм, в шаге спирали 2,6 аминокислоты. Стабилизация осуществляется за счет межмолекулярных водородных связей между соседними молекулами. 3) β – изгиб. В состав может входить до 4 аминокислотных остатков. Происходит определенная укладка полипептидной цепи. Существуют также другие виды вторичной структуры: π – спираль (отличается от α - спирали линейными группами. И др.
Cлайд 9
 Происходит общее пространственное расположение белковой молекулы. Третичная структура определяется формой «упаковки» доменов. (домен – это определенные структуры, состоящие из разных типов вторичной структуры белков). В зависимости от соотношения α и β участков различают глобулярные и фибриллярные третичные структуры белков. Происходит образование структуры называемой глобула. В стабилизации третичной структуры участвуют: 1) дисульфитные ковалентные связи, образующиеся между остатками аминокислоты цистеина. Основная роль в стабилизации; 2) водородные связи; 3) ионная связь; 4) гидрофобное взаимодействие.
Происходит общее пространственное расположение белковой молекулы. Третичная структура определяется формой «упаковки» доменов. (домен – это определенные структуры, состоящие из разных типов вторичной структуры белков). В зависимости от соотношения α и β участков различают глобулярные и фибриллярные третичные структуры белков. Происходит образование структуры называемой глобула. В стабилизации третичной структуры участвуют: 1) дисульфитные ковалентные связи, образующиеся между остатками аминокислоты цистеина. Основная роль в стабилизации; 2) водородные связи; 3) ионная связь; 4) гидрофобное взаимодействие.
Cлайд 10
 Четвертичную структуру имеют только белки, состоящие из нескольких субъединиц. Это сформировавшаяся часть белковой молекулы, имеющий первичную, вторичную, третичную структуры. В состав белковых молекул обычно входят четное число субъединиц. Это обусловлено тем, что четное число субъединиц образует стабильную пространственную конфигурацию белков (тетраэдрическая, кубическая, диэдрическая и др.). Происходит пространственное расположение субъединиц. Примером четвертичной структуры может служить молекула гемоглобина, которая входит в состав эритроцитов (красные клетки крови). В состав гемоглобина входят 4 субъединицы (образуется тетраэдрическая конфигурация молекулы белка). Стабилизация структуры происходит за счет гидрофобных взаимодействий возникающих между субъединицами).
Четвертичную структуру имеют только белки, состоящие из нескольких субъединиц. Это сформировавшаяся часть белковой молекулы, имеющий первичную, вторичную, третичную структуры. В состав белковых молекул обычно входят четное число субъединиц. Это обусловлено тем, что четное число субъединиц образует стабильную пространственную конфигурацию белков (тетраэдрическая, кубическая, диэдрическая и др.). Происходит пространственное расположение субъединиц. Примером четвертичной структуры может служить молекула гемоглобина, которая входит в состав эритроцитов (красные клетки крови). В состав гемоглобина входят 4 субъединицы (образуется тетраэдрическая конфигурация молекулы белка). Стабилизация структуры происходит за счет гидрофобных взаимодействий возникающих между субъединицами).
Cлайд 11
 1) Пластическая (строительная) функция. Белки участвуют в образовании всех клеточных мембран и органоидов клетки, а также внеклеточных структур. 2) Каталитическая функция. Все биологические катализаторы – ферменты – вещества белковой природы, они ускоряют химические реакции, протекающие в клетке, в десятки и сотни тысяч раз. 3) Двигательная функция. Обеспечивается специальными сократительными белками. Эти белки участвуют во всех видах движения, к которым способны клетки и организмы: мерцание ресничек и биение жгутиков у простейших, сокращение мышц и многоклеточных животных, движение листьев у растений и др. 4) Транспортная функция. Происходит присоединение химических элементов (например, кислорода гемоглобином) или биологически активных веществ (гормонов) и переносе их к различным тканям и органам тела. Очень много транспортных белков в мембранах клеток, они перенося различные вещества из окружающей среды в клетку. 5) Защитная функция. При поступлении чужеродных белков или микроорганизмов в лейкоцитах образуются особые белки - антитела. Они связываются с чужеродными веществами- антигенами. В результате образуется безвредный, нетоксичный комплекс – антигенантитело, который впоследствии фагоцитируется. 6) Энергетическая функция. Белки могут служить источником энергии. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Однако, в таком качестве белки используются очень редко. 7) Регуляторная функция. Происходит за счет особых белков – гормонов. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Например, инсулин регулирует уровень глюкозы в крови. 8) Сигнальная функция. В мембрану встроены особые белки, способные изменять свою третичную структуру на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача информации в клетку.
1) Пластическая (строительная) функция. Белки участвуют в образовании всех клеточных мембран и органоидов клетки, а также внеклеточных структур. 2) Каталитическая функция. Все биологические катализаторы – ферменты – вещества белковой природы, они ускоряют химические реакции, протекающие в клетке, в десятки и сотни тысяч раз. 3) Двигательная функция. Обеспечивается специальными сократительными белками. Эти белки участвуют во всех видах движения, к которым способны клетки и организмы: мерцание ресничек и биение жгутиков у простейших, сокращение мышц и многоклеточных животных, движение листьев у растений и др. 4) Транспортная функция. Происходит присоединение химических элементов (например, кислорода гемоглобином) или биологически активных веществ (гормонов) и переносе их к различным тканям и органам тела. Очень много транспортных белков в мембранах клеток, они перенося различные вещества из окружающей среды в клетку. 5) Защитная функция. При поступлении чужеродных белков или микроорганизмов в лейкоцитах образуются особые белки - антитела. Они связываются с чужеродными веществами- антигенами. В результате образуется безвредный, нетоксичный комплекс – антигенантитело, который впоследствии фагоцитируется. 6) Энергетическая функция. Белки могут служить источником энергии. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Однако, в таком качестве белки используются очень редко. 7) Регуляторная функция. Происходит за счет особых белков – гормонов. Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Например, инсулин регулирует уровень глюкозы в крови. 8) Сигнальная функция. В мембрану встроены особые белки, способные изменять свою третичную структуру на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача информации в клетку.
Cлайд 12
 I. По химическому составу выделяют белки: 1) Простые (протеины), состоящие только из аминокислот. 2) сложные (протеиды), кроме аминокислот, в состав белков входят различные добавочные группы (нуклеопротеиды, гликопротеиды, и др.) II. По растворимости в различных растворителях: 1) Альбумины – растворяются в насыщенных растворах минеральных солей; 2) глобулины - растворяются в полунасыщенных растворах минеральных солей; 3) проламины – растворяются в 60%-80% этаноле; 4) глютаимины – растворяются в щелочных растворах и др. III. По характеру добавочных групп: 1) Металлопротеиды 2) Неметаллопротеиды.
I. По химическому составу выделяют белки: 1) Простые (протеины), состоящие только из аминокислот. 2) сложные (протеиды), кроме аминокислот, в состав белков входят различные добавочные группы (нуклеопротеиды, гликопротеиды, и др.) II. По растворимости в различных растворителях: 1) Альбумины – растворяются в насыщенных растворах минеральных солей; 2) глобулины - растворяются в полунасыщенных растворах минеральных солей; 3) проламины – растворяются в 60%-80% этаноле; 4) глютаимины – растворяются в щелочных растворах и др. III. По характеру добавочных групп: 1) Металлопротеиды 2) Неметаллопротеиды.
Cлайд 15
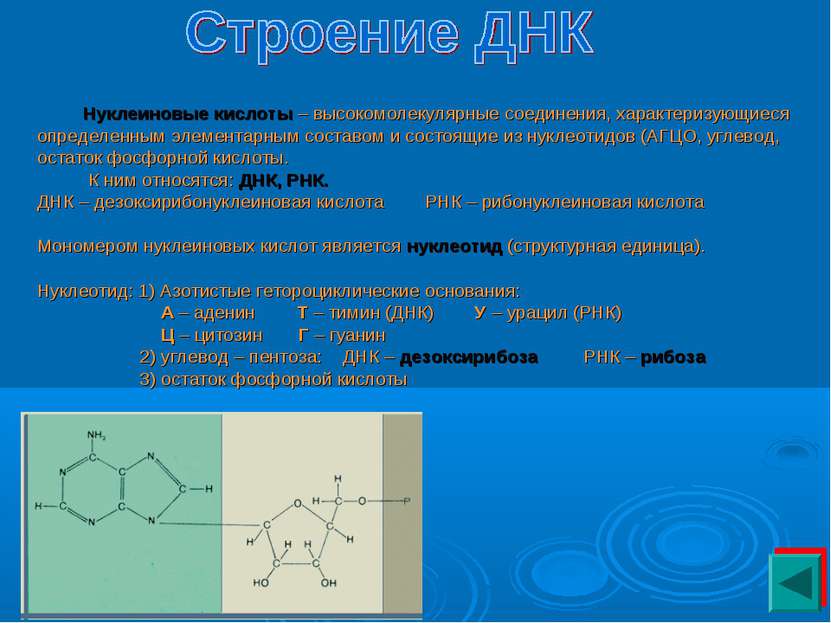
 Нуклеиновые кислоты – высокомолекулярные соединения, характеризующиеся определенным элементарным составом и состоящие из нуклеотидов (АГЦО, углевод, остаток фосфорной кислоты. К ним относятся: ДНК, РНК. ДНК – дезоксирибонуклеиновая кислота РНК – рибонуклеиновая кислота Мономером нуклеиновых кислот является нуклеотид (структурная единица). Нуклеотид: 1) Азотистые гетороциклические основания: А – аденин Т – тимин (ДНК) У – урацил (РНК) Ц – цитозин Г – гуанин 2) углевод – пентоза: ДНК – дезоксирибоза РНК – рибоза 3) остаток фосфорной кислоты
Нуклеиновые кислоты – высокомолекулярные соединения, характеризующиеся определенным элементарным составом и состоящие из нуклеотидов (АГЦО, углевод, остаток фосфорной кислоты. К ним относятся: ДНК, РНК. ДНК – дезоксирибонуклеиновая кислота РНК – рибонуклеиновая кислота Мономером нуклеиновых кислот является нуклеотид (структурная единица). Нуклеотид: 1) Азотистые гетороциклические основания: А – аденин Т – тимин (ДНК) У – урацил (РНК) Ц – цитозин Г – гуанин 2) углевод – пентоза: ДНК – дезоксирибоза РНК – рибоза 3) остаток фосфорной кислоты
Cлайд 17
 Происходит последовательное расположение нуклеотидов в полинуклеотидной цепи. В ходе изучения первичной структуры были открыты некоторые закономерности. 1) А + Г = Ц + Т Молекулярная масса пуриновых оснований равна молекулярной массе пиримидиновых оснований. 2) Отношение аденин-тиминовых пар и гуанин-цитозиновых пар представляет коэффициент специфичности ДНК. Этот показатель различается у различных видов животных. В ходе изучения первичной структуры было установлено, что 64% участков ДНК составляют уникальную последовательность. Такие участки называются – структурные гены. Структурные гены обеспечивают биосинтез специфических белков. Остальные гены контролируют синтез белка, которые требуются в больших количествах. (Ген – участок молекулы ДНК, содержащий информацию о первичной структуре одного определенного белка.)
Происходит последовательное расположение нуклеотидов в полинуклеотидной цепи. В ходе изучения первичной структуры были открыты некоторые закономерности. 1) А + Г = Ц + Т Молекулярная масса пуриновых оснований равна молекулярной массе пиримидиновых оснований. 2) Отношение аденин-тиминовых пар и гуанин-цитозиновых пар представляет коэффициент специфичности ДНК. Этот показатель различается у различных видов животных. В ходе изучения первичной структуры было установлено, что 64% участков ДНК составляют уникальную последовательность. Такие участки называются – структурные гены. Структурные гены обеспечивают биосинтез специфических белков. Остальные гены контролируют синтез белка, которые требуются в больших количествах. (Ген – участок молекулы ДНК, содержащий информацию о первичной структуре одного определенного белка.)
Cлайд 18
 Происходит определенное пространственное расположение полинуклеотидной цепи. Характерной особенность вторичной структуры является спирализация полинуклеотидной цепи. У ДНК уровень спирализации достигает до 100%. Вторичная структура была установлена Уотсоном и Криком (получили Нобелевскую премию). В состав молекулы ДНК входят две полинуклеотидные цепи, образуя двойную спираль. Закрутка спирали правая. Основа расположена снаружи (углевод, остаток фосфорной кислоты), а – азотистые основание внутри. АГЦО, между которыми образуются водородные связи образуют комплементарные пары: А – Т Г – Ц Между А и Т образуются две водородные связи. Между Г и Ц – три. Выделяют несколько форм вторичной структуры ДНК: 1) В – форма. Расположение АГЦО перпендикулярно к оси молекулы. В шаг спирали входят 16 пар нуклеотидов. Эта форма более стабильная. 2) А – форма. Расположение АГЦО происходит под углом 70 градусов к оси. В шаг спирали входят 11 пар нуклеотидов. Эта форма образуется в ходе репликации и транскрипции. 3) Z – форма. Характеризуется левой закруткой спирали. В шаг спирали входит 12 пар нуклеотидов.
Происходит определенное пространственное расположение полинуклеотидной цепи. Характерной особенность вторичной структуры является спирализация полинуклеотидной цепи. У ДНК уровень спирализации достигает до 100%. Вторичная структура была установлена Уотсоном и Криком (получили Нобелевскую премию). В состав молекулы ДНК входят две полинуклеотидные цепи, образуя двойную спираль. Закрутка спирали правая. Основа расположена снаружи (углевод, остаток фосфорной кислоты), а – азотистые основание внутри. АГЦО, между которыми образуются водородные связи образуют комплементарные пары: А – Т Г – Ц Между А и Т образуются две водородные связи. Между Г и Ц – три. Выделяют несколько форм вторичной структуры ДНК: 1) В – форма. Расположение АГЦО перпендикулярно к оси молекулы. В шаг спирали входят 16 пар нуклеотидов. Эта форма более стабильная. 2) А – форма. Расположение АГЦО происходит под углом 70 градусов к оси. В шаг спирали входят 11 пар нуклеотидов. Эта форма образуется в ходе репликации и транскрипции. 3) Z – форма. Характеризуется левой закруткой спирали. В шаг спирали входит 12 пар нуклеотидов.
Cлайд 19
 Происходит общее пространственное расположение молекулы ДНК. Благодаря третичной структуре происходит «плотная» упаковка молекулы ДНК в клетках прокариот и хромосомах ядра эукариот. Вещество хромосом называется хроматином и он содержит: ДНК, белки и некоторое количество РНК. Белки, входящие в состав белков: гистоны. Различают 5 видов гистонов, отличающиеся содержанием лизина и аргинина. В результате образуются нуклеосомы (размеры молекулы ДНК уменьшаются в20-50 раз). В состав нуклеосомы входит 145-150 нуклеотидов. Происходит скручивание нуклеосом, в результате образуется структура – соленоид (катушка) (размеры уменьшаются в 20-60 раз). Соленоиды образуют фибриллярные структуры (размеры уменьшаются в 200 раз). За счет которых образуются впоследствии хромосомы. В результате всей упаковки молекула ДНК уменьшается в 100 000 раз.
Происходит общее пространственное расположение молекулы ДНК. Благодаря третичной структуре происходит «плотная» упаковка молекулы ДНК в клетках прокариот и хромосомах ядра эукариот. Вещество хромосом называется хроматином и он содержит: ДНК, белки и некоторое количество РНК. Белки, входящие в состав белков: гистоны. Различают 5 видов гистонов, отличающиеся содержанием лизина и аргинина. В результате образуются нуклеосомы (размеры молекулы ДНК уменьшаются в20-50 раз). В состав нуклеосомы входит 145-150 нуклеотидов. Происходит скручивание нуклеосом, в результате образуется структура – соленоид (катушка) (размеры уменьшаются в 20-60 раз). Соленоиды образуют фибриллярные структуры (размеры уменьшаются в 200 раз). За счет которых образуются впоследствии хромосомы. В результате всей упаковки молекула ДНК уменьшается в 100 000 раз.
Cлайд 20
 Происходит общее пространственное расположение отдельных молекул ДНК в хромосоме и взаимное расположение отдельных молекул ДНК и РНК в ходе биосинтеза белка.
Происходит общее пространственное расположение отдельных молекул ДНК в хромосоме и взаимное расположение отдельных молекул ДНК и РНК в ходе биосинтеза белка.
Cлайд 21
 Значение ДНК (как РНК) в клетке очень велико. Особенности их химического строения обеспечивают возможность хранения, переноса и передачи по наследству дочерним клеткам информации о структуре белковых молекул, которые синтезируются в каждой ткани на определенном этапе индивидуального развития. Стабильность нуклеиновых кислот - важнейшее условие нормальной жизнедеятельности клеток влекут за собой изменения структуры клеток или активности физиологических процессов в них, влияя таким образом на жизнеспособность.
Значение ДНК (как РНК) в клетке очень велико. Особенности их химического строения обеспечивают возможность хранения, переноса и передачи по наследству дочерним клеткам информации о структуре белковых молекул, которые синтезируются в каждой ткани на определенном этапе индивидуального развития. Стабильность нуклеиновых кислот - важнейшее условие нормальной жизнедеятельности клеток влекут за собой изменения структуры клеток или активности физиологических процессов в них, влияя таким образом на жизнеспособность.
Cлайд 23
 РНК, как и ДНК представляет собой биополимер, мономерами которого являются нуклеотиды, состоящие из трех основных компонентов: 1) азотистое основание; 2) углевод – рибозы; 3) остаток фосфорной кислоты. В состав РНК входят те же самые азотистые основания, что и в ДНК. Но вместо тимина (Т) в состав РНК входит урацил (У). По структуре различают одноцепочечные и двуцепочечные РНК. Двуцепочечные РНК являются хранителем наследственной информации у ряда вирусов. Существует несколько видов одноцепочечных РНК: т-РНК, и-РНК, р-РНК.
РНК, как и ДНК представляет собой биополимер, мономерами которого являются нуклеотиды, состоящие из трех основных компонентов: 1) азотистое основание; 2) углевод – рибозы; 3) остаток фосфорной кислоты. В состав РНК входят те же самые азотистые основания, что и в ДНК. Но вместо тимина (Т) в состав РНК входит урацил (У). По структуре различают одноцепочечные и двуцепочечные РНК. Двуцепочечные РНК являются хранителем наследственной информации у ряда вирусов. Существует несколько видов одноцепочечных РНК: т-РНК, и-РНК, р-РНК.
Cлайд 25
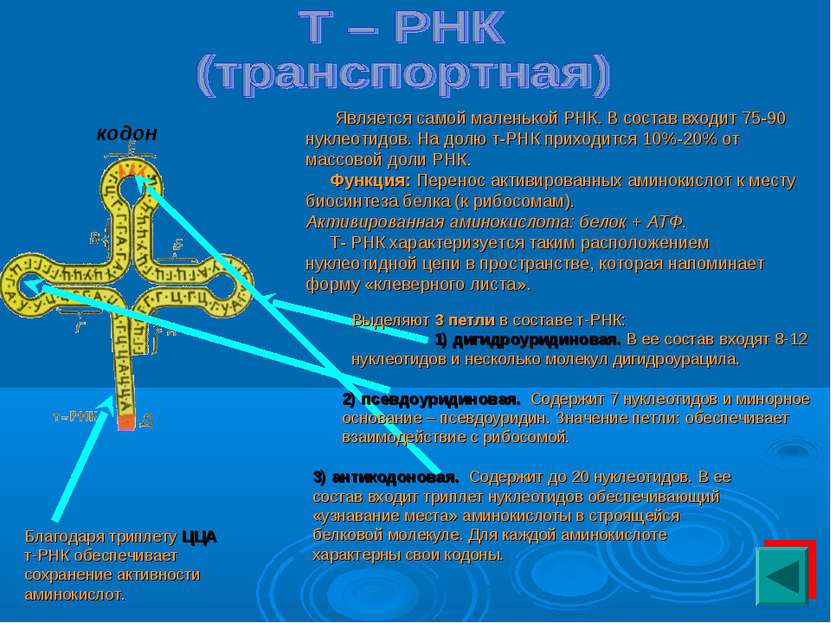
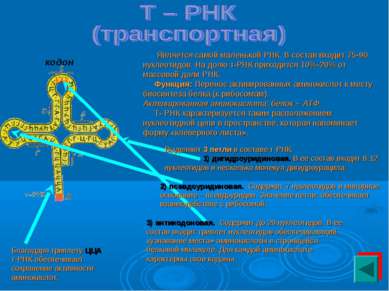 Является самой маленькой РНК. В состав входит 75-90 нуклеотидов. На долю т-РНК приходится 10%-20% от массовой доли РНК. Функция: Перенос активированных аминокислот к месту биосинтеза белка (к рибосомам). Активированная аминокислота: белок + АТФ. Т- РНК характеризуется таким расположением нуклеотидной цепи в пространстве, которая напоминает форму «клеверного листа». кодон Выделяют 3 петли в составе т-РНК: 1) дигидроуридиновая. В ее состав входят 8-12 нуклеотидов и несколько молекул дигидроурацила. 2) псевдоуридиновая. Содержит 7 нуклеотидов и минорное основание – псевдоуридин. Значение петли: обеспечивает взаимодействие с рибосомой. 3) антикодоновая. Содержит до 20 нуклеотидов. В ее состав входит триплет нуклеотидов обеспечивающий «узнавание места» аминокислоты в строящейся белковой молекуле. Для каждой аминокислоте характерны свои кодоны. Благодаря триплету ЦЦА т-РНК обеспечивает сохранение активности аминокислот.
Является самой маленькой РНК. В состав входит 75-90 нуклеотидов. На долю т-РНК приходится 10%-20% от массовой доли РНК. Функция: Перенос активированных аминокислот к месту биосинтеза белка (к рибосомам). Активированная аминокислота: белок + АТФ. Т- РНК характеризуется таким расположением нуклеотидной цепи в пространстве, которая напоминает форму «клеверного листа». кодон Выделяют 3 петли в составе т-РНК: 1) дигидроуридиновая. В ее состав входят 8-12 нуклеотидов и несколько молекул дигидроурацила. 2) псевдоуридиновая. Содержит 7 нуклеотидов и минорное основание – псевдоуридин. Значение петли: обеспечивает взаимодействие с рибосомой. 3) антикодоновая. Содержит до 20 нуклеотидов. В ее состав входит триплет нуклеотидов обеспечивающий «узнавание места» аминокислоты в строящейся белковой молекуле. Для каждой аминокислоте характерны свои кодоны. Благодаря триплету ЦЦА т-РНК обеспечивает сохранение активности аминокислот.
Cлайд 26
 И - РНК образуется в ходе транскрипции на молекуле ДНК, поэтому первичная структура и-РНК является «отражением» соответствующего гена. Помимо этого в ходе биосинтеза и-РНК образуется достройка молекулы. На долю и-РНК приходится от 2 до 6% массовой доли всех РНК. В состав и-РНК входит 6 участков, каждый выполняет определенные функции. 1) КЭП. Роль: стабилизация молекулы и-РНК. 2) Предцистронный участок. Роль: связывание с рибосомой за счет образования водородной связи. 3) Инициирующий участок. Роль: содержится «команда» о начале биосинтеза белка в рибосоме. 4) Цистронный участок. Роль: несет информацию о биосинтезе белка. 5) Обрывающийся триплет. Роль: Содержится «команда» о прекращении биосинтеза белка. 6) Постцистронный участок. Роль: Регулирование количества синтезируемого белка.
И - РНК образуется в ходе транскрипции на молекуле ДНК, поэтому первичная структура и-РНК является «отражением» соответствующего гена. Помимо этого в ходе биосинтеза и-РНК образуется достройка молекулы. На долю и-РНК приходится от 2 до 6% массовой доли всех РНК. В состав и-РНК входит 6 участков, каждый выполняет определенные функции. 1) КЭП. Роль: стабилизация молекулы и-РНК. 2) Предцистронный участок. Роль: связывание с рибосомой за счет образования водородной связи. 3) Инициирующий участок. Роль: содержится «команда» о начале биосинтеза белка в рибосоме. 4) Цистронный участок. Роль: несет информацию о биосинтезе белка. 5) Обрывающийся триплет. Роль: Содержится «команда» о прекращении биосинтеза белка. 6) Постцистронный участок. Роль: Регулирование количества синтезируемого белка.
Cлайд 27
 Являются основным структурным компонентом рибосом. На долю р-РНК приходится до 75% от общей массы РНК. Взаимодействуя с белками (гистонами) р-РНК образует субъединицы рибосом. Рибосомы состоят из большой и малой субъединиц.
Являются основным структурным компонентом рибосом. На долю р-РНК приходится до 75% от общей массы РНК. Взаимодействуя с белками (гистонами) р-РНК образует субъединицы рибосом. Рибосомы состоят из большой и малой субъединиц.
Cлайд 29
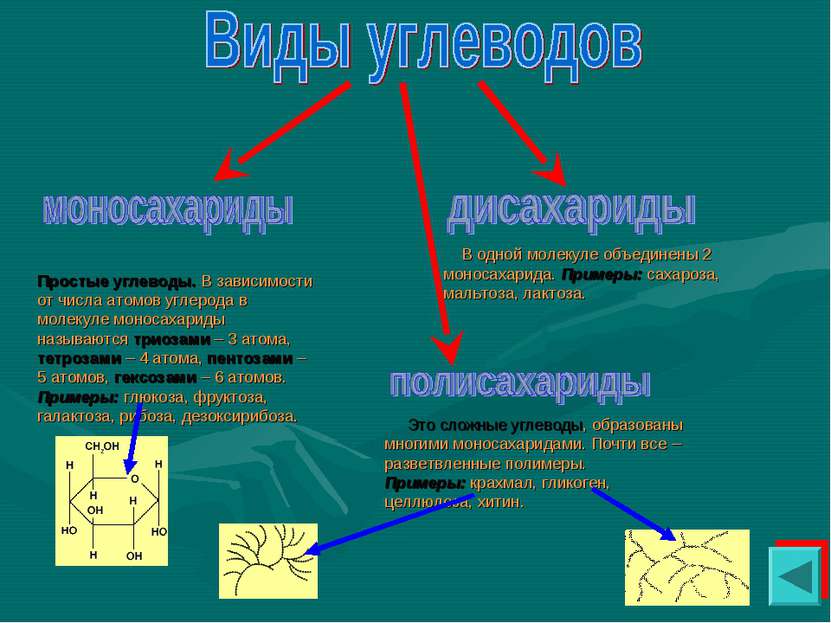
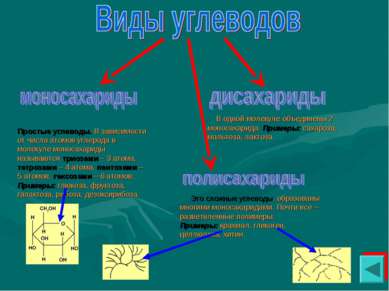 Простые углеводы. В зависимости от числа атомов углерода в молекуле моносахариды называются триозами – 3 атома, тетрозами – 4 атома, пентозами – 5 атомов, гексозами – 6 атомов. Примеры: глюкоза, фруктоза, галактоза, рибоза, дезоксирибоза. В одной молекуле объединены 2 моносахарида. Примеры: сахароза, мальтоза, лактоза. Это сложные углеводы, образованы многими моносахаридами. Почти все – разветвленные полимеры. Примеры: крахмал, гликоген, целлюлоза, хитин.
Простые углеводы. В зависимости от числа атомов углерода в молекуле моносахариды называются триозами – 3 атома, тетрозами – 4 атома, пентозами – 5 атомов, гексозами – 6 атомов. Примеры: глюкоза, фруктоза, галактоза, рибоза, дезоксирибоза. В одной молекуле объединены 2 моносахарида. Примеры: сахароза, мальтоза, лактоза. Это сложные углеводы, образованы многими моносахаридами. Почти все – разветвленные полимеры. Примеры: крахмал, гликоген, целлюлоза, хитин.
Cлайд 30
 1) Основная функция – энергетическая. При расщеплении и окислении выделяется энергия, которая обеспечивает жизнедеятельность организма. В процессе окисления 1 г углевода освобождается 17,6 кДж энергии. 2) строительная функция. Целлюлоза входит в состав стенки растительных клеток; сложный полисахарид хитин - главный структурный компонент наружного скелета членистоногих. Строительную функцию хитин выполняет и у грибов. Крахмал – запасное питательное вещество у растений. Гликоген образуется из избытка глюкозы в крови. И т.д.
1) Основная функция – энергетическая. При расщеплении и окислении выделяется энергия, которая обеспечивает жизнедеятельность организма. В процессе окисления 1 г углевода освобождается 17,6 кДж энергии. 2) строительная функция. Целлюлоза входит в состав стенки растительных клеток; сложный полисахарид хитин - главный структурный компонент наружного скелета членистоногих. Строительную функцию хитин выполняет и у грибов. Крахмал – запасное питательное вещество у растений. Гликоген образуется из избытка глюкозы в крови. И т.д.
Cлайд 31
 Липиды присутствуют во всех без исключения клетках, выполняя специфические биологические функции. Жиры – наиболее простые и широко распространенные липиды. Липиды представляют собой соединение, состоящее из: 1) высокомолекулярных жирных кислот 2) трехатомного спирта - глицерина Жиры не растворяются в воде, они гидрофобны. В клетках есть и другие сложные гидрофобные жироподобные вещество – липоиды. Функции: 1) запасающая. У позвоночных животных примерно половина энергии, потребляемой клетками в состоянии покоя , образуется за счет окисления жиров. 2) энергетическая. В ходе расщепления 1 г жиров до СО2 и Н2О освобождается большое количество энергии – 38,9 кДж. 3) теплоизоляция. У некоторых животных (тюлени, киты) он откладывается в подкожной жировой ткани, которая у китов образует слой толщиной до 1 м. 4) регуляторная. Многие гормоны (например, коры надпочечников, половые) являются производными липидов.
Липиды присутствуют во всех без исключения клетках, выполняя специфические биологические функции. Жиры – наиболее простые и широко распространенные липиды. Липиды представляют собой соединение, состоящее из: 1) высокомолекулярных жирных кислот 2) трехатомного спирта - глицерина Жиры не растворяются в воде, они гидрофобны. В клетках есть и другие сложные гидрофобные жироподобные вещество – липоиды. Функции: 1) запасающая. У позвоночных животных примерно половина энергии, потребляемой клетками в состоянии покоя , образуется за счет окисления жиров. 2) энергетическая. В ходе расщепления 1 г жиров до СО2 и Н2О освобождается большое количество энергии – 38,9 кДж. 3) теплоизоляция. У некоторых животных (тюлени, киты) он откладывается в подкожной жировой ткани, которая у китов образует слой толщиной до 1 м. 4) регуляторная. Многие гормоны (например, коры надпочечников, половые) являются производными липидов.