X
Код презентации скопируйте его
Ионная химическая связь
Скачать эту презентациюПрезентация на тему Ионная химическая связь
Скачать эту презентациюCлайд 1
 Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Cлайд 2
 Ионная химическая связь Ионная химическая связь – это связь, образовавшаяся за счет электрического притяжения катионов к анионам. Наиболее устойчивой является такая электронная конфигурация атомов, при которой на внешнем электронном уровне, подобно атомам благородных газов, будет находиться 8 электронов (а для 1 энергетического уровня – 2) При химических взаимодействиях атомы стремятся приобрести именно такую устойчивую электронную конфигурацию. Это происходит во время процесса восстановления или окисления.
Ионная химическая связь Ионная химическая связь – это связь, образовавшаяся за счет электрического притяжения катионов к анионам. Наиболее устойчивой является такая электронная конфигурация атомов, при которой на внешнем электронном уровне, подобно атомам благородных газов, будет находиться 8 электронов (а для 1 энергетического уровня – 2) При химических взаимодействиях атомы стремятся приобрести именно такую устойчивую электронную конфигурацию. Это происходит во время процесса восстановления или окисления.
Cлайд 3
 Атомы, присоединившие свои электроны, превращаются в отрицательные ионы, или анионы, а атомы, отдавшие электроны – в положительные ионы, или катионы. Между катионами и анионами возникают силы электростатического притяжения, которые будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь. Этот тип связи характерен для элементов главных подгрупп I и II групп, кроме Mg и Be)
Атомы, присоединившие свои электроны, превращаются в отрицательные ионы, или анионы, а атомы, отдавшие электроны – в положительные ионы, или катионы. Между катионами и анионами возникают силы электростатического притяжения, которые будут удерживать их друг около друга, осуществляя тем самым ионную химическую связь. Этот тип связи характерен для элементов главных подгрупп I и II групп, кроме Mg и Be)
Cлайд 4
 Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с противоположно заряженными ионами, вследствие чего образуются соединения с ионной кристаллической решеткой. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления. Растворы и расплавы большинства ионных соединений – электролиты. Ионная связь является случаем ковалентной полярной связи.
Два разноименно заряженных иона, связанные силами притяжения, не теряют способности взаимодействовать с противоположно заряженными ионами, вследствие чего образуются соединения с ионной кристаллической решеткой. Ионные соединения представляют собой твердые, прочные, тугоплавкие вещества с высокой температурой плавления. Растворы и расплавы большинства ионных соединений – электролиты. Ионная связь является случаем ковалентной полярной связи.
Cлайд 5
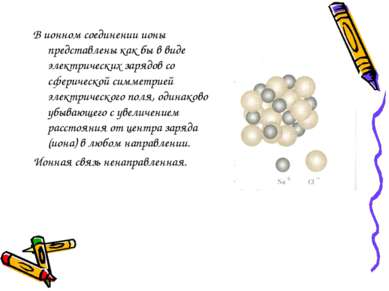 В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении. Ионная связь ненаправленная.
В ионном соединении ионы представлены как бы в виде электрических зарядов со сферической симметрией электрического поля, одинаково убывающего с увеличением расстояния от центра заряда (иона) в любом направлении. Ионная связь ненаправленная.
Cлайд 6
 Ковалентная химическая связь Ковалентная химическая связь – это связь, возникающая между атомами за счет общих электронных пар.
Ковалентная химическая связь Ковалентная химическая связь – это связь, возникающая между атомами за счет общих электронных пар.
Cлайд 7
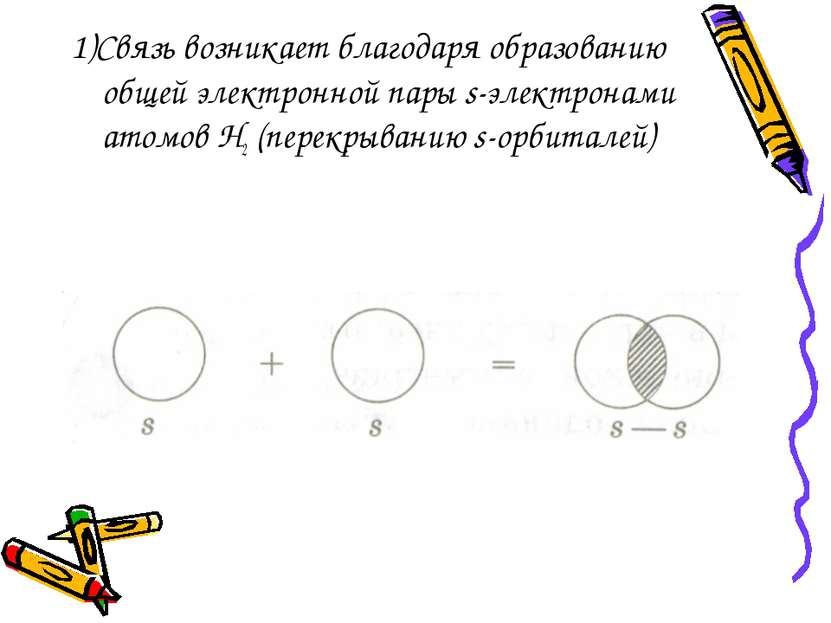
 1)Связь возникает благодаря образованию общей электронной пары s-электронами атомов H2 (перекрыванию s-орбиталей)
1)Связь возникает благодаря образованию общей электронной пары s-электронами атомов H2 (перекрыванию s-орбиталей)
Cлайд 8
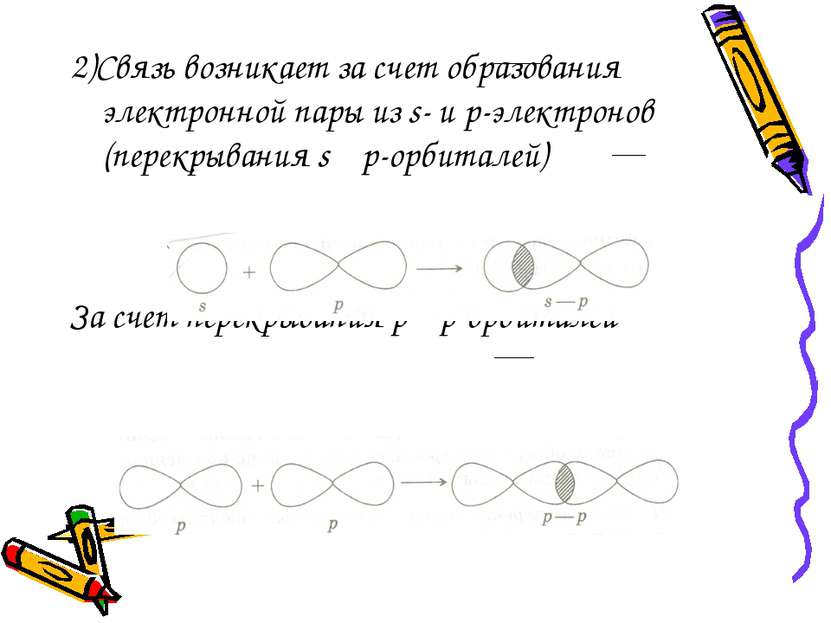
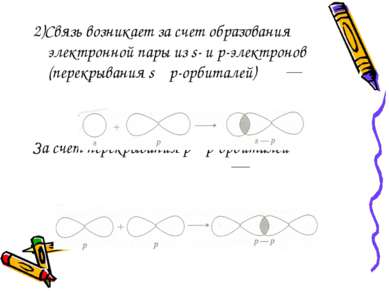 2)Связь возникает за счет образования электронной пары из s- и p-электронов (перекрывания s p-орбиталей) За счет перекрывания p p-орбиталей
2)Связь возникает за счет образования электронной пары из s- и p-электронов (перекрывания s p-орбиталей) За счет перекрывания p p-орбиталей
Cлайд 9
 Донорно-акцепторный механизм образования ковалентной связи рассмотрим на классическом примере образования иона аммония NH4 Донор имеет электронную пару, акцептор – свободную орбиталь, которую эта пара может занять. В ионе аммония все 4 связи ковалентные и равноценные.
Донорно-акцепторный механизм образования ковалентной связи рассмотрим на классическом примере образования иона аммония NH4 Донор имеет электронную пару, акцептор – свободную орбиталь, которую эта пара может занять. В ионе аммония все 4 связи ковалентные и равноценные.
Cлайд 10
 По способу перекрывания электронных орбиталей различают σ и π-ковалентные связи (сигма- и пи- ) 1). σ –связь. Электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов. Эта связь прочная. 2)π-связь образуется за счет бокового перекрывания p-орбиталей в двух областях. Эта связь менее прочная.
По способу перекрывания электронных орбиталей различают σ и π-ковалентные связи (сигма- и пи- ) 1). σ –связь. Электронная плотность находится в одной области, расположенной на линии, соединяющей ядра атомов. Эта связь прочная. 2)π-связь образуется за счет бокового перекрывания p-орбиталей в двух областях. Эта связь менее прочная.
Cлайд 11
 σ-связи могут образовываться за счет перекрывания электронных орбиталей: S S (H2) S P (HCl) P P (Cl2) А также за счет перекрывания «чистых» и гибридных орбиталей S SP3 (CH4) SP2 SP3 (C2H4)
σ-связи могут образовываться за счет перекрывания электронных орбиталей: S S (H2) S P (HCl) P P (Cl2) А также за счет перекрывания «чистых» и гибридных орбиталей S SP3 (CH4) SP2 SP3 (C2H4)
Cлайд 12
 По числу общих электронных пар, связывающих атомы, то есть по кратности, различают связи: Одинарные H2 H H Двойные CO2 O C O Тройные N2 N N
По числу общих электронных пар, связывающих атомы, то есть по кратности, различают связи: Одинарные H2 H H Двойные CO2 O C O Тройные N2 N N
Cлайд 13
 По степени смещённости общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной. Ковалентную химическую связь, образующуюся между атомам с одинаковой электроотрицательностью, называют НЕПОЛЯРНОЙ. H2 Cl2 N2 Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют ПОЛЯРНОЙ. NH3
По степени смещённости общих электронных пар к одному из связанных ими атомов ковалентная связь может быть неполярной и полярной. Ковалентную химическую связь, образующуюся между атомам с одинаковой электроотрицательностью, называют НЕПОЛЯРНОЙ. H2 Cl2 N2 Ковалентную химическую связь между атомами элементов, электроотрицательности которых различаются, называют ПОЛЯРНОЙ. NH3
Cлайд 14
 Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов: Атомной – очень прочной (алмаз, графит, кварц SiO2) Молекулярной – в обычных условиях это газы, легколетучие жидкости и твердые, но легкоплавкие или возгоняющиеся вещества (Cl2, H2O, I2,CO2 и др.)
Вещества с ковалентной связью характеризуются кристаллической решеткой двух типов: Атомной – очень прочной (алмаз, графит, кварц SiO2) Молекулярной – в обычных условиях это газы, легколетучие жидкости и твердые, но легкоплавкие или возгоняющиеся вещества (Cl2, H2O, I2,CO2 и др.)
Cлайд 15
 Металлическая связь Это связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
Металлическая связь Это связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке.
Cлайд 16
 Это связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов. M0 nē Mn+ Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск.
Это связь ненаправленная, ненасыщенная, характеризуется небольшим числом валентных электронов и большим числом свободных орбиталей, что характерно для атомов металлов. M0 nē Mn+ Наличием металлической связи обусловлены физические свойства металлов и сплавов: твердость, электрическая проводимость и теплопроводность, ковкость, пластичность, металлический блеск.
Cлайд 17
 Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неопределенные электронные пары (F, O, N и реже Cl и S) другой молекулы (или ее части)
Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно поляризованными атомами сильно электроотрицательных элементов, имеющих неопределенные электронные пары (F, O, N и реже Cl и S) другой молекулы (или ее части)
Cлайд 18
 Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер.
Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер.
Cлайд 19
 В биополимерах – белках имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы C O -… +H N
В биополимерах – белках имеется внутримолекулярная водородная связь между карбонильным кислородом и водородом аминогруппы C O -… +H N
Cлайд 20
 Единая природа химической связи Деление химических связей на группы носит условный характер. Ионную связь можно рассматривать как предельный случай ковалентной связи. Металлическая связь совмещает ковалентное взаимодействие атомов и электростатическое притяжение между этими электронами и ионами металлов.
Единая природа химической связи Деление химических связей на группы носит условный характер. Ионную связь можно рассматривать как предельный случай ковалентной связи. Металлическая связь совмещает ковалентное взаимодействие атомов и электростатическое притяжение между этими электронами и ионами металлов.
Cлайд 21
 Различные типы связей могут содержаться в одних и тех же веществах. Например: В основаниях – между атомами кислорода и водорода в гидроксогруппах связь ковалентная полярная, а между металлом и гидроксогруппой – ионная; В солях кислородсодержащих кислот - между атомами неметалла и кислородом кислотного остатка – ковалентная полярная, а между металлом и кислотным остатком – ионная;
Различные типы связей могут содержаться в одних и тех же веществах. Например: В основаниях – между атомами кислорода и водорода в гидроксогруппах связь ковалентная полярная, а между металлом и гидроксогруппой – ионная; В солях кислородсодержащих кислот - между атомами неметалла и кислородом кислотного остатка – ковалентная полярная, а между металлом и кислотным остатком – ионная;
Cлайд 22
 В солях аммония, метиламмония и т.д. – между атомами азота и водорода – ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком – ионная и т.д. В пероксидах металлов – связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом – ионная и т.д.
В солях аммония, метиламмония и т.д. – между атомами азота и водорода – ковалентная полярная, а между ионами аммония или метиламмония и кислотным остатком – ионная и т.д. В пероксидах металлов – связь между атомами кислорода ковалентная неполярная, а между металлом и кислородом – ионная и т.д.