X
Код презентации скопируйте его
Ковалентная связь 11 класс
Скачать эту презентациюПрезентация на тему Ковалентная связь 11 класс
Скачать эту презентациюCлайд 1
 Химическая связь 11 класс РАБОТА ВЫПОЛНЕНА учителем химии средней школы №118 Выборгского района Санкт - Петербурга ТИХОМИРОВОЙ ЛЮДМИЛОЙ ВИКТОРОВНОЙ
Химическая связь 11 класс РАБОТА ВЫПОЛНЕНА учителем химии средней школы №118 Выборгского района Санкт - Петербурга ТИХОМИРОВОЙ ЛЮДМИЛОЙ ВИКТОРОВНОЙ
Cлайд 2
 Ковалентная связь - это химическая связь, возникающая между атомами за счет образования общих электронных пар.
Ковалентная связь - это химическая связь, возникающая между атомами за счет образования общих электронных пар.
Cлайд 3
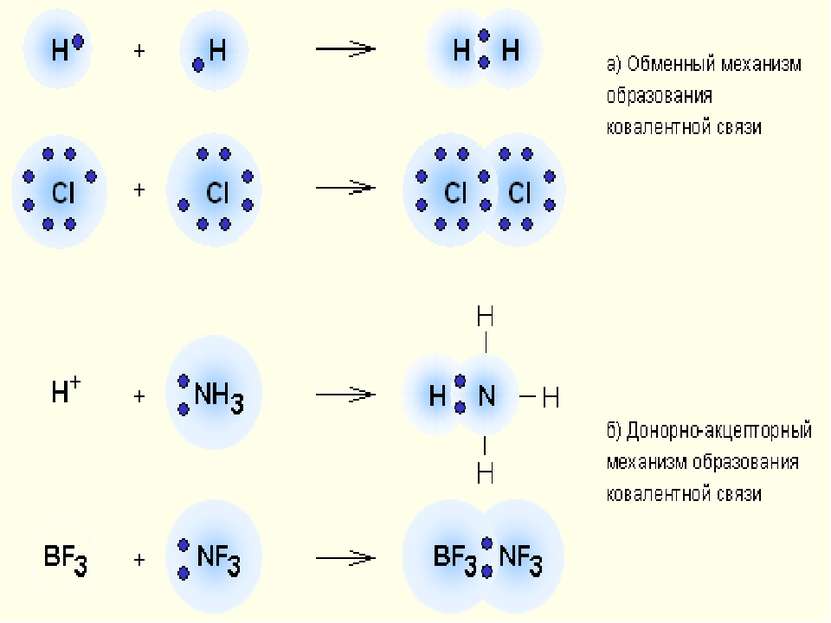
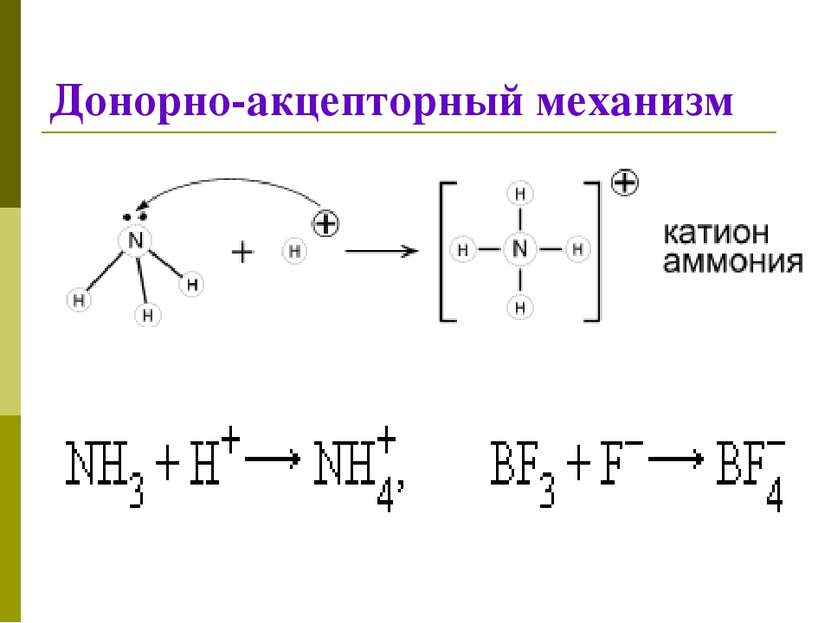
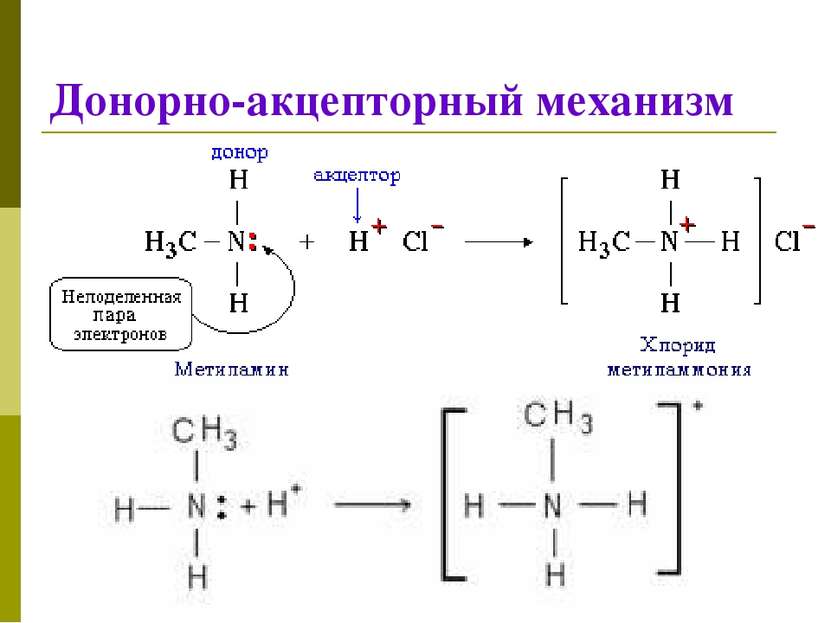
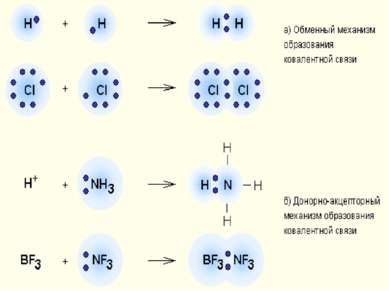
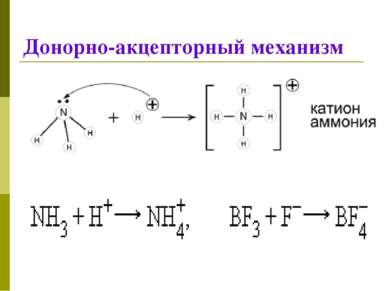
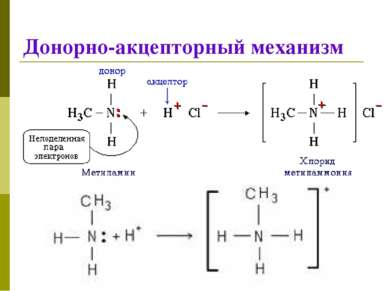
 Классификация КС 1. По механизму образования Обменный механизм Каждый из атомов предоставляет неспаренный ( неспаренные) электроны для образования связи Донорно-акцепторный механизм Донор предоставляет общую электронную пару, акцептор предоставляет свободную электронную орбиталь,которую эта пара может занять
Классификация КС 1. По механизму образования Обменный механизм Каждый из атомов предоставляет неспаренный ( неспаренные) электроны для образования связи Донорно-акцепторный механизм Донор предоставляет общую электронную пару, акцептор предоставляет свободную электронную орбиталь,которую эта пара может занять
Cлайд 8
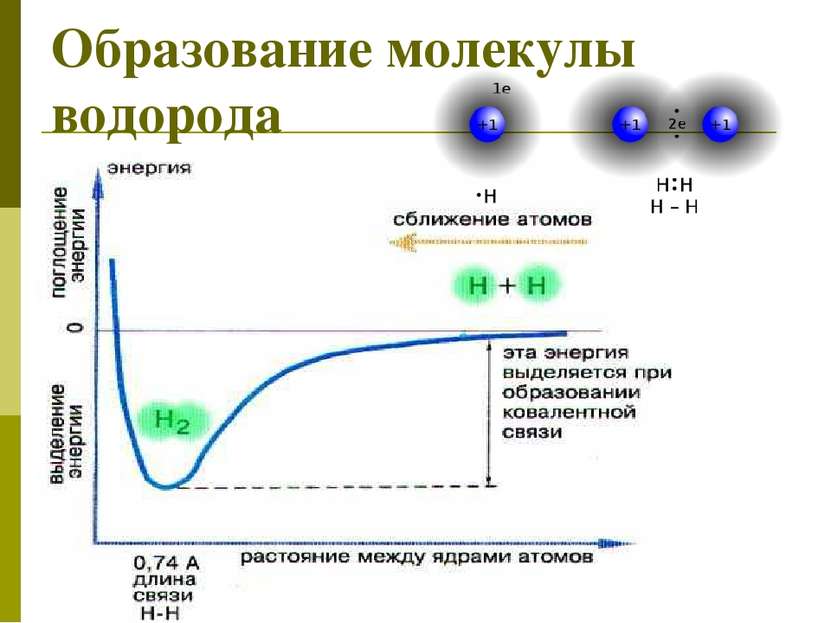
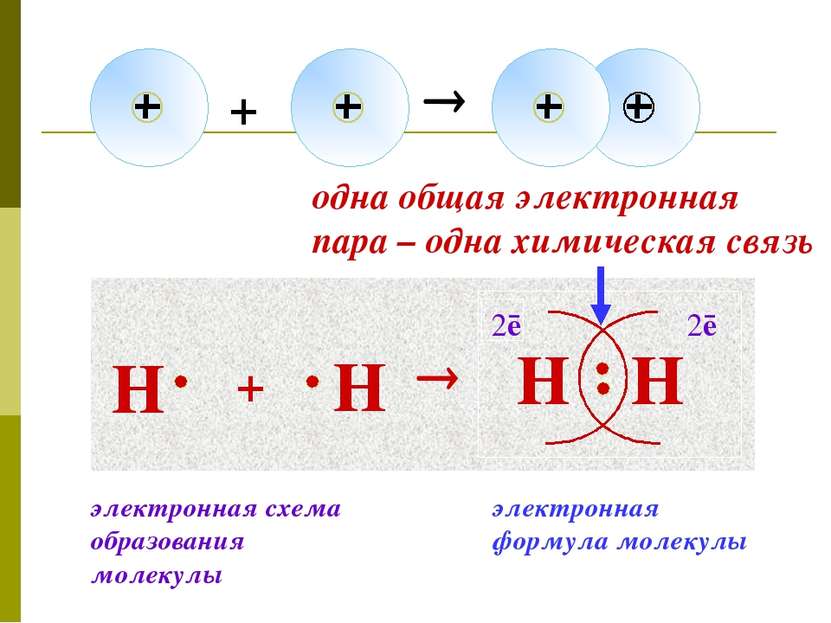
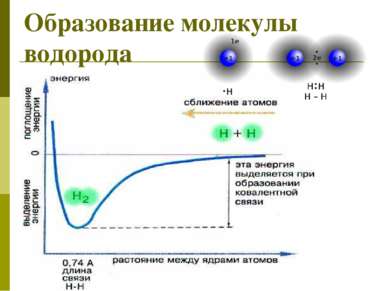
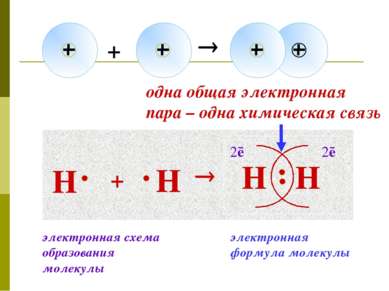 Н + Н Н Н 2ē 2ē одна общая электронная пара – одна химическая связь электронная формула молекулы электронная схема образования молекулы
Н + Н Н Н 2ē 2ē одна общая электронная пара – одна химическая связь электронная формула молекулы электронная схема образования молекулы
Cлайд 9
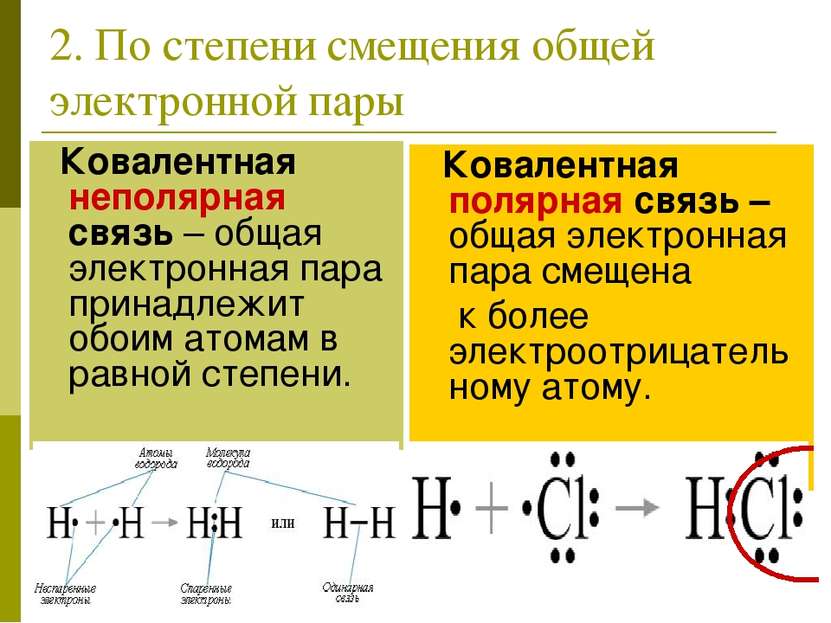
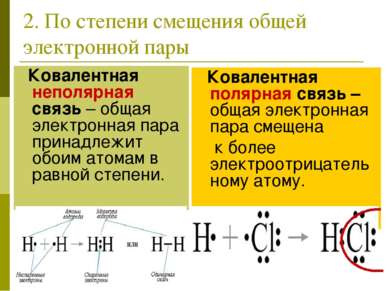 2. По степени смещения общей электронной пары Ковалентная неполярная связь – общая электронная пара принадлежит обоим атомам в равной степени. Ковалентная полярная связь –общая электронная пара смещена к более электроотрицательному атому.
2. По степени смещения общей электронной пары Ковалентная неполярная связь – общая электронная пара принадлежит обоим атомам в равной степени. Ковалентная полярная связь –общая электронная пара смещена к более электроотрицательному атому.
Cлайд 10
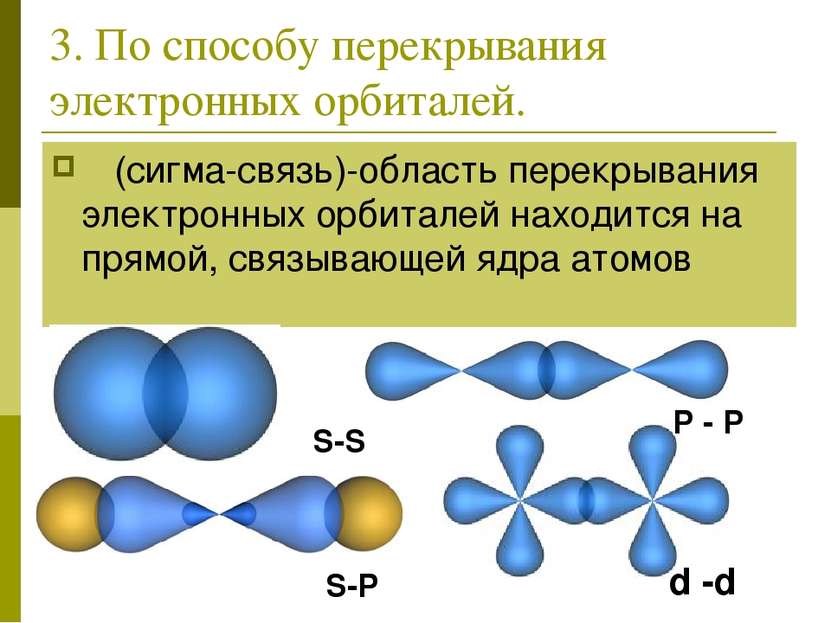
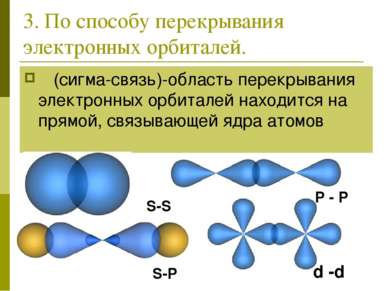 3. По способу перекрывания электронных орбиталей. σ (сигма-связь)-область перекрывания электронных орбиталей находится на прямой, связывающей ядра атомов S-S P - P S-P d -d
3. По способу перекрывания электронных орбиталей. σ (сигма-связь)-область перекрывания электронных орбиталей находится на прямой, связывающей ядра атомов S-S P - P S-P d -d
Cлайд 11
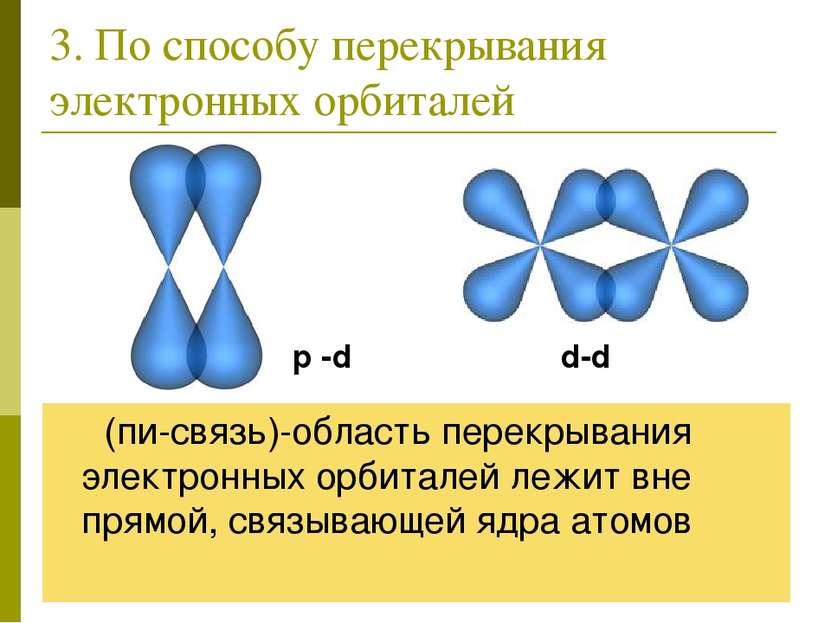
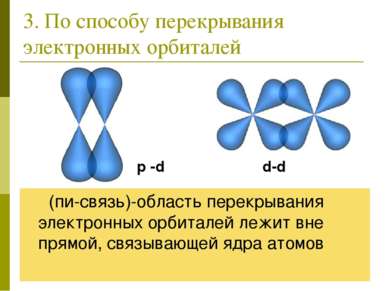 3. По способу перекрывания электронных орбиталей π (пи-связь)-область перекрывания электронных орбиталей лежит вне прямой, связывающей ядра атомов p -d d-d
3. По способу перекрывания электронных орбиталей π (пи-связь)-область перекрывания электронных орбиталей лежит вне прямой, связывающей ядра атомов p -d d-d
Cлайд 12
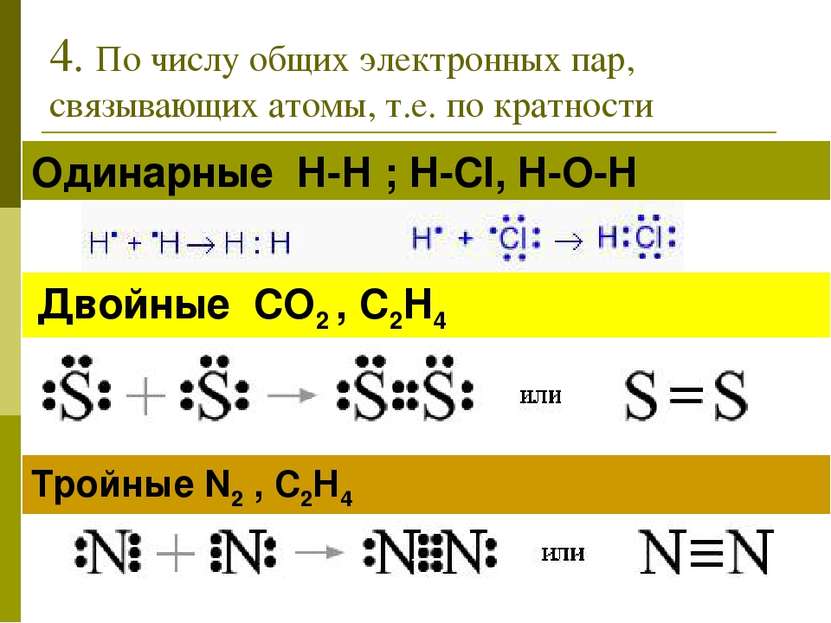
 4. По числу общих электронных пар, связывающих атомы, т.е. по кратности Одинарные Н-Н ; H-Cl, H-O-H Двойные СО2 , С2Н4 Тройные N2 , С2Н4
4. По числу общих электронных пар, связывающих атомы, т.е. по кратности Одинарные Н-Н ; H-Cl, H-O-H Двойные СО2 , С2Н4 Тройные N2 , С2Н4
Cлайд 13
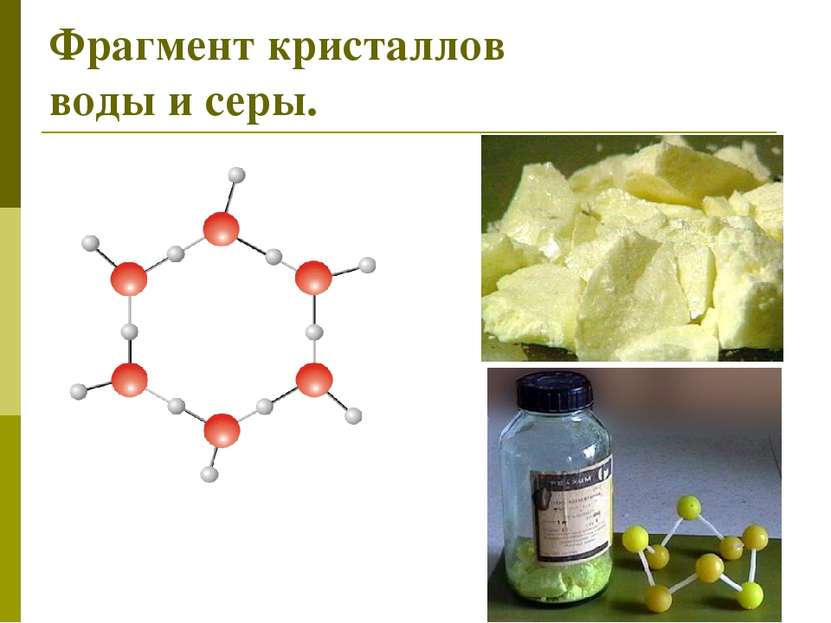
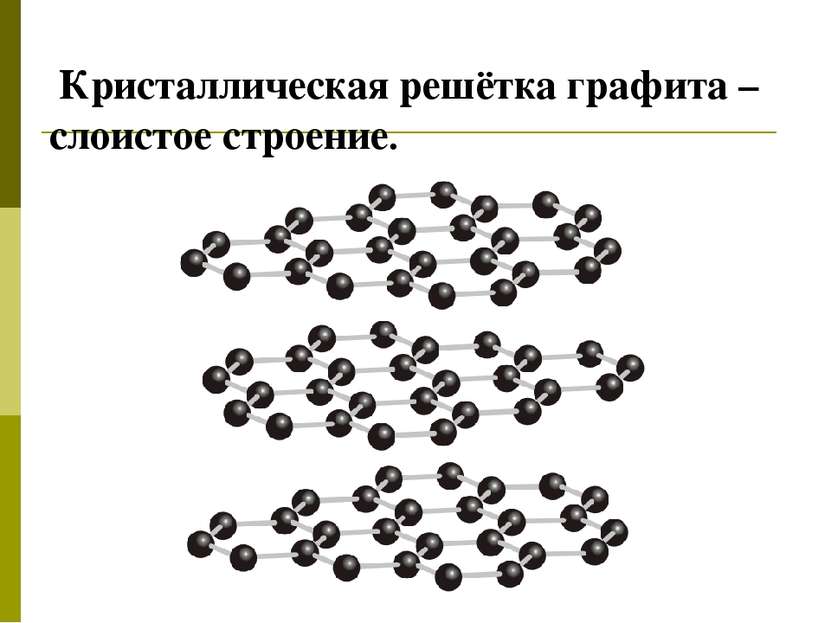
 Типы кристаллических решеток Молекулярная В узлах находятся молекулы. Силы притяжения слабые. Вещества непрочные, легкоплавкие, летучие. Газы и жидкости в твердом состоянии, сера, иод, нафталин, белый фосфор, углекислый газ(«сухой лёд»), органические вещества Атомная В узлах находятся атомы. Силы притяжения сильные. Вещества прочные, тугоплавкие, нелетучие, не проводят электрический ток ( кроме графита) Алмаз, кремний кристаллический, бор, оксид кремния( кремнезем)
Типы кристаллических решеток Молекулярная В узлах находятся молекулы. Силы притяжения слабые. Вещества непрочные, легкоплавкие, летучие. Газы и жидкости в твердом состоянии, сера, иод, нафталин, белый фосфор, углекислый газ(«сухой лёд»), органические вещества Атомная В узлах находятся атомы. Силы притяжения сильные. Вещества прочные, тугоплавкие, нелетучие, не проводят электрический ток ( кроме графита) Алмаз, кремний кристаллический, бор, оксид кремния( кремнезем)
Cлайд 14
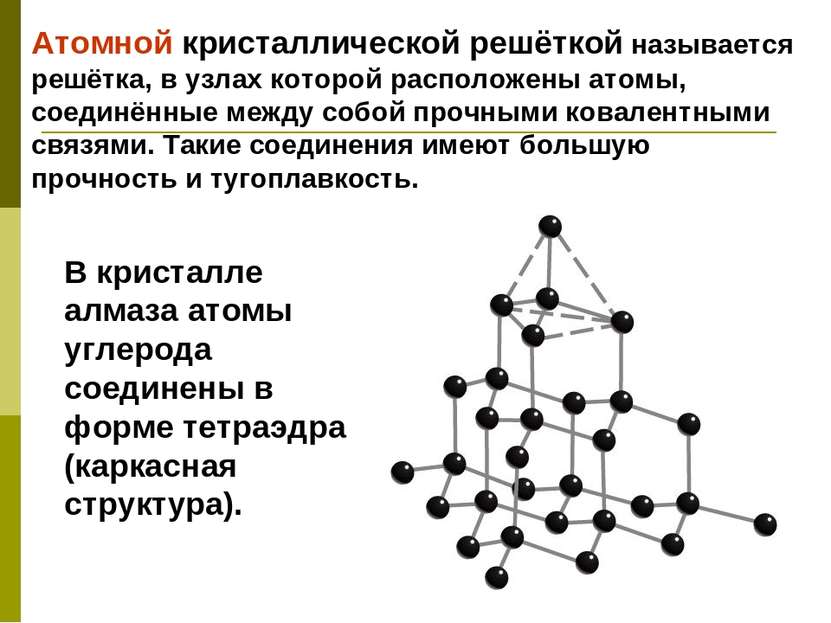
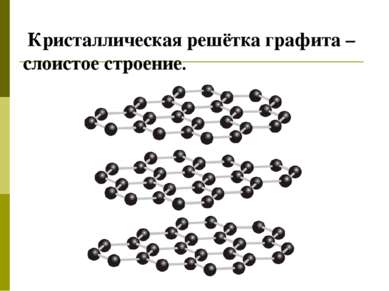
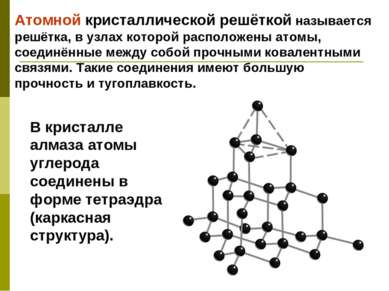 Атомной кристаллической решёткой называется решётка, в узлах которой расположены атомы, соединённые между собой прочными ковалентными связями. Такие соединения имеют большую прочность и тугоплавкость. В кристалле алмаза атомы углерода соединены в форме тетраэдра (каркасная структура).
Атомной кристаллической решёткой называется решётка, в узлах которой расположены атомы, соединённые между собой прочными ковалентными связями. Такие соединения имеют большую прочность и тугоплавкость. В кристалле алмаза атомы углерода соединены в форме тетраэдра (каркасная структура).
Cлайд 17
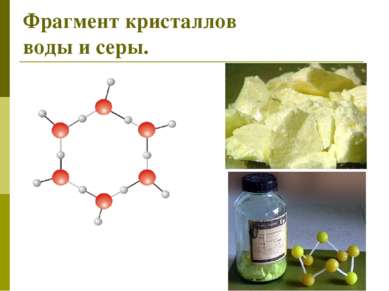
 Молекулярной кристаллической решёткой называется решётка, в узлах которой расположены молекулы, удерживаемые силами межмолекулярного взаимодействия . Такие соединения легко плавятся. При н.у. часто являются газами или подвижными жидкостями.
Молекулярной кристаллической решёткой называется решётка, в узлах которой расположены молекулы, удерживаемые силами межмолекулярного взаимодействия . Такие соединения легко плавятся. При н.у. часто являются газами или подвижными жидкостями.
Cлайд 21
 Домашнее задание Габриелян химия 11 базовый уровень § 4 стр.37 вопросы 1. 2, 3,6, 7,8 Габриелян , Лысова Химия 11 § 6 стр. 46 – 51 стр. 56 вопросы 3,4,5 Составьте формулу ионного фторида и молекулярного оксида с наименьшей молекулярной массой. Рассчитайте массовые доли фтора и кислорода в этих соединениях
Домашнее задание Габриелян химия 11 базовый уровень § 4 стр.37 вопросы 1. 2, 3,6, 7,8 Габриелян , Лысова Химия 11 § 6 стр. 46 – 51 стр. 56 вопросы 3,4,5 Составьте формулу ионного фторида и молекулярного оксида с наименьшей молекулярной массой. Рассчитайте массовые доли фтора и кислорода в этих соединениях