X
Код презентации скопируйте его
Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения
Скачать эту презентациюПрезентация на тему Нуклеофильное присоединение к кратным связям углерод-гетероатом. Карбонильные соединения
Скачать эту презентациюCлайд 1
 Нуклеофильное присоединение к кратным связям углерод-гетероатом Карбонильные соединения Лекция 8
Нуклеофильное присоединение к кратным связям углерод-гетероатом Карбонильные соединения Лекция 8
Cлайд 2
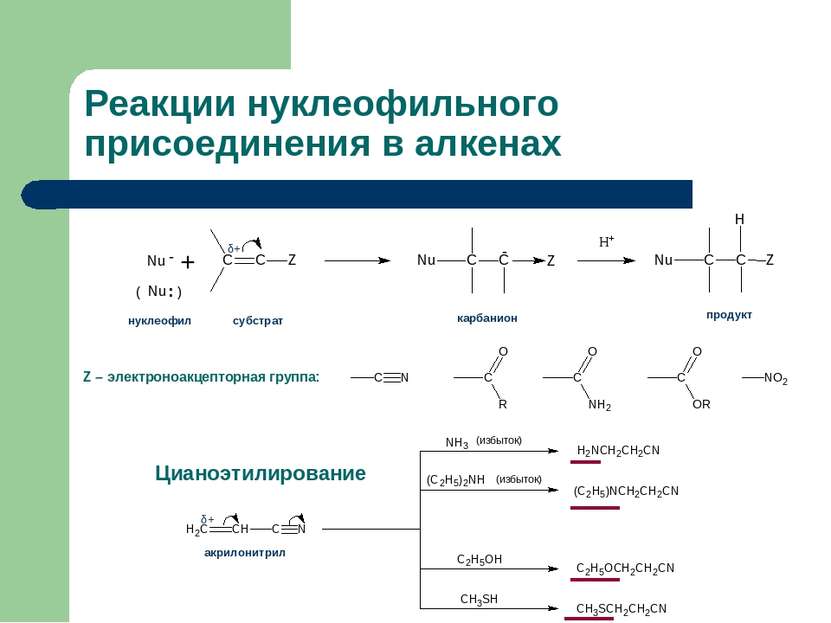
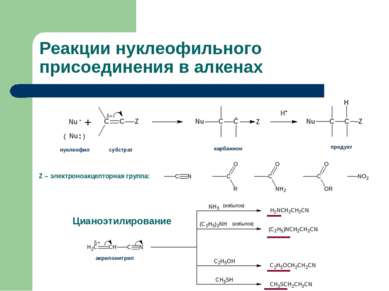 Реакции нуклеофильного присоединения в алкенах Z – электроноакцепторная группа: акрилонитрил δ+ (избыток) (избыток) Цианоэтилирование
Реакции нуклеофильного присоединения в алкенах Z – электроноакцепторная группа: акрилонитрил δ+ (избыток) (избыток) Цианоэтилирование
Cлайд 4
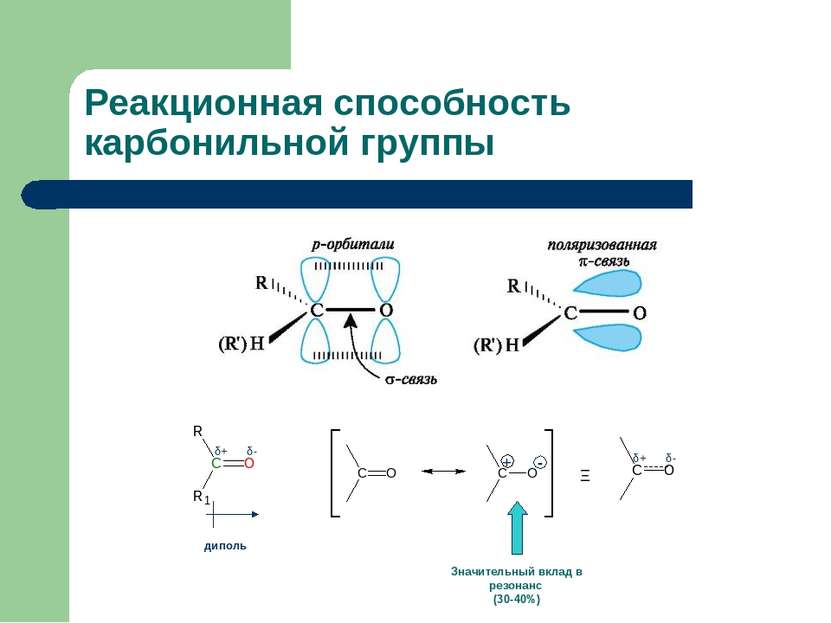
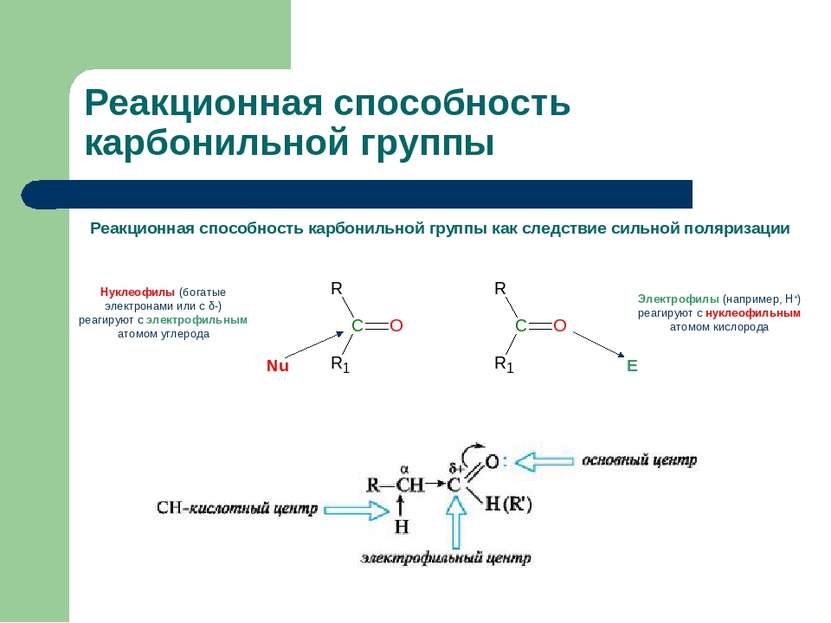
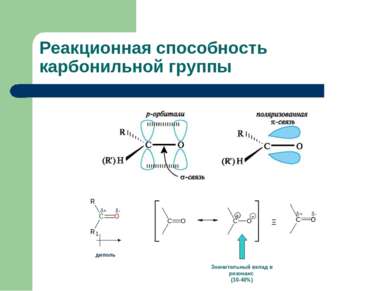
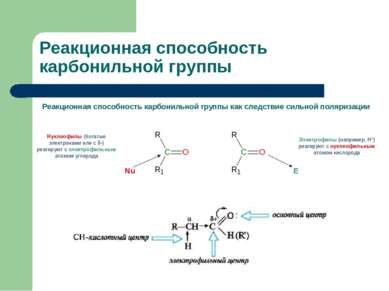 Реакционная способность карбонильной группы Реакционная способность карбонильной группы как следствие сильной поляризации
Реакционная способность карбонильной группы Реакционная способность карбонильной группы как следствие сильной поляризации
Cлайд 5
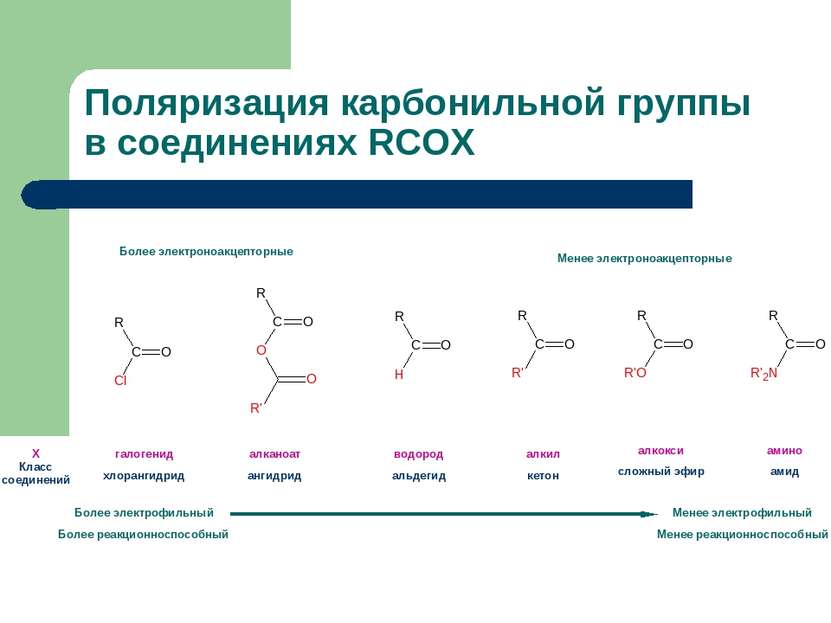
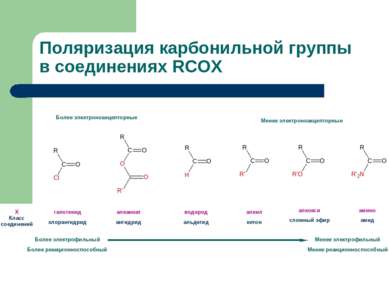 Поляризация карбонильной группы в соединениях RCOX Х Класс соединений Более электрофильный Более реакционноспособный Менее электрофильный Менее реакционноспособный Более электроноакцепторные Менее электроноакцепторные
Поляризация карбонильной группы в соединениях RCOX Х Класс соединений Более электрофильный Более реакционноспособный Менее электрофильный Менее реакционноспособный Более электроноакцепторные Менее электроноакцепторные
Cлайд 6
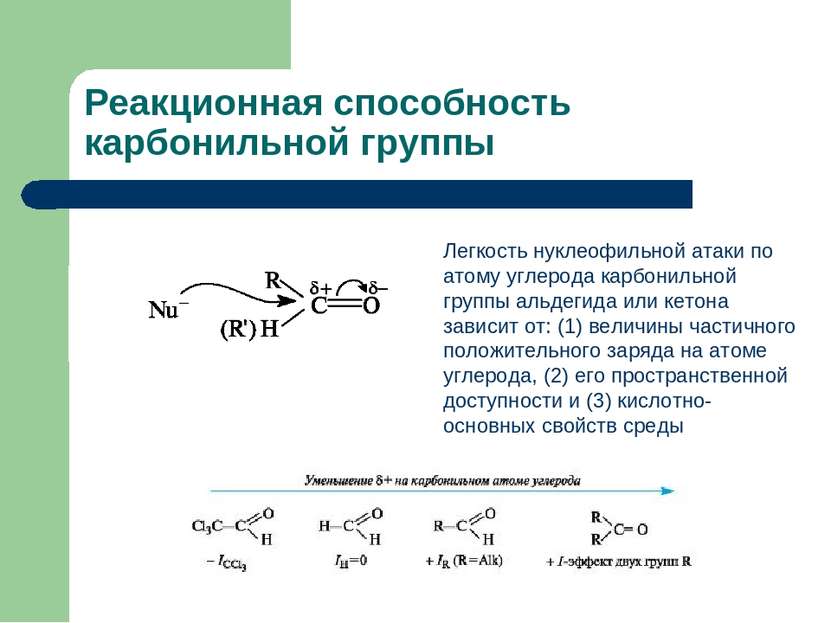
 Реакционная способность карбонильной группы Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от: (1) величины частичного положительного заряда на атоме углерода, (2) его пространственной доступности и (3) кислотно-основных свойств среды
Реакционная способность карбонильной группы Легкость нуклеофильной атаки по атому углерода карбонильной группы альдегида или кетона зависит от: (1) величины частичного положительного заряда на атоме углерода, (2) его пространственной доступности и (3) кислотно-основных свойств среды
Cлайд 7
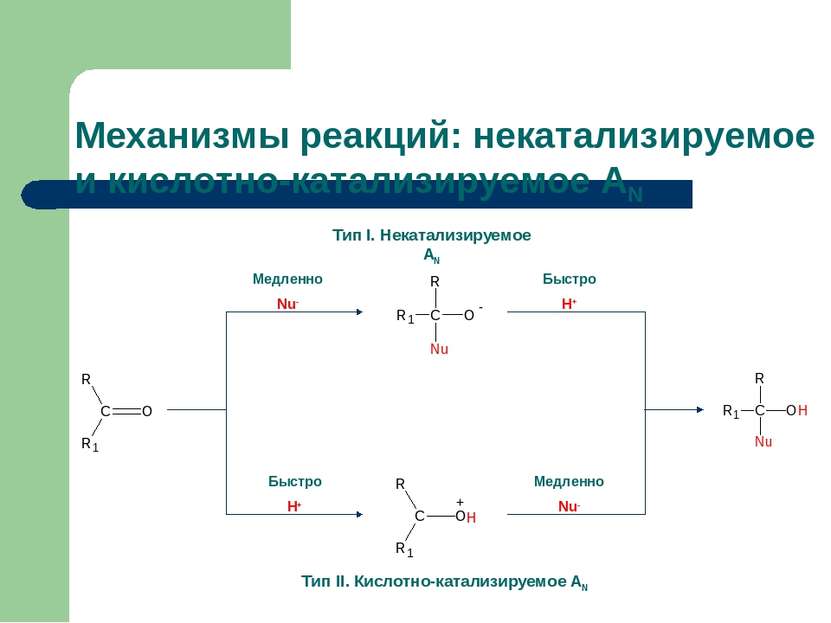
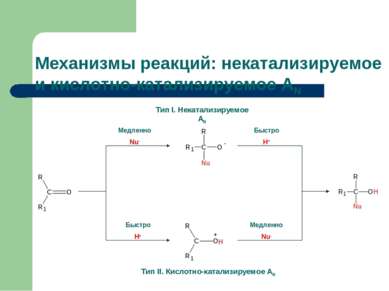 Механизмы реакций: некатализируемое и кислотно-катализируемое AN Тип I. Некатализируемое АN Тип II. Кислотно-катализируемое АN
Механизмы реакций: некатализируемое и кислотно-катализируемое AN Тип I. Некатализируемое АN Тип II. Кислотно-катализируемое АN
Cлайд 8
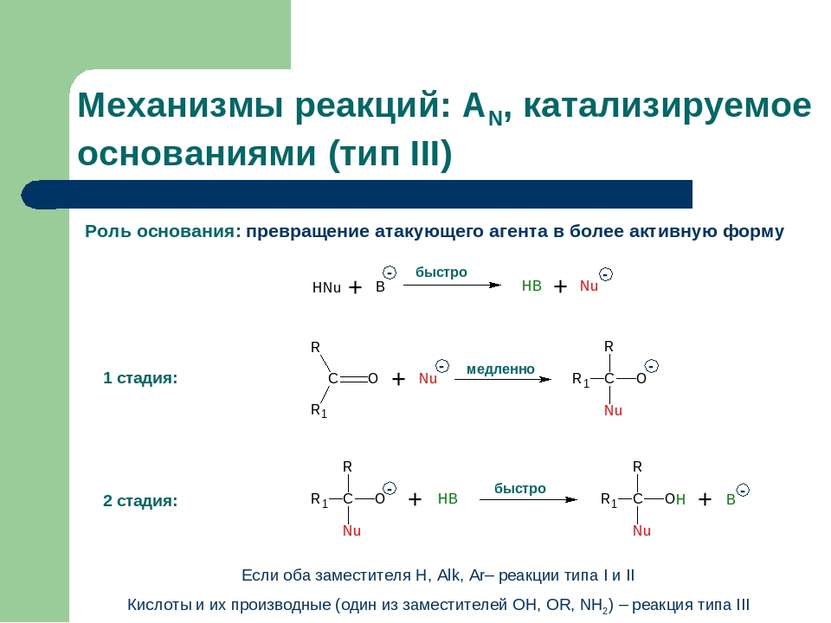
 Роль основания: превращение атакующего агента в более активную форму Механизмы реакций: AN, катализируемое основаниями (тип III) Если оба заместителя Н, Alk, Ar– реакции типа I и II Кислоты и их производные (один из заместителей OH, OR, NH2) – реакция типа III
Роль основания: превращение атакующего агента в более активную форму Механизмы реакций: AN, катализируемое основаниями (тип III) Если оба заместителя Н, Alk, Ar– реакции типа I и II Кислоты и их производные (один из заместителей OH, OR, NH2) – реакция типа III
Cлайд 9
 Промежуточные выводы Электронная плотность на карбонильном углероде выше в переходном состоянии, чем в исходном. В исходном состоянии карбонильный углерод окружен тремя лигандами, в переходном – четырьмя, т.е. переходное состояние более пространственно затруднено, чем исходное. Электронодонорные эффекты (+I, +M) – снижение реакционной способности субстрата. Электроноакцепторные эффекты (-I, -M) – повышение реакционной способности субстрата
Промежуточные выводы Электронная плотность на карбонильном углероде выше в переходном состоянии, чем в исходном. В исходном состоянии карбонильный углерод окружен тремя лигандами, в переходном – четырьмя, т.е. переходное состояние более пространственно затруднено, чем исходное. Электронодонорные эффекты (+I, +M) – снижение реакционной способности субстрата. Электроноакцепторные эффекты (-I, -M) – повышение реакционной способности субстрата
Cлайд 10
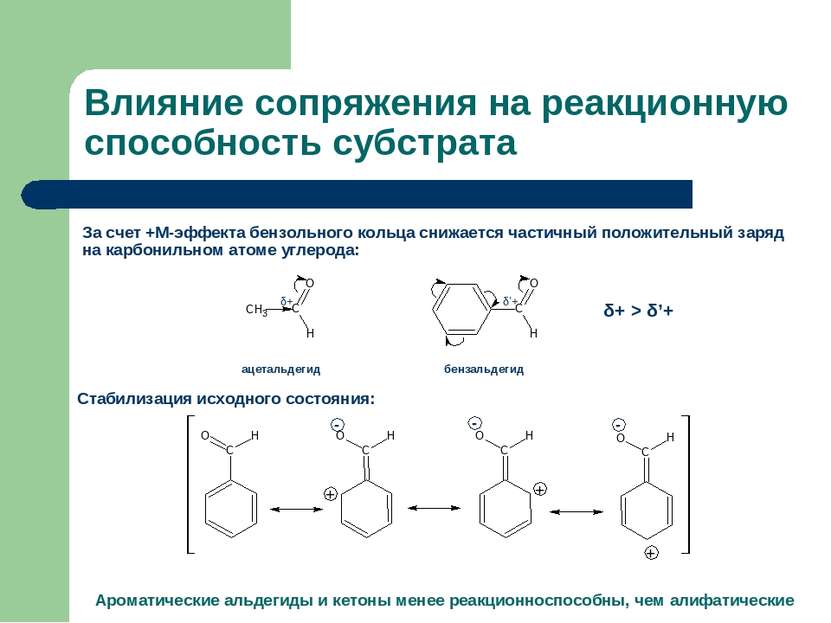
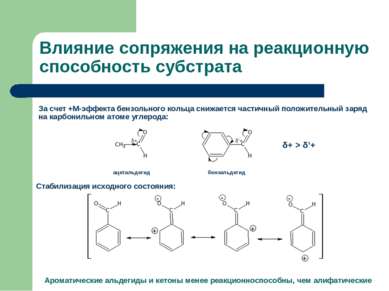 Влияние сопряжения на реакционную способность субстрата За счет +М-эффекта бензольного кольца снижается частичный положительный заряд на карбонильном атоме углерода: ацетальдегид бензальдегид Стабилизация исходного состояния: Ароматические альдегиды и кетоны менее реакционноспособны, чем алифатические
Влияние сопряжения на реакционную способность субстрата За счет +М-эффекта бензольного кольца снижается частичный положительный заряд на карбонильном атоме углерода: ацетальдегид бензальдегид Стабилизация исходного состояния: Ароматические альдегиды и кетоны менее реакционноспособны, чем алифатические
Cлайд 11
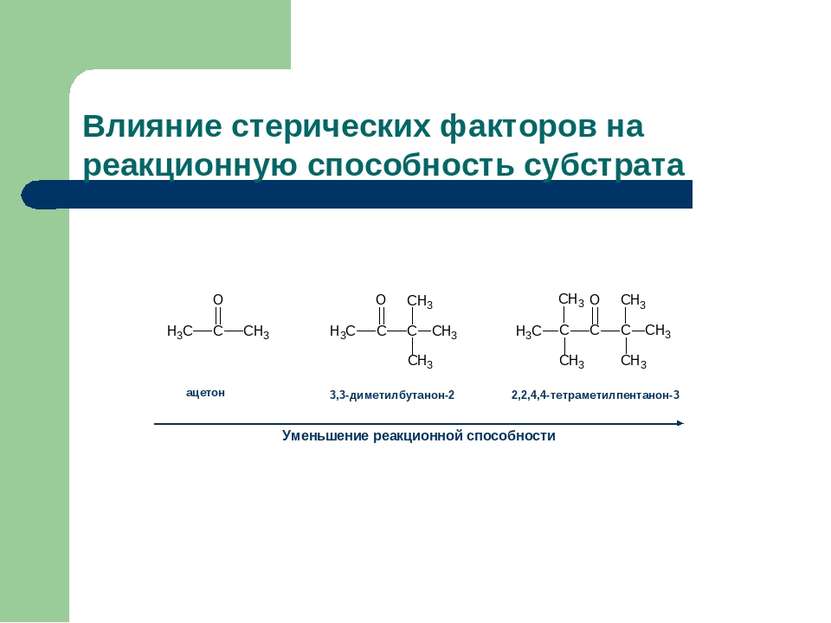
 Влияние стерических факторов на реакционную способность субстрата Уменьшение реакционной способности 2,2,4,4-тетраметилпентанон-3 3,3-диметилбутанон-2 ацетон
Влияние стерических факторов на реакционную способность субстрата Уменьшение реакционной способности 2,2,4,4-тетраметилпентанон-3 3,3-диметилбутанон-2 ацетон
Cлайд 12
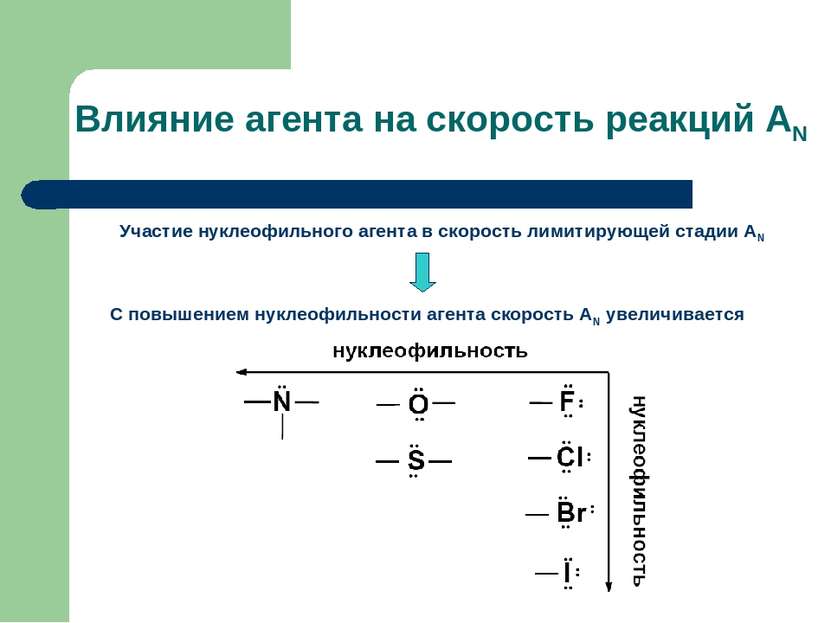
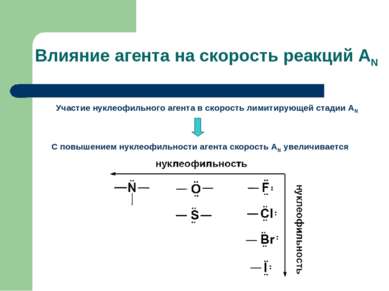 Влияние агента на скорость реакций АN Участие нуклеофильного агента в скорость лимитирующей стадии АN С повышением нуклеофильности агента скорость АN увеличивается
Влияние агента на скорость реакций АN Участие нуклеофильного агента в скорость лимитирующей стадии АN С повышением нуклеофильности агента скорость АN увеличивается
Cлайд 14
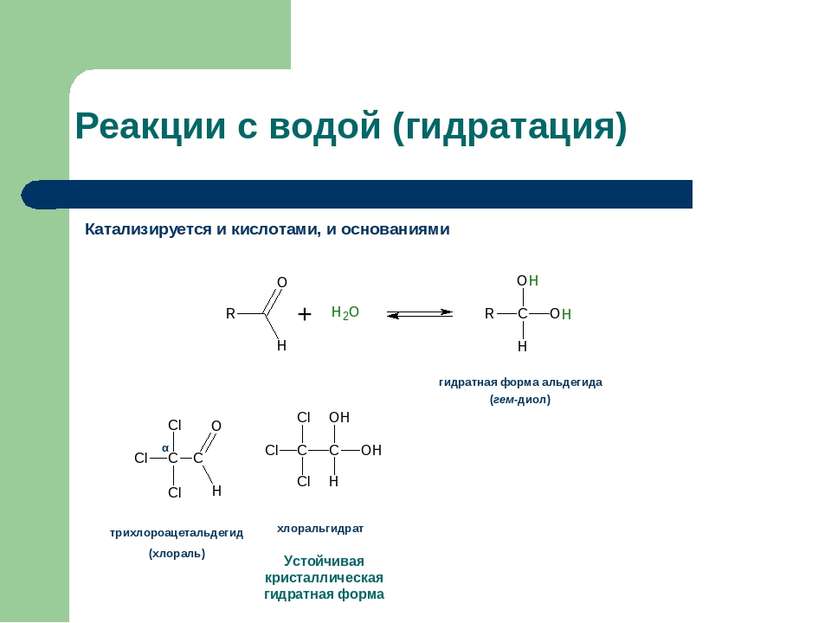
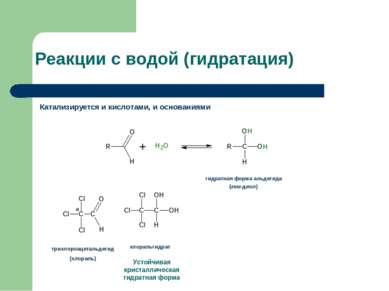 Реакции с водой (гидратация) Катализируется и кислотами, и основаниями гидратная форма альдегида (гем-диол)
Реакции с водой (гидратация) Катализируется и кислотами, и основаниями гидратная форма альдегида (гем-диол)
Cлайд 16
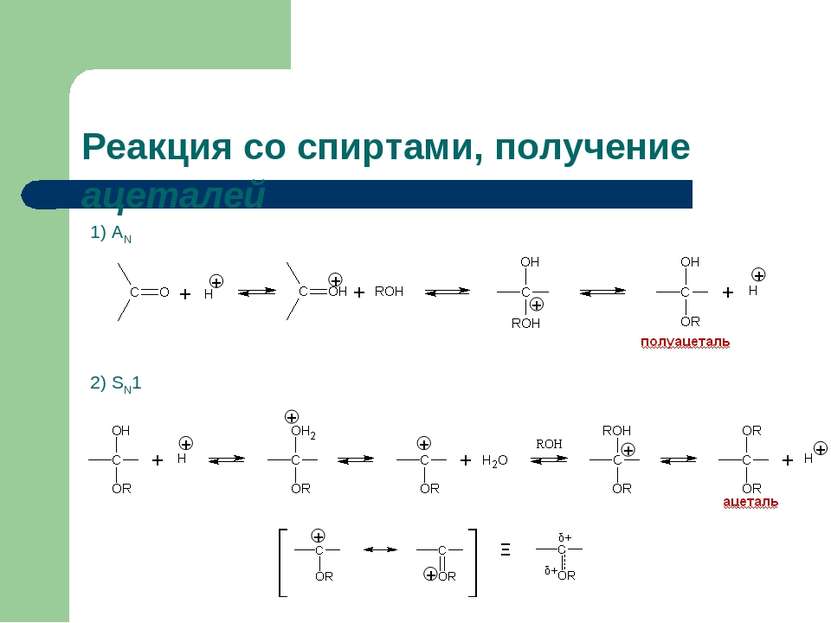
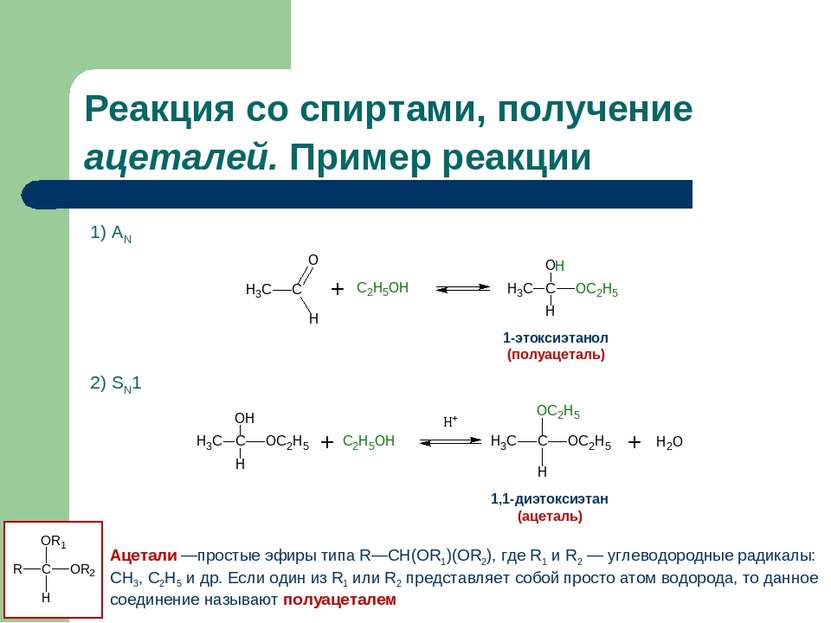
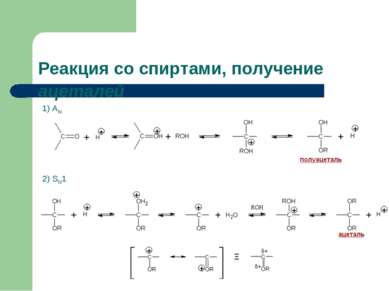
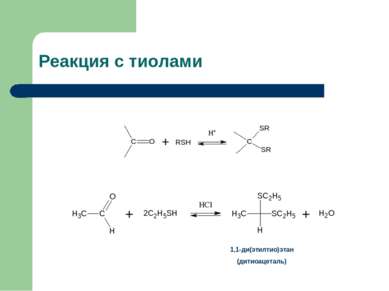
 Реакция со спиртами, получение ацеталей. Пример реакции 1) АN 2) SN1 1-этоксиэтанол (полуацеталь) 1,1-диэтоксиэтан (ацеталь) Ацетали —простые эфиры типа R—CH(OR1)(OR2), где R1 и R2 — углеводородные радикалы: CH3, C2H5 и др. Если один из R1 или R2 представляет собой просто атом водорода, то данное соединение называют полуацеталем
Реакция со спиртами, получение ацеталей. Пример реакции 1) АN 2) SN1 1-этоксиэтанол (полуацеталь) 1,1-диэтоксиэтан (ацеталь) Ацетали —простые эфиры типа R—CH(OR1)(OR2), где R1 и R2 — углеводородные радикалы: CH3, C2H5 и др. Если один из R1 или R2 представляет собой просто атом водорода, то данное соединение называют полуацеталем
Cлайд 17
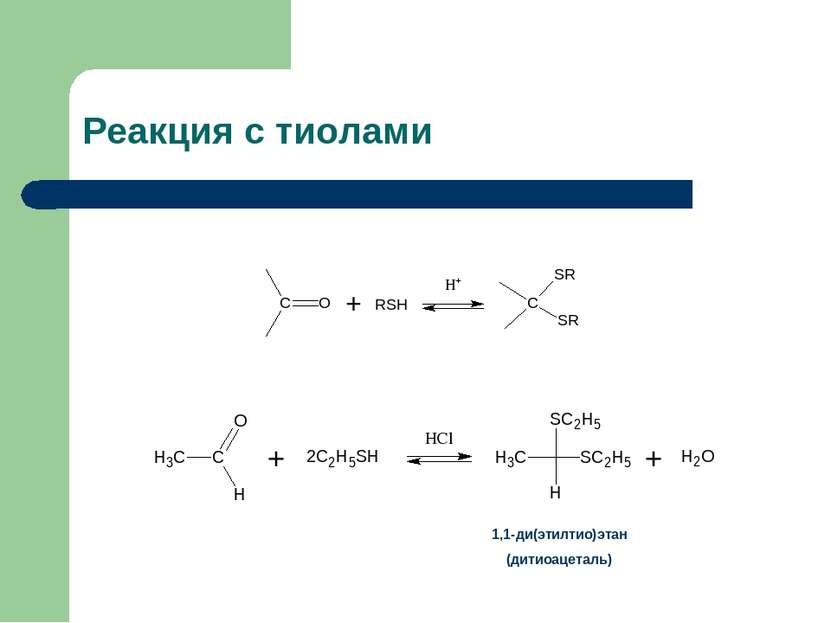
 Промежуточные выводы Взаимодействие карбонильных соединений со спиртами в безводных условиях в присутствии кислот и при удалении образующейся в реакции воды приводит к образованию ацеталей Взаимодействие ацеталей с водными растворами кислот приводит к гидролизу ацеталей Устойчивость ацеталей в щелочных средах
Промежуточные выводы Взаимодействие карбонильных соединений со спиртами в безводных условиях в присутствии кислот и при удалении образующейся в реакции воды приводит к образованию ацеталей Взаимодействие ацеталей с водными растворами кислот приводит к гидролизу ацеталей Устойчивость ацеталей в щелочных средах
Cлайд 20
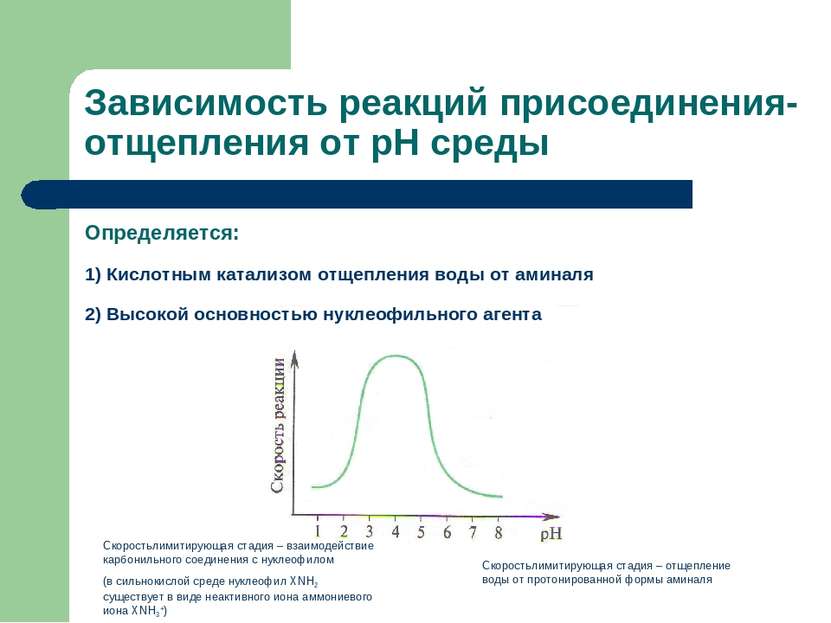
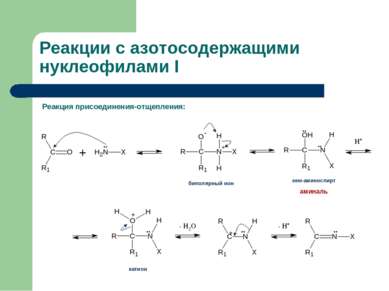
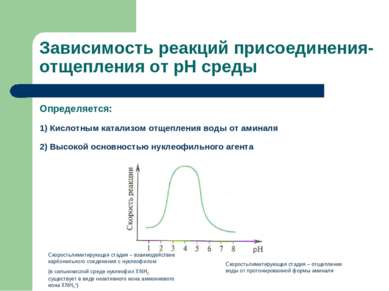 Зависимость реакций присоединения-отщепления от рН среды Определяется: 1) Кислотным катализом отщепления воды от аминаля 2) Высокой основностью нуклеофильного агента Скоростьлимитирующая стадия – отщепление воды от протонированной формы аминаля Скоростьлимитирующая стадия – взаимодействие карбонильного соединения с нуклеофилом (в сильнокислой среде нуклеофил XNH2 существует в виде неактивного иона аммониевого иона ХNH3+)
Зависимость реакций присоединения-отщепления от рН среды Определяется: 1) Кислотным катализом отщепления воды от аминаля 2) Высокой основностью нуклеофильного агента Скоростьлимитирующая стадия – отщепление воды от протонированной формы аминаля Скоростьлимитирующая стадия – взаимодействие карбонильного соединения с нуклеофилом (в сильнокислой среде нуклеофил XNH2 существует в виде неактивного иона аммониевого иона ХNH3+)
Cлайд 21
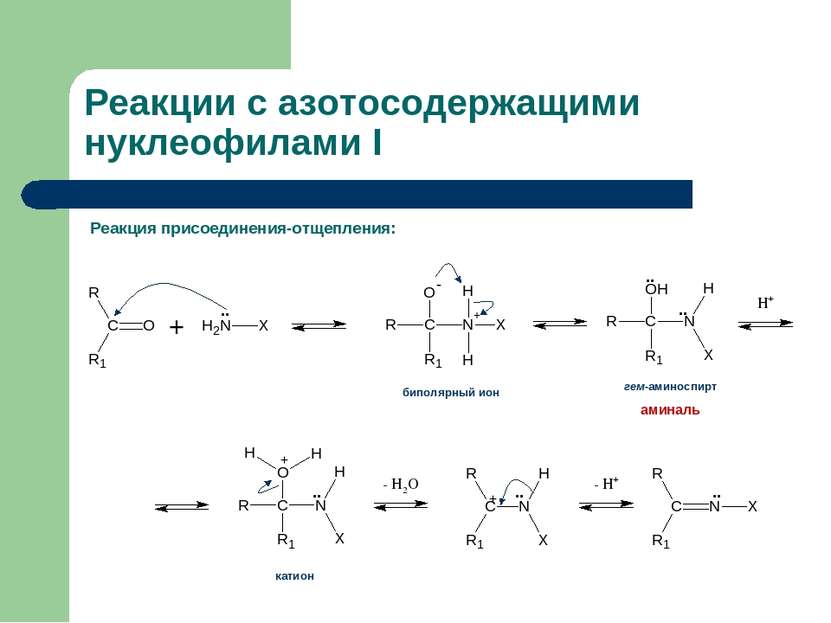
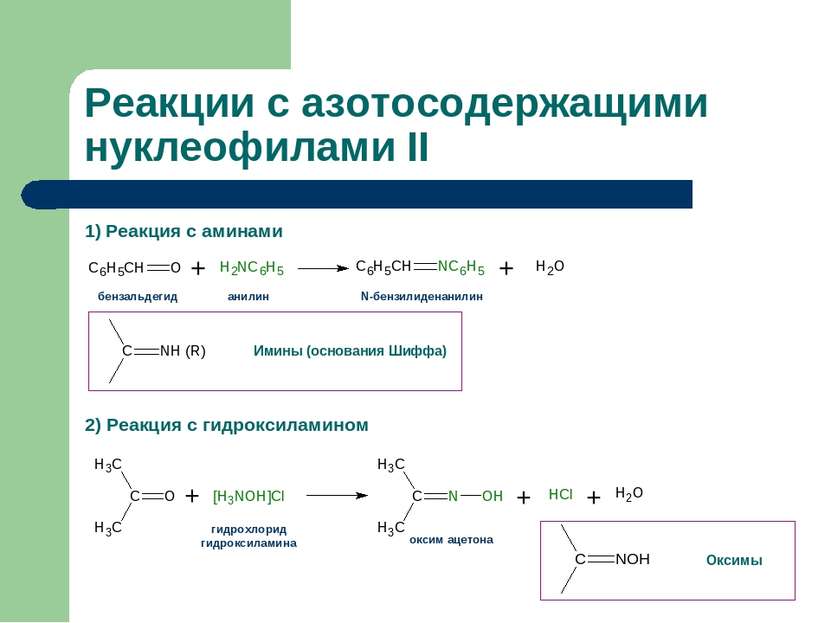
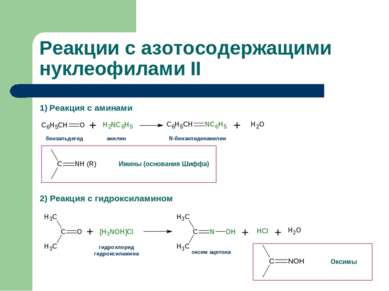 1) Реакция с аминами 2) Реакция с гидроксиламином Реакции с азотосодержащими нуклеофилами II оксим ацетона гидрохлорид гидроксиламина
1) Реакция с аминами 2) Реакция с гидроксиламином Реакции с азотосодержащими нуклеофилами II оксим ацетона гидрохлорид гидроксиламина
Cлайд 22
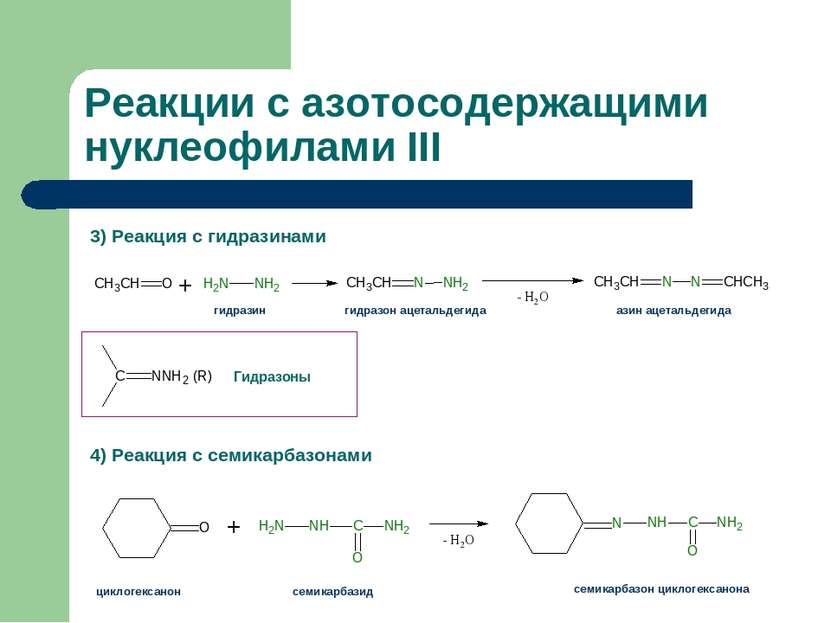
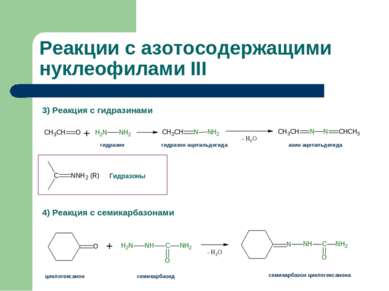 Реакции с азотосодержащими нуклеофилами III 3) Реакция с гидразинами 4) Реакция с семикарбазонами гидразин гидразон ацетальдегида азин ацетальдегида циклогексанон семикарбазид семикарбазон циклогексанона
Реакции с азотосодержащими нуклеофилами III 3) Реакция с гидразинами 4) Реакция с семикарбазонами гидразин гидразон ацетальдегида азин ацетальдегида циклогексанон семикарбазид семикарбазон циклогексанона
Cлайд 23
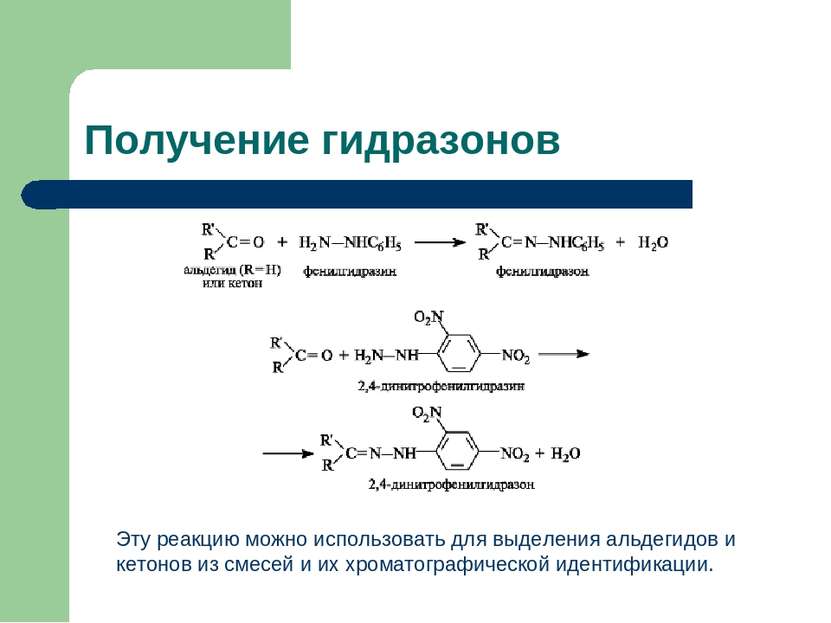
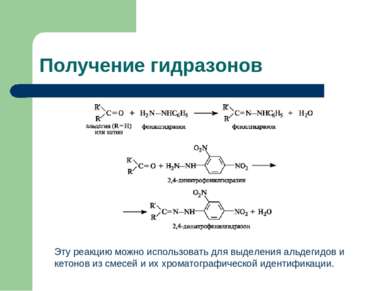 Получение гидразонов Эту реакцию можно использовать для выделения альдегидов и кетонов из смесей и их хроматографической идентификации.
Получение гидразонов Эту реакцию можно использовать для выделения альдегидов и кетонов из смесей и их хроматографической идентификации.
Cлайд 25
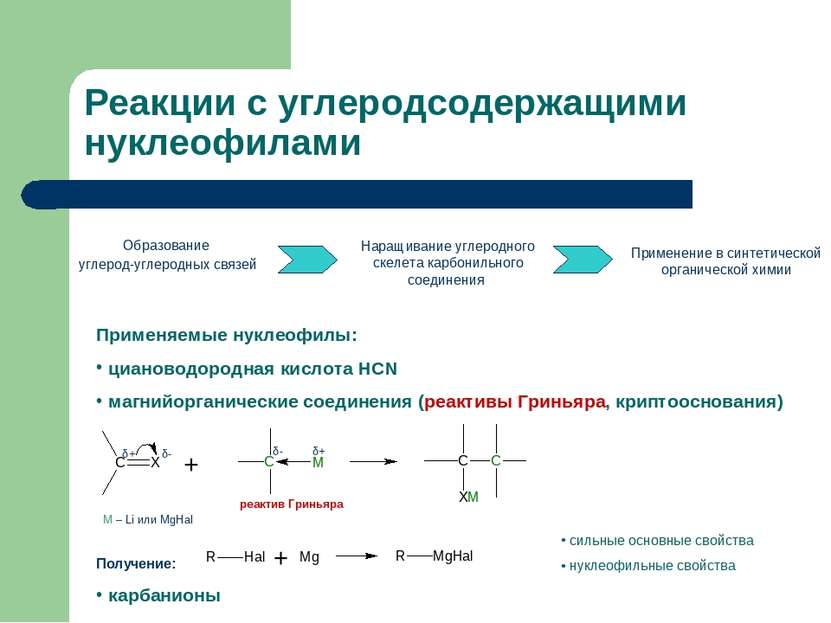
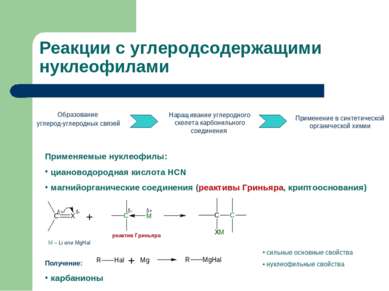 Реакции с углеродсодержащими нуклеофилами Образование углерод-углеродных связей Наращивание углеродного скелета карбонильного соединения Применение в синтетической органической химии Применяемые нуклеофилы: циановодородная кислота HCN магнийорганические соединения (реактивы Гриньяра, криптооснования) Получение: карбанионы сильные основные свойства нуклеофильные свойства реактив Гриньяра
Реакции с углеродсодержащими нуклеофилами Образование углерод-углеродных связей Наращивание углеродного скелета карбонильного соединения Применение в синтетической органической химии Применяемые нуклеофилы: циановодородная кислота HCN магнийорганические соединения (реактивы Гриньяра, криптооснования) Получение: карбанионы сильные основные свойства нуклеофильные свойства реактив Гриньяра
Cлайд 26
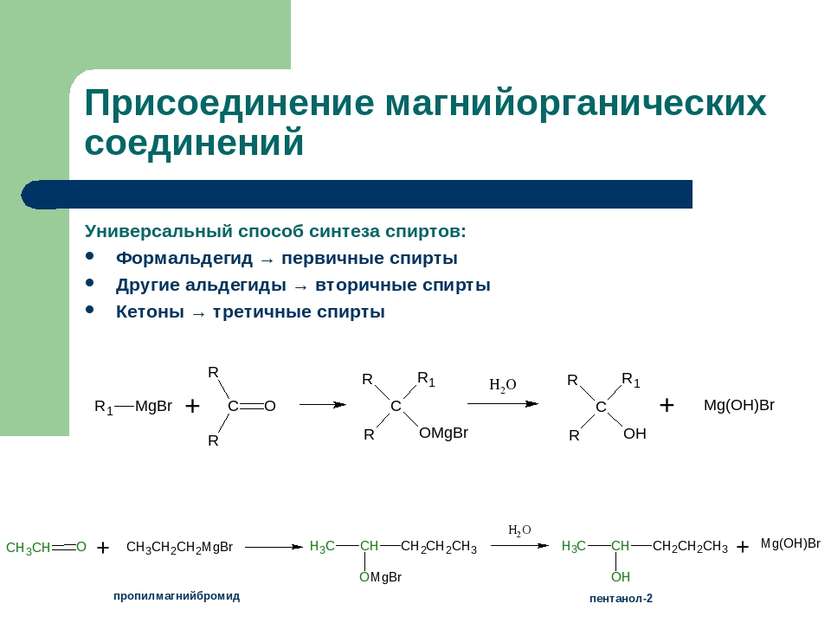
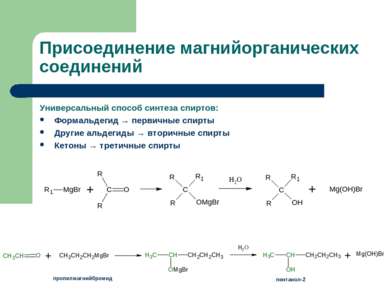 Присоединение магнийорганических соединений Универсальный способ синтеза спиртов: Формальдегид → первичные спирты Другие альдегиды → вторичные спирты Кетоны → третичные спирты пропилмагнийбромид пентанол-2
Присоединение магнийорганических соединений Универсальный способ синтеза спиртов: Формальдегид → первичные спирты Другие альдегиды → вторичные спирты Кетоны → третичные спирты пропилмагнийбромид пентанол-2
Cлайд 27
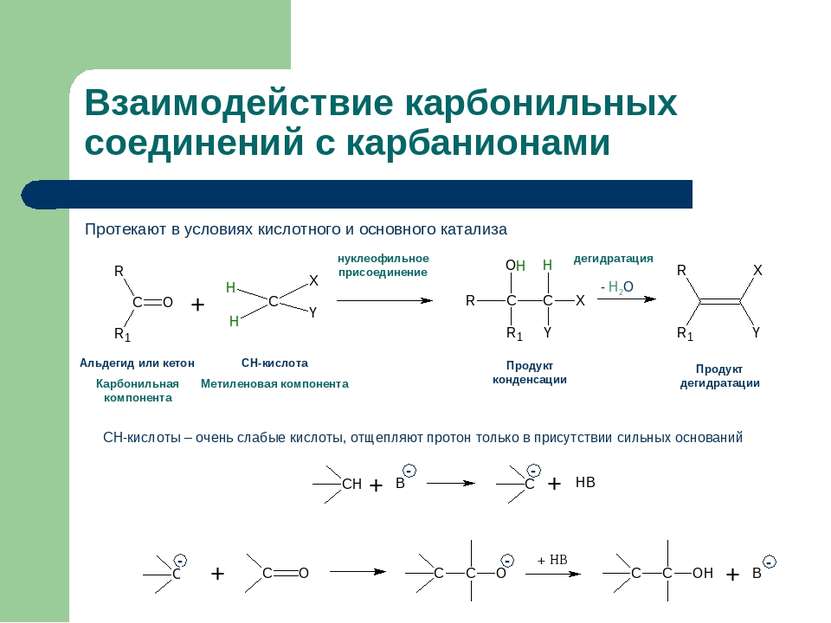
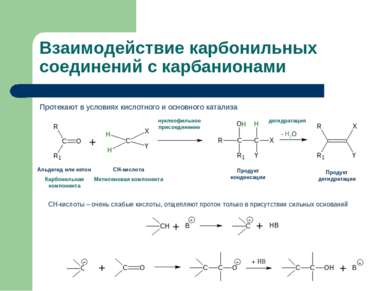 Взаимодействие карбонильных соединений с карбанионами Протекают в условиях кислотного и основного катализа Альдегид или кетон Карбонильная компонента СН-кислота Метиленовая компонента Продукт конденсации Продукт дегидратации - Н2О нуклеофильное присоединение дегидратация СН-кислоты – очень слабые кислоты, отщепляют протон только в присутствии сильных оснований
Взаимодействие карбонильных соединений с карбанионами Протекают в условиях кислотного и основного катализа Альдегид или кетон Карбонильная компонента СН-кислота Метиленовая компонента Продукт конденсации Продукт дегидратации - Н2О нуклеофильное присоединение дегидратация СН-кислоты – очень слабые кислоты, отщепляют протон только в присутствии сильных оснований
Cлайд 28
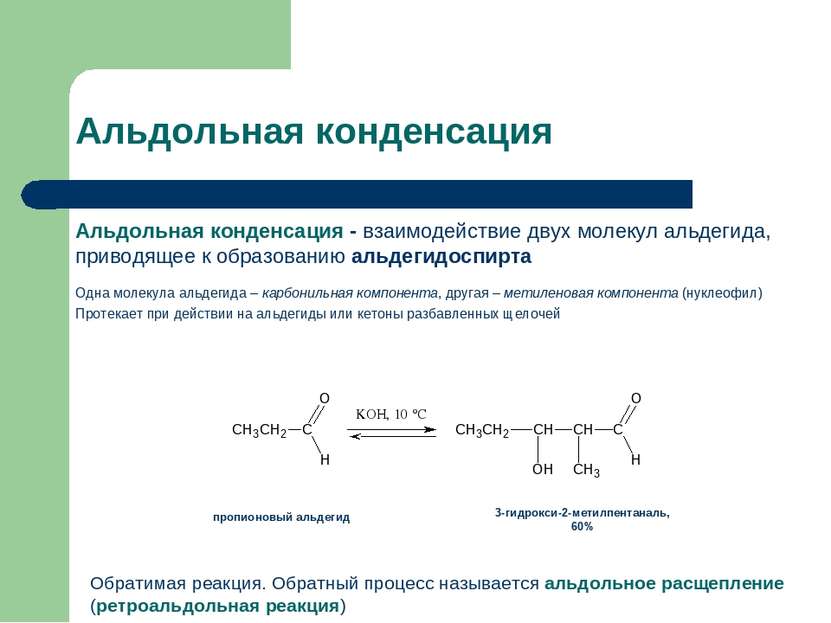
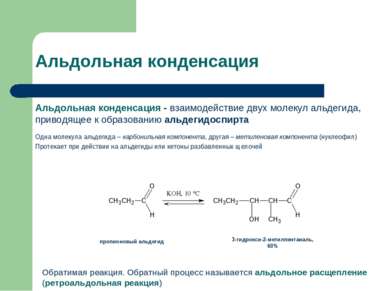 Альдольная конденсация Альдольная конденсация - взаимодействие двух молекул альдегида, приводящее к образованию альдегидоспирта Одна молекула альдегида – карбонильная компонента, другая – метиленовая компонента (нуклеофил) Протекает при действии на альдегиды или кетоны разбавленных щелочей 3-гидрокси-2-метилпентаналь, 60% пропионовый альдегид Обратимая реакция. Обратный процесс называется альдольное расщепление (ретроальдольная реакция)
Альдольная конденсация Альдольная конденсация - взаимодействие двух молекул альдегида, приводящее к образованию альдегидоспирта Одна молекула альдегида – карбонильная компонента, другая – метиленовая компонента (нуклеофил) Протекает при действии на альдегиды или кетоны разбавленных щелочей 3-гидрокси-2-метилпентаналь, 60% пропионовый альдегид Обратимая реакция. Обратный процесс называется альдольное расщепление (ретроальдольная реакция)
Cлайд 29
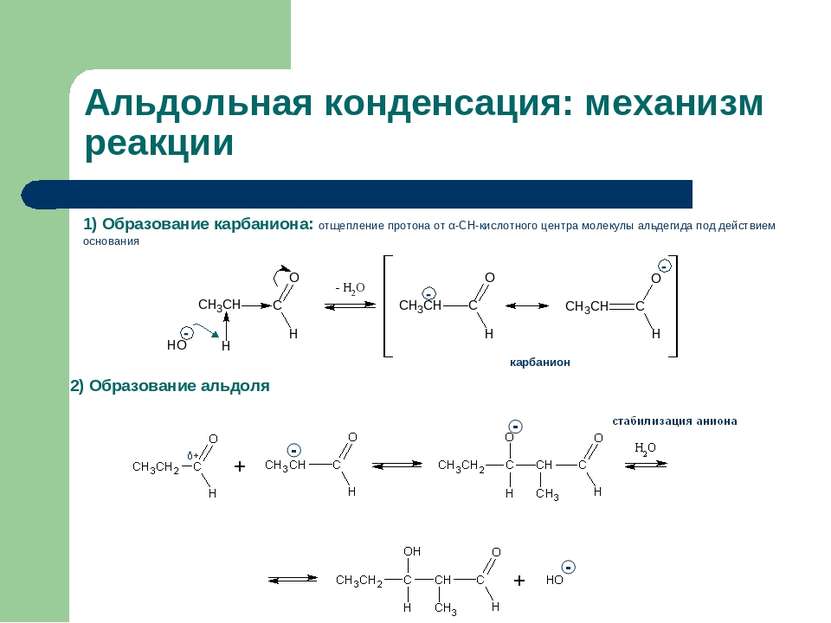
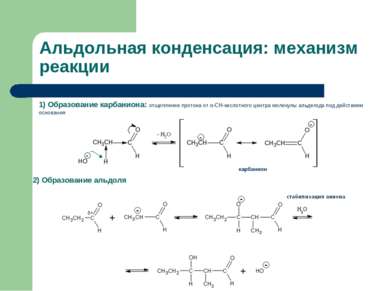 Альдольная конденсация: механизм реакции 1) Образование карбаниона: отщепление протона от α-СН-кислотного центра молекулы альдегида под действием основания 2) Образование альдоля карбанион
Альдольная конденсация: механизм реакции 1) Образование карбаниона: отщепление протона от α-СН-кислотного центра молекулы альдегида под действием основания 2) Образование альдоля карбанион
Cлайд 30
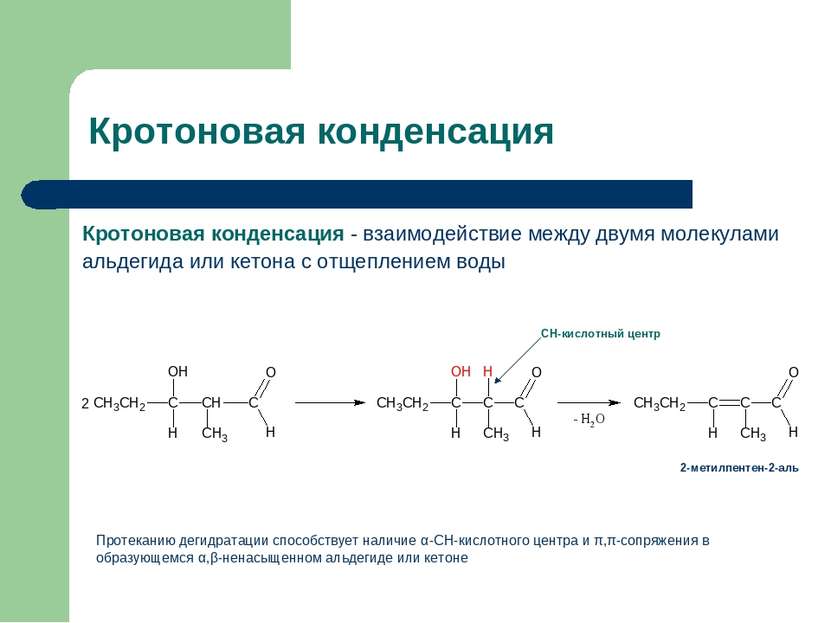
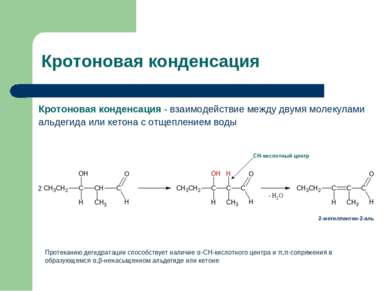 Кротоновая конденсация Кротоновая конденсация - взаимодействие между двумя молекулами альдегида или кетона с отщеплением воды СН-кислотный центр 2-метилпентен-2-аль Протеканию дегидратации способствует наличие α-СН-кислотного центра и π,π-сопряжения в образующемся α,β-ненасыщенном альдегиде или кетоне
Кротоновая конденсация Кротоновая конденсация - взаимодействие между двумя молекулами альдегида или кетона с отщеплением воды СН-кислотный центр 2-метилпентен-2-аль Протеканию дегидратации способствует наличие α-СН-кислотного центра и π,π-сопряжения в образующемся α,β-ненасыщенном альдегиде или кетоне
Cлайд 31
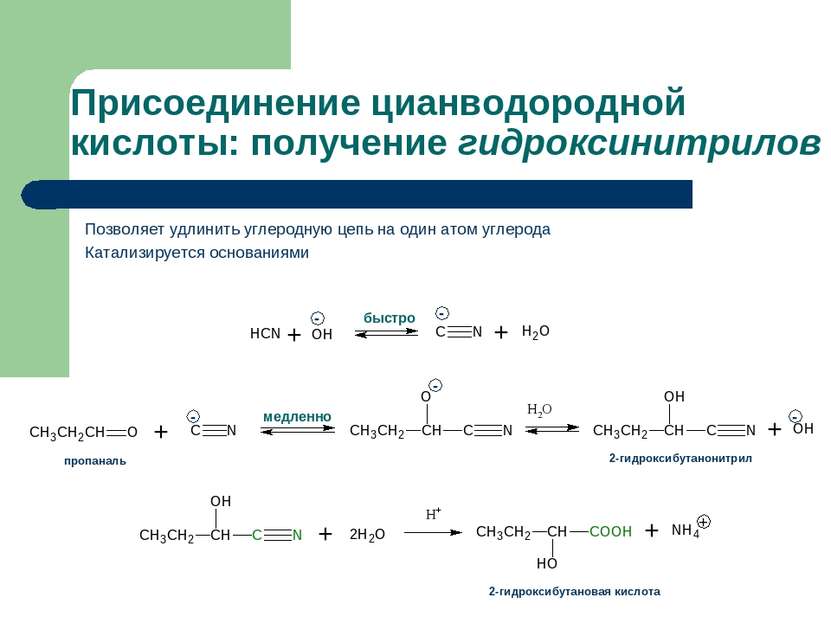
 Присоединение цианводородной кислоты: получение гидроксинитрилов Позволяет удлинить углеродную цепь на один атом углерода Катализируется основаниями
Присоединение цианводородной кислоты: получение гидроксинитрилов Позволяет удлинить углеродную цепь на один атом углерода Катализируется основаниями
Cлайд 33
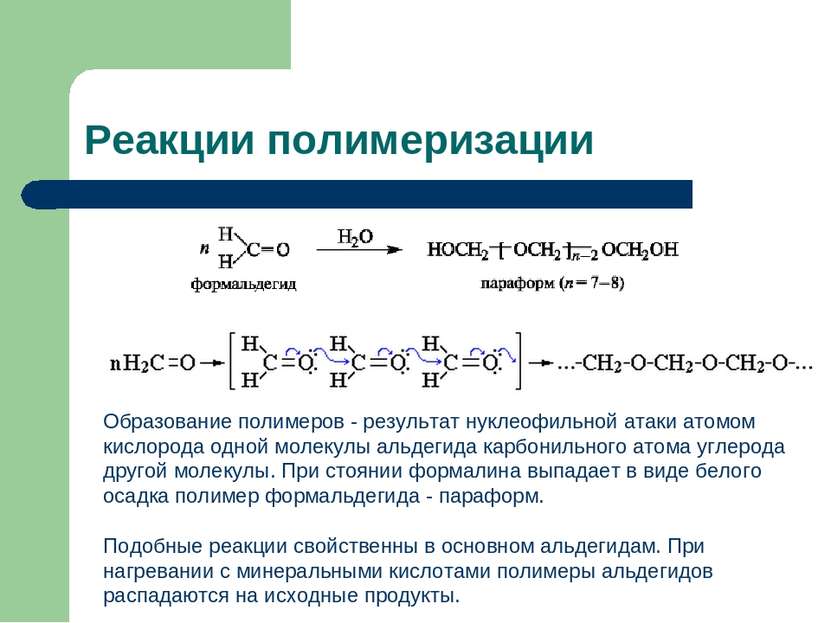
 Реакции полимеризации Образование полимеров - результат нуклеофильной атаки атомом кислорода одной молекулы альдегида карбонильного атома углерода другой молекулы. При стоянии формалина выпадает в виде белого осадка полимер формальдегида - параформ. Подобные реакции свойственны в основном альдегидам. При нагревании с минеральными кислотами полимеры альдегидов распадаются на исходные продукты.
Реакции полимеризации Образование полимеров - результат нуклеофильной атаки атомом кислорода одной молекулы альдегида карбонильного атома углерода другой молекулы. При стоянии формалина выпадает в виде белого осадка полимер формальдегида - параформ. Подобные реакции свойственны в основном альдегидам. При нагревании с минеральными кислотами полимеры альдегидов распадаются на исходные продукты.
Cлайд 34
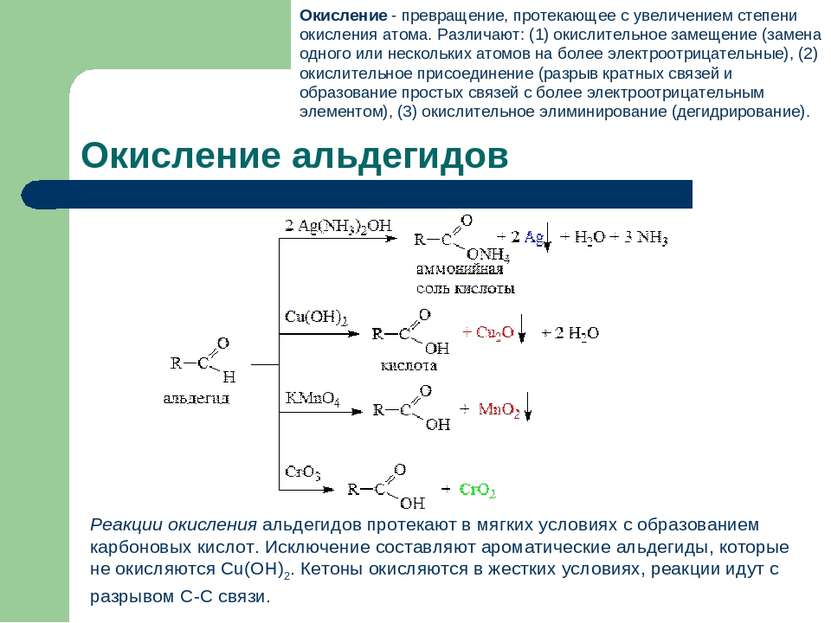
 Окисление альдегидов Реакции окисления альдегидов протекают в мягких условиях с образованием карбоновых кислот. Исключение составляют ароматические альдегиды, которые не окисляются Cu(OH)2. Кетоны окисляются в жестких условиях, реакции идут с разрывом С-С связи. Окисление - превращение, протекающее с увеличением степени окисления атома. Различают: (1) окислительное замещение (замена одного или нескольких атомов на более электроотрицательные), (2) окислительное присоединение (разрыв кратных связей и образование простых связей с более электроотрицательным элементом), (3) окислительное элиминирование (дегидрирование).
Окисление альдегидов Реакции окисления альдегидов протекают в мягких условиях с образованием карбоновых кислот. Исключение составляют ароматические альдегиды, которые не окисляются Cu(OH)2. Кетоны окисляются в жестких условиях, реакции идут с разрывом С-С связи. Окисление - превращение, протекающее с увеличением степени окисления атома. Различают: (1) окислительное замещение (замена одного или нескольких атомов на более электроотрицательные), (2) окислительное присоединение (разрыв кратных связей и образование простых связей с более электроотрицательным элементом), (3) окислительное элиминирование (дегидрирование).
Cлайд 35
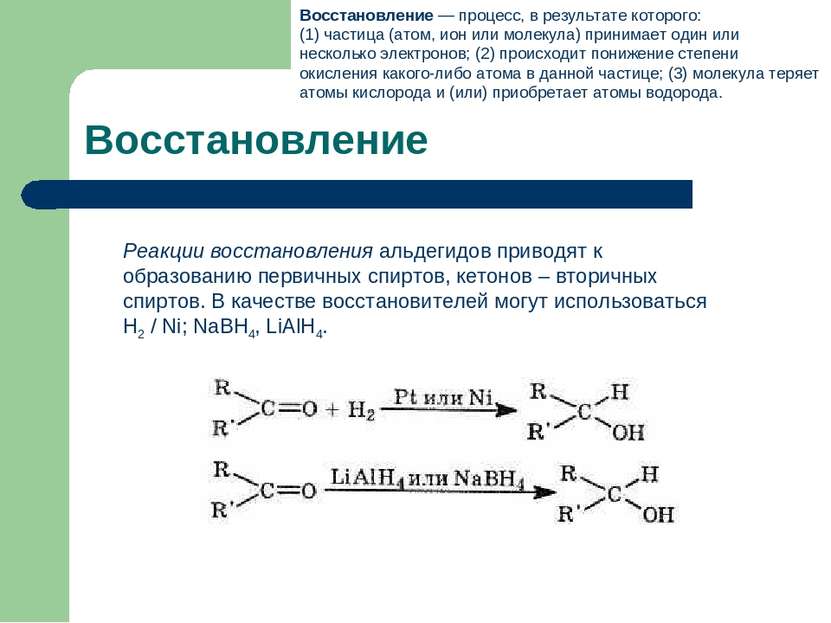
 Восстановление Реакции восстановления альдегидов приводят к образованию первичных спиртов, кетонов – вторичных спиртов. В качестве восстановителей могут использоваться Н2 / Ni; NaBH4, LiAlH4. Восстановление — процесс, в результате которого: (1) частица (атом, ион или молекула) принимает один или несколько электронов; (2) происходит понижение степени окисления какого-либо атома в данной частице; (3) молекула теряет атомы кислорода и (или) приобретает атомы водорода.
Восстановление Реакции восстановления альдегидов приводят к образованию первичных спиртов, кетонов – вторичных спиртов. В качестве восстановителей могут использоваться Н2 / Ni; NaBH4, LiAlH4. Восстановление — процесс, в результате которого: (1) частица (атом, ион или молекула) принимает один или несколько электронов; (2) происходит понижение степени окисления какого-либо атома в данной частице; (3) молекула теряет атомы кислорода и (или) приобретает атомы водорода.
Cлайд 36
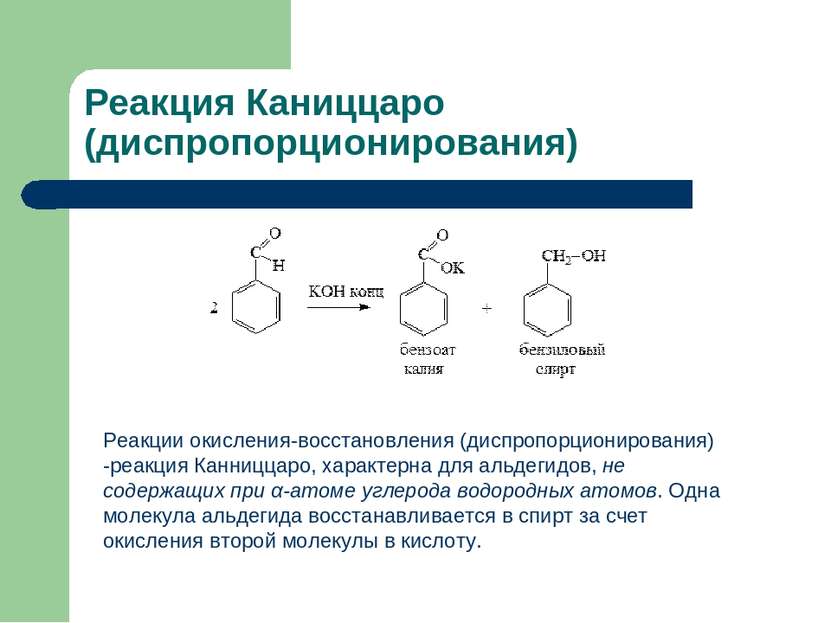
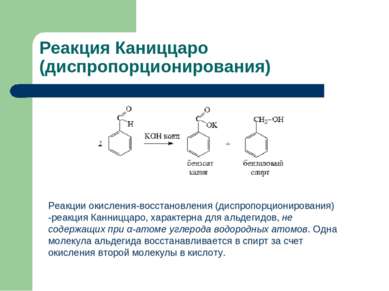 Реакция Каниццаро (диспропорционирования) Реакции окисления-восстановления (диспропорционирования) -реакция Канниццаро, характерна для альдегидов, не содержащих при α-атоме углерода водородных атомов. Одна молекула альдегида восстанавливается в спирт за счет окисления второй молекулы в кислоту.
Реакция Каниццаро (диспропорционирования) Реакции окисления-восстановления (диспропорционирования) -реакция Канниццаро, характерна для альдегидов, не содержащих при α-атоме углерода водородных атомов. Одна молекула альдегида восстанавливается в спирт за счет окисления второй молекулы в кислоту.
Cлайд 37
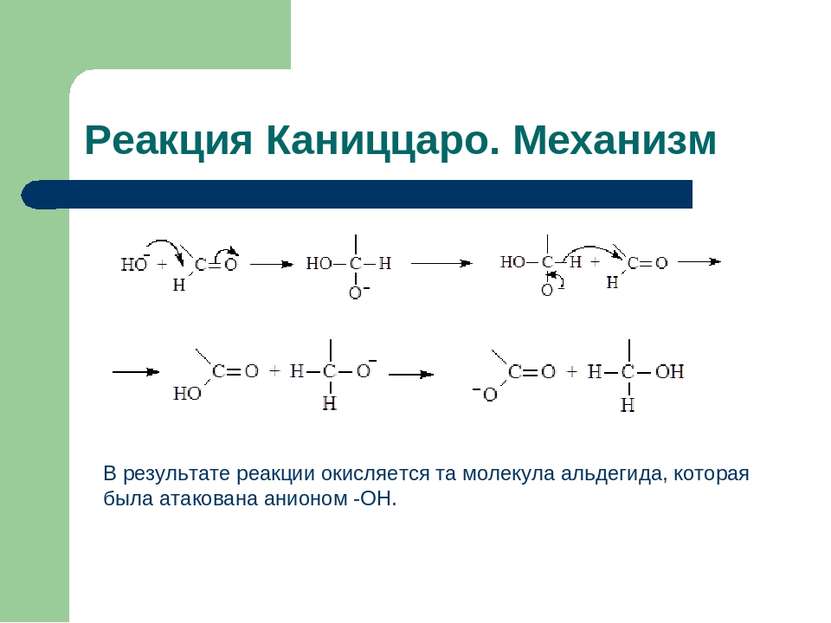
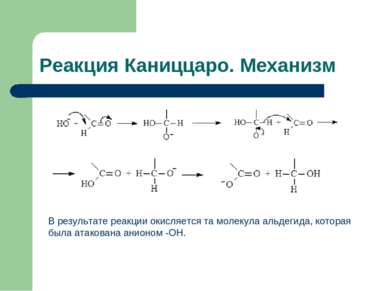 Реакция Каниццаро. Механизм В результате реакции окисляется та молекула альдегида, которая была атакована анионом -OH.
Реакция Каниццаро. Механизм В результате реакции окисляется та молекула альдегида, которая была атакована анионом -OH.
Cлайд 38
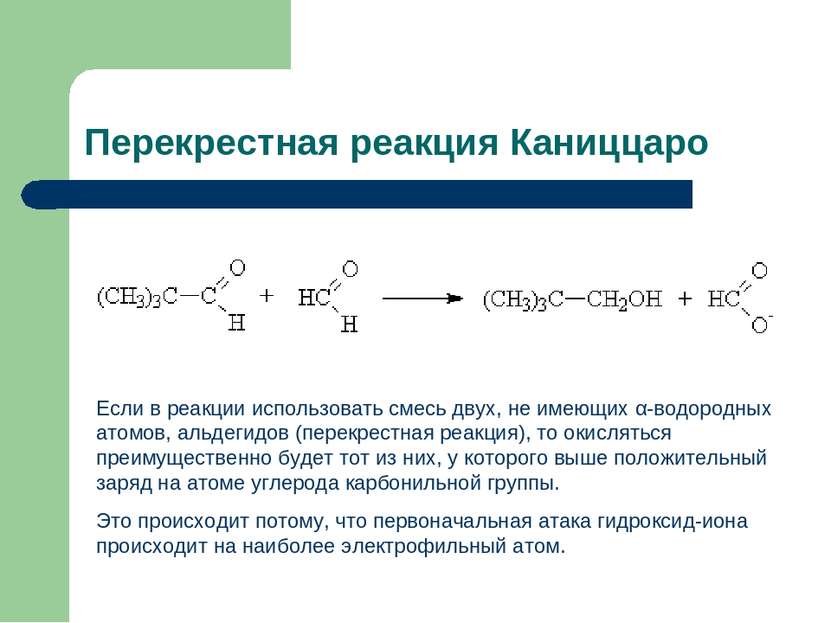
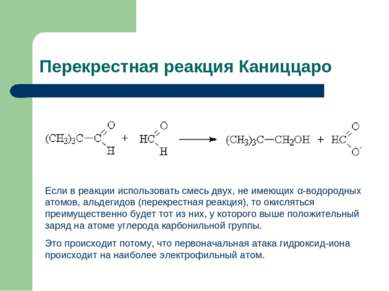 Перекрестная реакция Каниццаро Если в реакции использовать смесь двух, не имеющих α-водородных атомов, альдегидов (перекрестная реакция), то окисляться преимущественно будет тот из них, у которого выше положительный заряд на атоме углерода карбонильной группы. Это происходит потому, что первоначальная атака гидроксид-иона происходит на наиболее электрофильный атом.
Перекрестная реакция Каниццаро Если в реакции использовать смесь двух, не имеющих α-водородных атомов, альдегидов (перекрестная реакция), то окисляться преимущественно будет тот из них, у которого выше положительный заряд на атоме углерода карбонильной группы. Это происходит потому, что первоначальная атака гидроксид-иона происходит на наиболее электрофильный атом.