X
Код презентации скопируйте его
Алкены (10 класс)
Скачать эту презентациюПрезентация на тему Алкены (10 класс)
Скачать эту презентациюCлайд 2
 Цели урока изучить способы получения, химические свойства применение алкенов на примере непредельного углеводорода - этилена
Цели урока изучить способы получения, химические свойства применение алкенов на примере непредельного углеводорода - этилена
Cлайд 5
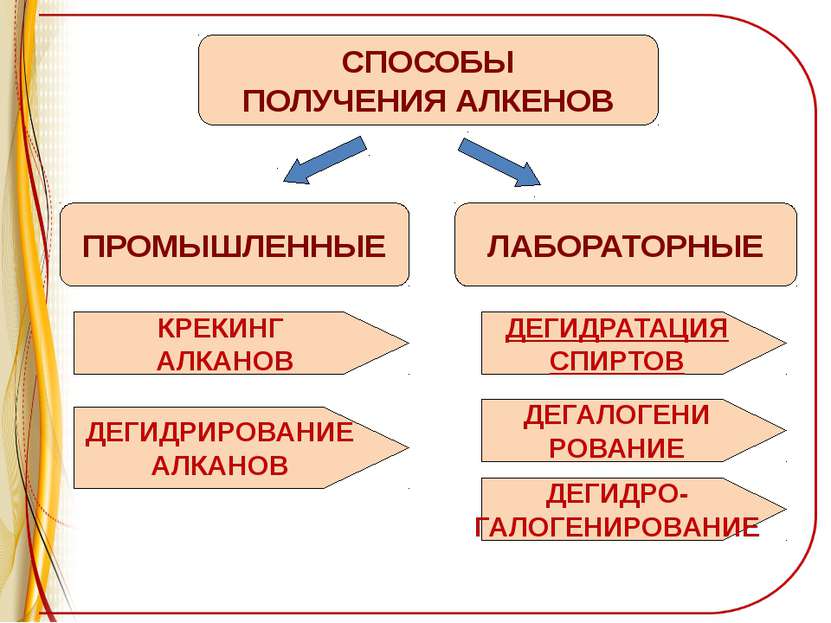
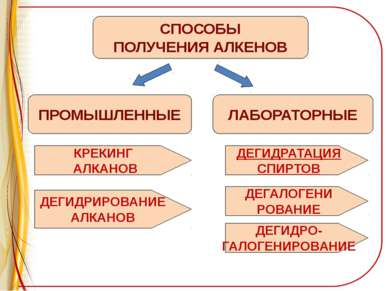 ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИ РОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИ РОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
Cлайд 6
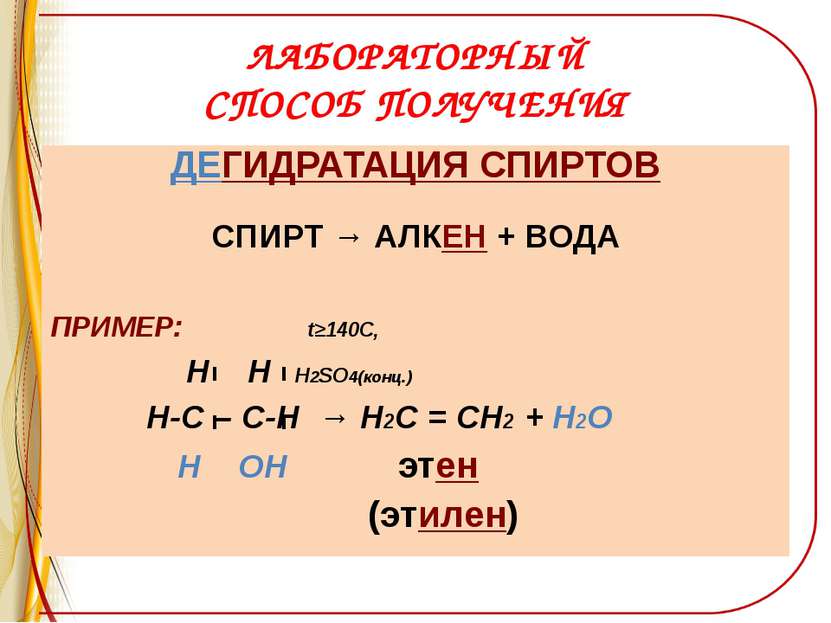
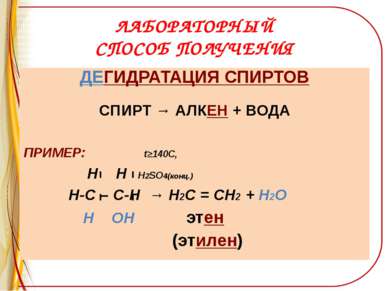 ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С – С-Н → Н2С = СН2 + Н2О Н ОН этен (этилен)
ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С – С-Н → Н2С = СН2 + Н2О Н ОН этен (этилен)
Cлайд 7
 Получение алкенов КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИННОЙ УГЛЕРОДНОЙ УГЛЕРОДНОЙ ЦЕПЬЮ ЦЕПЬЮ ПРИМЕР: t=400-700C С 10 Н 22→ С5Н 12+ С5Н10 декан пентан пентен
Получение алкенов КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИННОЙ УГЛЕРОДНОЙ УГЛЕРОДНОЙ ЦЕПЬЮ ЦЕПЬЮ ПРИМЕР: t=400-700C С 10 Н 22→ С5Н 12+ С5Н10 декан пентан пентен
Cлайд 8
 ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3 → Н2С = СН2 + Н2 этан этен (этилен)
ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3 → Н2С = СН2 + Н2 этан этен (этилен)
Cлайд 9
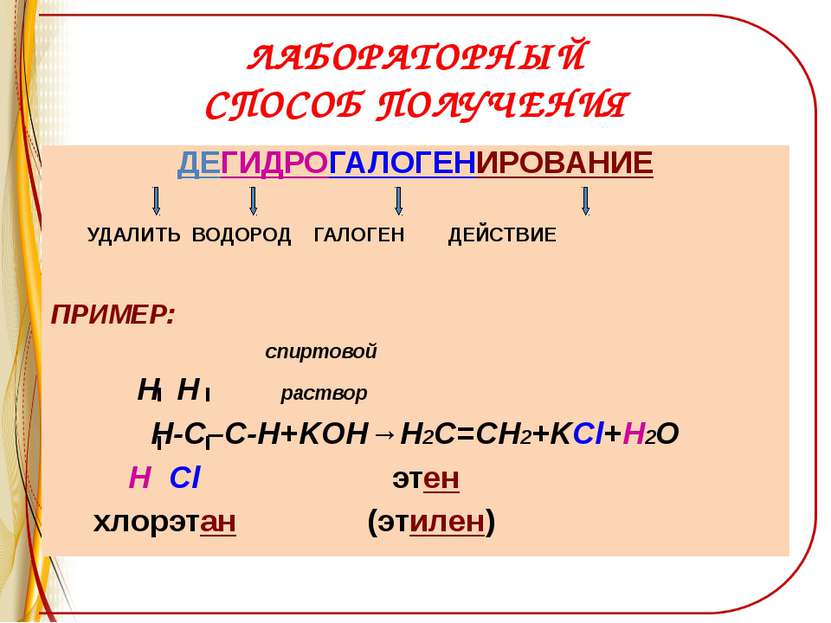
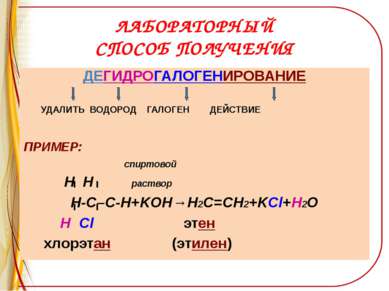 ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl этен хлорэтан (этилен)
ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl этен хлорэтан (этилен)
Cлайд 11
 РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь
РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] + H2O H2C - CH2 OH OH этиленгликоль (этандиол-1,2) ! Качественная реакция на непредельность углеводорода – на кратную связь
Cлайд 12
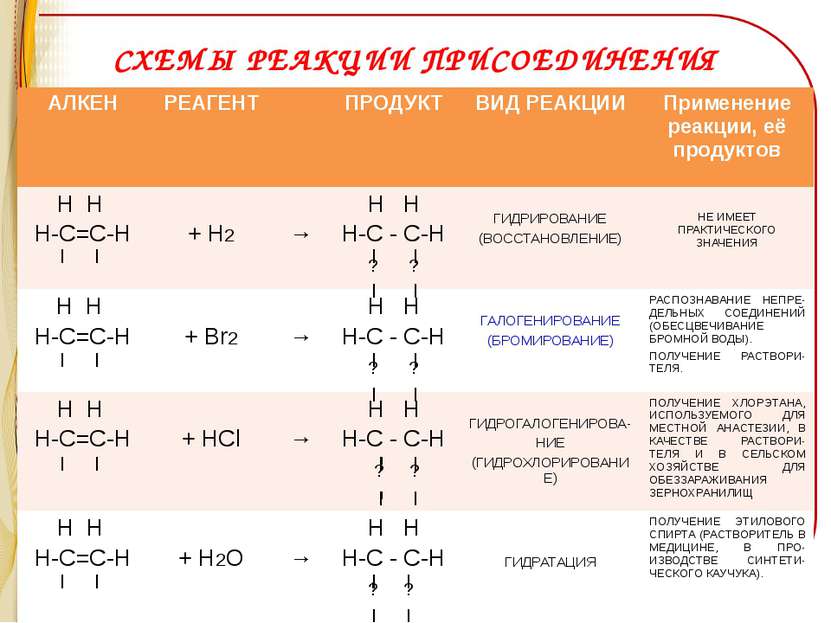
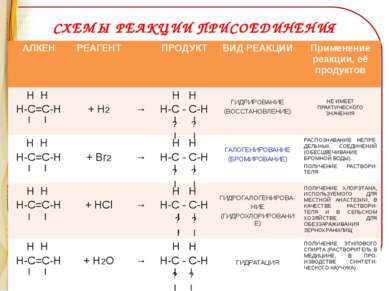 СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ АЛКЕН РЕАГЕНТ ПРОДУКТ ВИД РЕАКЦИИ Применение реакции, её продуктов Н Н Н-С=С-Н + Н2 → Н Н Н-С - С-Н ? ? ГИДРИРОВАНИЕ (ВОССТАНОВЛЕНИЕ) НЕ ИМЕЕТ ПРАКТИЧЕСКОГО ЗНАЧЕНИЯ Н Н Н-С=С-Н + Br2 → Н Н Н-С - С-Н ? ? ГАЛОГЕНИРОВАНИЕ (БРОМИРОВАНИЕ) РАСПОЗНАВАНИЕ НЕПРЕ-ДЕЛЬНЫХ СОЕДИНЕНИЙ (ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ ВОДЫ). ПОЛУЧЕНИЕ РАСТВОРИ-ТЕЛЯ. Н Н Н-С=С-Н +HCl → Н Н Н-С - С-Н ? ? ГИДРОГАЛОГЕНИРОВА- НИЕ (ГИДРОХЛОРИРОВАНИЕ) ПОЛУЧЕНИЕ ХЛОРЭТАНА, ИСПОЛЬЗУЕМОГО ДЛЯ МЕСТНОЙ АНАСТЕЗИИ, В КАЧЕСТВЕ РАСТВОРИ-ТЕЛЯ И В СЕЛЬСКОМ ХОЗЯЙСТВЕ ДЛЯ ОБЕЗЗАРАЖИВАНИЯ ЗЕРНОХРАНИЛИЩ Н Н Н-С=С-Н + H2O → Н Н Н-С - С-Н ? ? ГИДРАТАЦИЯ ПОЛУЧЕНИЕ ЭТИЛОВОГО СПИРТА (РАСТВОРИТЕЛЬ В МЕДИЦИНЕ, В ПРО-ИЗВОДСТВЕ СИНТЕТИ-ЧЕСКОГО КАУЧУКА).
СХЕМЫ РЕАКЦИИ ПРИСОЕДИНЕНИЯ АЛКЕН РЕАГЕНТ ПРОДУКТ ВИД РЕАКЦИИ Применение реакции, её продуктов Н Н Н-С=С-Н + Н2 → Н Н Н-С - С-Н ? ? ГИДРИРОВАНИЕ (ВОССТАНОВЛЕНИЕ) НЕ ИМЕЕТ ПРАКТИЧЕСКОГО ЗНАЧЕНИЯ Н Н Н-С=С-Н + Br2 → Н Н Н-С - С-Н ? ? ГАЛОГЕНИРОВАНИЕ (БРОМИРОВАНИЕ) РАСПОЗНАВАНИЕ НЕПРЕ-ДЕЛЬНЫХ СОЕДИНЕНИЙ (ОБЕСЦВЕЧИВАНИЕ БРОМНОЙ ВОДЫ). ПОЛУЧЕНИЕ РАСТВОРИ-ТЕЛЯ. Н Н Н-С=С-Н +HCl → Н Н Н-С - С-Н ? ? ГИДРОГАЛОГЕНИРОВА- НИЕ (ГИДРОХЛОРИРОВАНИЕ) ПОЛУЧЕНИЕ ХЛОРЭТАНА, ИСПОЛЬЗУЕМОГО ДЛЯ МЕСТНОЙ АНАСТЕЗИИ, В КАЧЕСТВЕ РАСТВОРИ-ТЕЛЯ И В СЕЛЬСКОМ ХОЗЯЙСТВЕ ДЛЯ ОБЕЗЗАРАЖИВАНИЯ ЗЕРНОХРАНИЛИЩ Н Н Н-С=С-Н + H2O → Н Н Н-С - С-Н ? ? ГИДРАТАЦИЯ ПОЛУЧЕНИЕ ЭТИЛОВОГО СПИРТА (РАСТВОРИТЕЛЬ В МЕДИЦИНЕ, В ПРО-ИЗВОДСТВЕ СИНТЕТИ-ЧЕСКОГО КАУЧУКА).