X
Код презентации скопируйте его
Строение атома и атомного ядра
Скачать эту презентациюПрезентация на тему Строение атома и атомного ядра
Скачать эту презентациюCлайд 1
 СОДЕРЖАНИЕ 1 модуль 1. Строение атома. Опыты Резерфорда. 2. Модель атома Резерфорда. 3. Радиоактивное превращение атомных ядер. 4. Состав атомного ядра. 5. Деление ядер урана. 6. Ядерный реактор. 7. Использование атомной энергии. 2 модуль 1. и распад. 2. Закон сохранения массового и зарядового числа. 3. Изотопы. 4. Термоядерная реакция. 2 - 4 5 7 - 9 6 13 - 15 10 -12 16 18 17 19 20
СОДЕРЖАНИЕ 1 модуль 1. Строение атома. Опыты Резерфорда. 2. Модель атома Резерфорда. 3. Радиоактивное превращение атомных ядер. 4. Состав атомного ядра. 5. Деление ядер урана. 6. Ядерный реактор. 7. Использование атомной энергии. 2 модуль 1. и распад. 2. Закон сохранения массового и зарядового числа. 3. Изотопы. 4. Термоядерная реакция. 2 - 4 5 7 - 9 6 13 - 15 10 -12 16 18 17 19 20
Cлайд 2
 1896 г. Анри Беккерель (франц.) открыл явление радиоактивности. Радиоактивность – способность атомов к самопроизвольному излучению. 1899 г. Эрнест Резерфорд обнаружил, что это излучение неоднородно.
1896 г. Анри Беккерель (франц.) открыл явление радиоактивности. Радиоактивность – способность атомов к самопроизвольному излучению. 1899 г. Эрнест Резерфорд обнаружил, что это излучение неоднородно.
Cлайд 3
 Опыты Резерфорда 1. В толстостенный свинцовый сосуд положили крупицу радия. Излучение радия обнаружили с помощью фотопластинки. 2. Вокруг цилиндра создали сильное магнитное поле. Излучение разделилось на три потока. Следовательно, излучение состоит из потоков положительных частиц, отрицательных и нейтральных. Положительные назвали альфа-частицами ( - частицы); Отрицательные – бета-частицы ( - частицы); Нейтральные – гамма-частицы ( - частицы) или - квантами или фотонами. N S
Опыты Резерфорда 1. В толстостенный свинцовый сосуд положили крупицу радия. Излучение радия обнаружили с помощью фотопластинки. 2. Вокруг цилиндра создали сильное магнитное поле. Излучение разделилось на три потока. Следовательно, излучение состоит из потоков положительных частиц, отрицательных и нейтральных. Положительные назвали альфа-частицами ( - частицы); Отрицательные – бета-частицы ( - частицы); Нейтральные – гамма-частицы ( - частицы) или - квантами или фотонами. N S
Cлайд 4
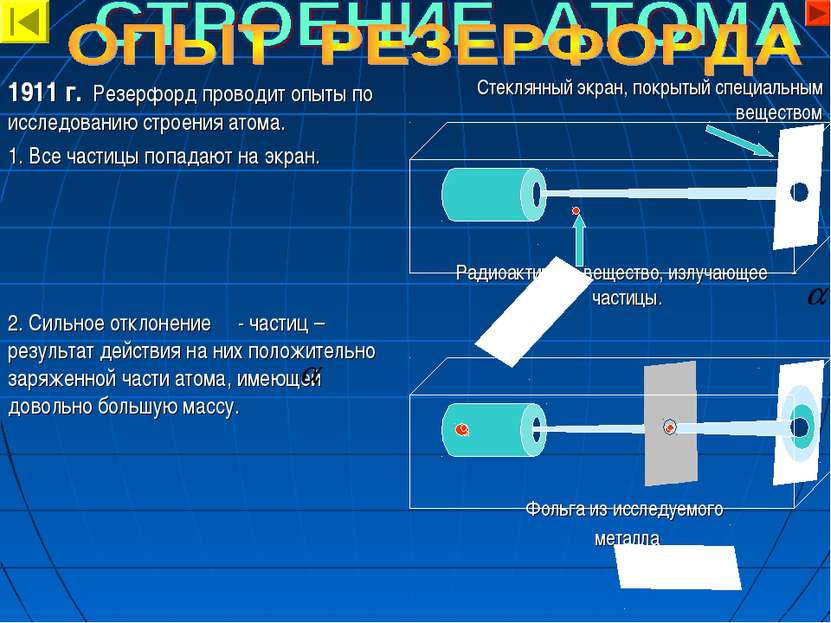
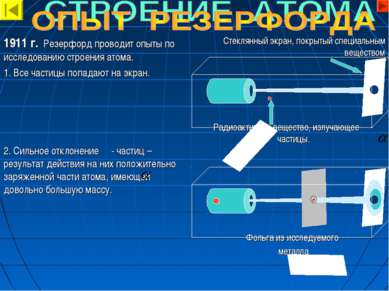 Стеклянный экран, покрытый специальным веществом Радиоактивное вещество, излучающее - частицы. Фольга из исследуемого металла 1911 г. Резерфорд проводит опыты по исследованию строения атома. 1. Все частицы попадают на экран. 2. Сильное отклонение - частиц – результат действия на них положительно заряженной части атома, имеющей довольно большую массу.
Стеклянный экран, покрытый специальным веществом Радиоактивное вещество, излучающее - частицы. Фольга из исследуемого металла 1911 г. Резерфорд проводит опыты по исследованию строения атома. 1. Все частицы попадают на экран. 2. Сильное отклонение - частиц – результат действия на них положительно заряженной части атома, имеющей довольно большую массу.
Cлайд 5
 - частицы ядро По Резерфорду атом имеет планетарное строение. В центре находится положительно заряженное ядро. Вокруг ядра движутся электроны. Атом нейтрален, т.к. заряд ядра равен общему заряду электронов. Такое строение атома объясняет поведение - частиц
- частицы ядро По Резерфорду атом имеет планетарное строение. В центре находится положительно заряженное ядро. Вокруг ядра движутся электроны. Атом нейтрален, т.к. заряд ядра равен общему заряду электронов. Такое строение атома объясняет поведение - частиц
Cлайд 6
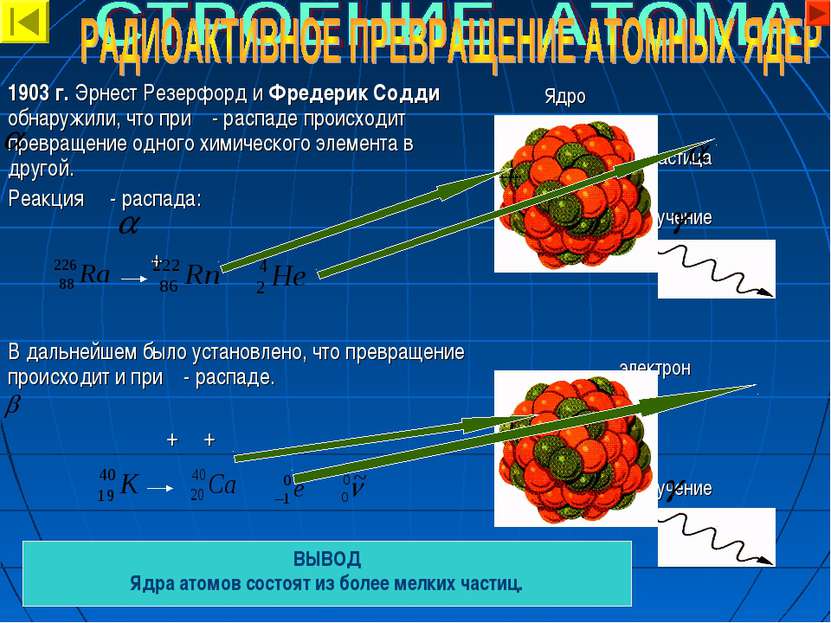
 1903 г. Эрнест Резерфорд и Фредерик Содди обнаружили, что при - распаде происходит превращение одного химического элемента в другой. Реакция - распада: + В дальнейшем было установлено, что превращение происходит и при - распаде. + + Ядро - частица - излучение электрон - излучение ВЫВОД Ядра атомов состоят из более мелких частиц.
1903 г. Эрнест Резерфорд и Фредерик Содди обнаружили, что при - распаде происходит превращение одного химического элемента в другой. Реакция - распада: + В дальнейшем было установлено, что превращение происходит и при - распаде. + + Ядро - частица - излучение электрон - излучение ВЫВОД Ядра атомов состоят из более мелких частиц.
Cлайд 7
 1919 г. Резерфорд исследовал взаимодействие - частиц с ядрами атомов азота. При этом, из ядра атома азота вылетала частица, которую он назвал протоном (первый). Позднее с помощью камеры Вильсона было доказано, что это действительно положительно заряженная элементарная частица, которая является ядром атома водорода. Кроме того, образовалось ядро атома кислорода. + + - ядро атома водорода или протон. Обозначается - , имеет массу ≈ 1а.е.м. и заряд равный заряду электрона.
1919 г. Резерфорд исследовал взаимодействие - частиц с ядрами атомов азота. При этом, из ядра атома азота вылетала частица, которую он назвал протоном (первый). Позднее с помощью камеры Вильсона было доказано, что это действительно положительно заряженная элементарная частица, которая является ядром атома водорода. Кроме того, образовалось ядро атома кислорода. + + - ядро атома водорода или протон. Обозначается - , имеет массу ≈ 1а.е.м. и заряд равный заряду электрона.
Cлайд 8
 1920 г. Резерфорд предполагает существование в ядре нейтральной частицы с массой равной массе протона. В 30-х гг. при бомбардировке ядер бериллия - частицами было обнаружено новое излучение, которое назвали бериллиевым. 1932 г. Джеймс Чедвиг (англ.) доказал, что бериллиевое излучение - это поток электрически нейтральных частиц с массой равной массе протона. Эти частицы назвали нейтронами.
1920 г. Резерфорд предполагает существование в ядре нейтральной частицы с массой равной массе протона. В 30-х гг. при бомбардировке ядер бериллия - частицами было обнаружено новое излучение, которое назвали бериллиевым. 1932 г. Джеймс Чедвиг (англ.) доказал, что бериллиевое излучение - это поток электрически нейтральных частиц с массой равной массе протона. Эти частицы назвали нейтронами.
Cлайд 9
 N – число нейтронов 1932 г. Д.Д.Иваненко (рус.), В.Гейзенберг (нем.) предложили протонно-нейтронную модель строения ядра: ядро состоит из протонов и нейтронов – нуклонов. ПРИМЕР. А = 56, Z = 26, N = 30 Общее число нуклонов в ядре называется массовым числом и обозначается А Число протонов в ядре называется зарядовым числом и обозначается Z X A Z A = Z+N Число протонов для данного элемента постоянное. Число нейтронов может быть больше числа протонов, оно может меняться(получаем ИЗОТОПЫ вещества)
N – число нейтронов 1932 г. Д.Д.Иваненко (рус.), В.Гейзенберг (нем.) предложили протонно-нейтронную модель строения ядра: ядро состоит из протонов и нейтронов – нуклонов. ПРИМЕР. А = 56, Z = 26, N = 30 Общее число нуклонов в ядре называется массовым числом и обозначается А Число протонов в ядре называется зарядовым числом и обозначается Z X A Z A = Z+N Число протонов для данного элемента постоянное. Число нейтронов может быть больше числа протонов, оно может меняться(получаем ИЗОТОПЫ вещества)
Cлайд 10
 1939 г. Отто Ган и Фриц Штрассман (нем.) открыли деление ядер урана. Ядра урана бомбардируют нейтронами. Если нейтрон попадает в нестабильное ядро, то оно делится на два более стабильных ядра, которые разлетаются с огромной скоростью. При этом они испускают 2-3 нейтрона. Осколки ядра тормозятся и при этом передают свою энергию окружающей среде
1939 г. Отто Ган и Фриц Штрассман (нем.) открыли деление ядер урана. Ядра урана бомбардируют нейтронами. Если нейтрон попадает в нестабильное ядро, то оно делится на два более стабильных ядра, которые разлетаются с огромной скоростью. При этом они испускают 2-3 нейтрона. Осколки ядра тормозятся и при этом передают свою энергию окружающей среде
Cлайд 12
 ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОТЕКАНИЕ ЦЕПНОЙ РЕАКЦИИ 1. МАССА УРАНА. 2. НАЛИЧИЕ ОТРАЖАЮЩЕЙ ОБОЛОЧКИ (бериллий). 3. НАЛИЧИЕ ПРИМЕСЕЙ. 4. НАЛИЧИЕ ЗАМЕДЛИТЕЛЯ НЕЙТРОНОВ – графит, вода, тяжелая вода. Наименьшая масса урана, при которой возможно протекание цепной реакции, называется критической массой
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОТЕКАНИЕ ЦЕПНОЙ РЕАКЦИИ 1. МАССА УРАНА. 2. НАЛИЧИЕ ОТРАЖАЮЩЕЙ ОБОЛОЧКИ (бериллий). 3. НАЛИЧИЕ ПРИМЕСЕЙ. 4. НАЛИЧИЕ ЗАМЕДЛИТЕЛЯ НЕЙТРОНОВ – графит, вода, тяжелая вода. Наименьшая масса урана, при которой возможно протекание цепной реакции, называется критической массой
Cлайд 14
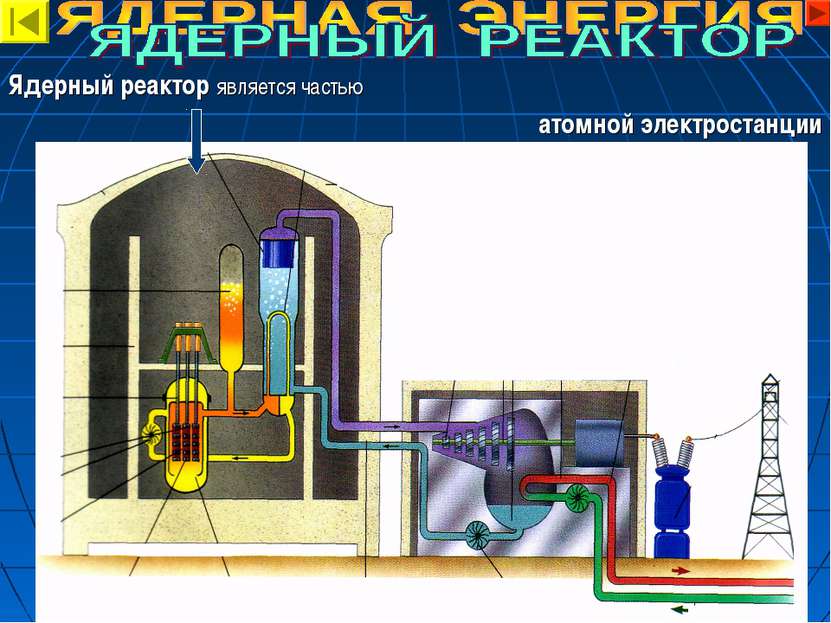
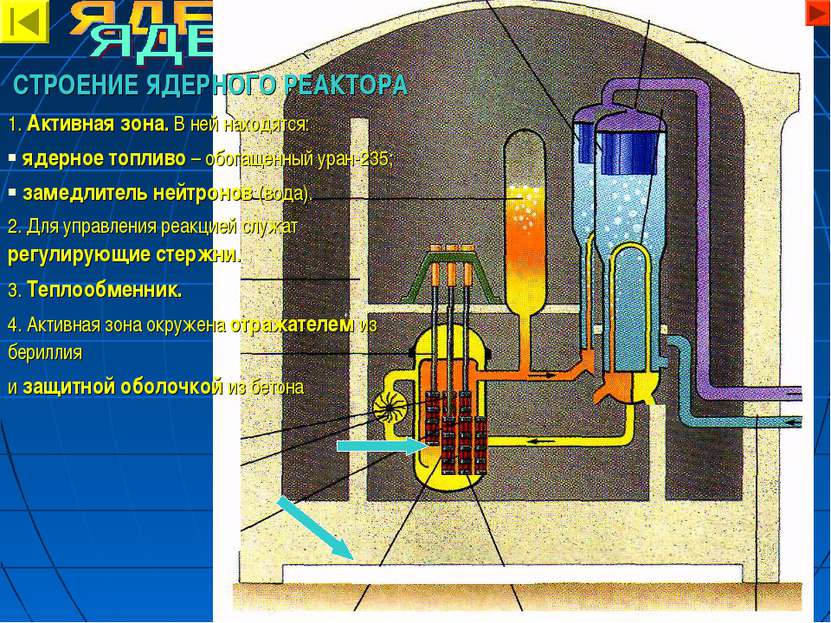
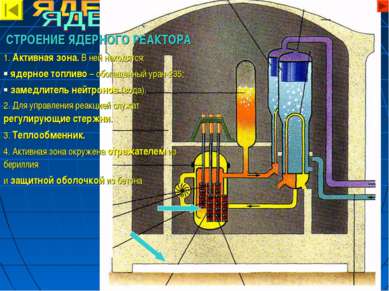 СТРОЕНИЕ ЯДЕРНОГО РЕАКТОРА 1. Активная зона. В ней находятся: ядерное топливо – обогащенный уран-235; замедлитель нейтронов (вода). 2. Для управления реакцией служат регулирующие стержни. 3. Теплообменник. 4. Активная зона окружена отражателем из бериллия и защитной оболочкой из бетона
СТРОЕНИЕ ЯДЕРНОГО РЕАКТОРА 1. Активная зона. В ней находятся: ядерное топливо – обогащенный уран-235; замедлитель нейтронов (вода). 2. Для управления реакцией служат регулирующие стержни. 3. Теплообменник. 4. Активная зона окружена отражателем из бериллия и защитной оболочкой из бетона
Cлайд 15
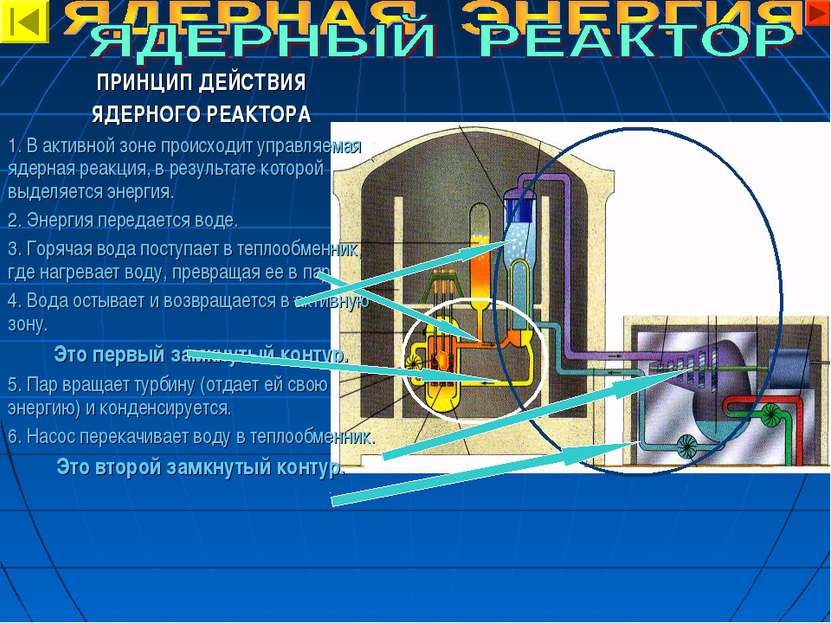
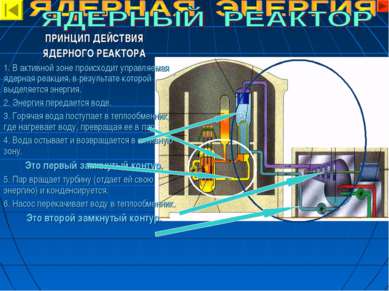 ПРИНЦИП ДЕЙСТВИЯ ЯДЕРНОГО РЕАКТОРА 1. В активной зоне происходит управляемая ядерная реакция, в результате которой выделяется энергия. 2. Энергия передается воде. 3. Горячая вода поступает в теплообменник, где нагревает воду, превращая ее в пар. 4. Вода остывает и возвращается в активную зону. Это первый замкнутый контур. 5. Пар вращает турбину (отдает ей свою энергию) и конденсируется. 6. Насос перекачивает воду в теплообменник. Это второй замкнутый контур.
ПРИНЦИП ДЕЙСТВИЯ ЯДЕРНОГО РЕАКТОРА 1. В активной зоне происходит управляемая ядерная реакция, в результате которой выделяется энергия. 2. Энергия передается воде. 3. Горячая вода поступает в теплообменник, где нагревает воду, превращая ее в пар. 4. Вода остывает и возвращается в активную зону. Это первый замкнутый контур. 5. Пар вращает турбину (отдает ей свою энергию) и конденсируется. 6. Насос перекачивает воду в теплообменник. Это второй замкнутый контур.
Cлайд 16
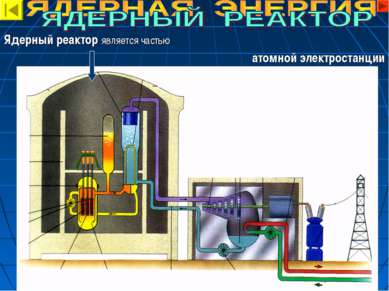
 1. АТОМНЫЕ ЭЛЕКТРОСТАНЦИИ. 1942 г. Под руководством Э.Ферми в США был построен первый ядерный реактор. 1946 г. Под руководством И.В.Курчатова был создан первый ядерный реактор в СССР. 1954 г. В СССР была введена в действие первая в мире атомная станция. 2. Техника. 1. Космические корабли. 2. Атомные ледоколы. 3. Атомные подводные лодки. 3. Ядерное оружие.
1. АТОМНЫЕ ЭЛЕКТРОСТАНЦИИ. 1942 г. Под руководством Э.Ферми в США был построен первый ядерный реактор. 1946 г. Под руководством И.В.Курчатова был создан первый ядерный реактор в СССР. 1954 г. В СССР была введена в действие первая в мире атомная станция. 2. Техника. 1. Космические корабли. 2. Атомные ледоколы. 3. Атомные подводные лодки. 3. Ядерное оружие.
Cлайд 17
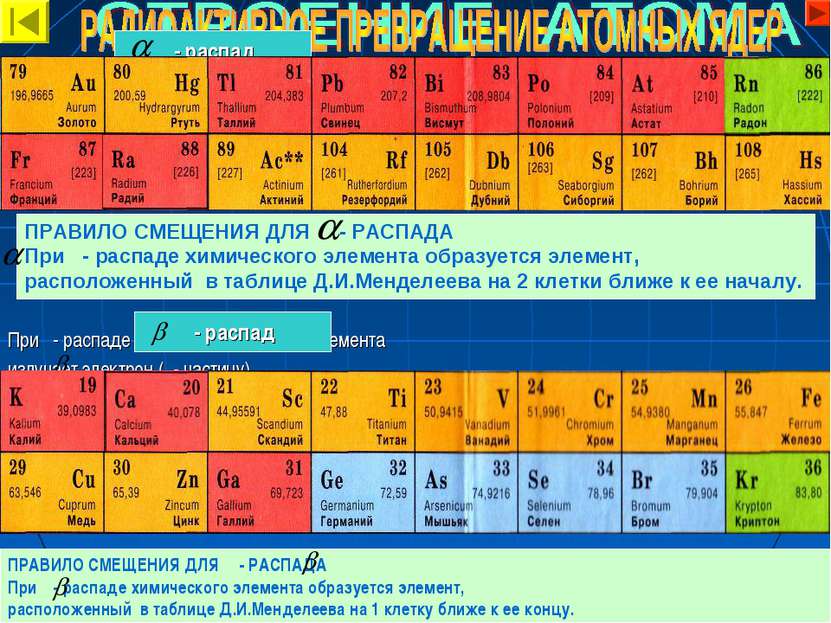
 ПРАВИЛО СМЕЩЕНИЯ ДЛЯ - РАСПАДА При - распаде химического элемента образуется элемент, расположенный в таблице Д.И.Менделеева на 2 клетки ближе к ее началу. При - распаде ядро радиоактивного элемента излучает - частицу и образуется ядро другого химического элемента, зарядовое число которого на 2 единицы меньше, чем у исходного. При - распаде ядро радиоактивного элемента излучает электрон ( - частицу) и нейтральную частицу – антинейтрино. В результате число протонов в ядре увеличивается на единицу, т.е. увеличивается зарядовое число, образуется новый химический элемент. - распад - распад 222 226 88 4 2 86 40 -1 20 19 40 0 0 0 ПРАВИЛО СМЕЩЕНИЯ ДЛЯ - РАСПАДА При - распаде химического элемента образуется элемент, расположенный в таблице Д.И.Менделеева на 1 клетку ближе к ее концу. Rn Ra + He e K Ca + +
ПРАВИЛО СМЕЩЕНИЯ ДЛЯ - РАСПАДА При - распаде химического элемента образуется элемент, расположенный в таблице Д.И.Менделеева на 2 клетки ближе к ее началу. При - распаде ядро радиоактивного элемента излучает - частицу и образуется ядро другого химического элемента, зарядовое число которого на 2 единицы меньше, чем у исходного. При - распаде ядро радиоактивного элемента излучает электрон ( - частицу) и нейтральную частицу – антинейтрино. В результате число протонов в ядре увеличивается на единицу, т.е. увеличивается зарядовое число, образуется новый химический элемент. - распад - распад 222 226 88 4 2 86 40 -1 20 19 40 0 0 0 ПРАВИЛО СМЕЩЕНИЯ ДЛЯ - РАСПАДА При - распаде химического элемента образуется элемент, расположенный в таблице Д.И.Менделеева на 1 клетку ближе к ее концу. Rn Ra + He e K Ca + +
Cлайд 18
 Массовые числа химических элементов. Зарядовые числа химических элементов. 222 226 88 4 2 86 Rn Ra + He ЗАКОН СОХРАНЕНИЯ МАССОВОГО ЧИСЛА И ЗАРЯДА. В процессе радиоактивного распада массовое число и заряд распадающегося ядра атома равны суммам массовых чисел и зарядов образовавшихся в результате распада веществ.
Массовые числа химических элементов. Зарядовые числа химических элементов. 222 226 88 4 2 86 Rn Ra + He ЗАКОН СОХРАНЕНИЯ МАССОВОГО ЧИСЛА И ЗАРЯДА. В процессе радиоактивного распада массовое число и заряд распадающегося ядра атома равны суммам массовых чисел и зарядов образовавшихся в результате распада веществ.
Cлайд 19
 ИЗОТОПЫ –разновидности химического элемента, различающиеся по массе атомных ядер. 234 92 U 235 92 U 236 92 U 1 1 H 2 1 H 3 1 H ПРИМЕРЫ: 1. Изотопы урана 2. Изотопы водорода - протий - дейтерий - тритий Все химические элементы имеют одинаковое зарядовое число, т.е. одинаковое число протонов, но разное массовое число, т.е. разное число нейтронов. Существование у химических элементов изотопов – причина того, что массовые числа многих элементов числа дробные. ПРИМЕР: 40,078 20 Ca
ИЗОТОПЫ –разновидности химического элемента, различающиеся по массе атомных ядер. 234 92 U 235 92 U 236 92 U 1 1 H 2 1 H 3 1 H ПРИМЕРЫ: 1. Изотопы урана 2. Изотопы водорода - протий - дейтерий - тритий Все химические элементы имеют одинаковое зарядовое число, т.е. одинаковое число протонов, но разное массовое число, т.е. разное число нейтронов. Существование у химических элементов изотопов – причина того, что массовые числа многих элементов числа дробные. ПРИМЕР: 40,078 20 Ca
Cлайд 20
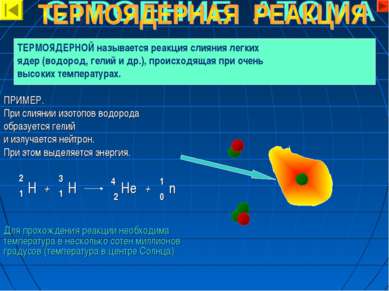 ПРИМЕР. При слиянии изотопов водорода образуется гелий и излучается нейтрон. При этом выделяется энергия. Для прохождения реакции необходима температура в несколько сотен миллионов градусов (температура в центре Солнца) ТЕРМОЯДЕРНОЙ называется реакция слияния легких ядер (водород, гелий и др.), происходящая при очень высоких температурах. 2 1 Н + Hе 3 1 Н 2 4 n 0 1 +
ПРИМЕР. При слиянии изотопов водорода образуется гелий и излучается нейтрон. При этом выделяется энергия. Для прохождения реакции необходима температура в несколько сотен миллионов градусов (температура в центре Солнца) ТЕРМОЯДЕРНОЙ называется реакция слияния легких ядер (водород, гелий и др.), происходящая при очень высоких температурах. 2 1 Н + Hе 3 1 Н 2 4 n 0 1 +