X
Код презентации скопируйте его
Хлороводород. Соляная кислота
Скачать эту презентациюПрезентация на тему Хлороводород. Соляная кислота
Скачать эту презентациюCлайд 2
 Хлороводород HCl HCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха. Докажем это: М (HCl)= 1+35,5=36,5 г/моль М (воздуха)= 29 г/моль
Хлороводород HCl HCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха. Докажем это: М (HCl)= 1+35,5=36,5 г/моль М (воздуха)= 29 г/моль
Cлайд 3
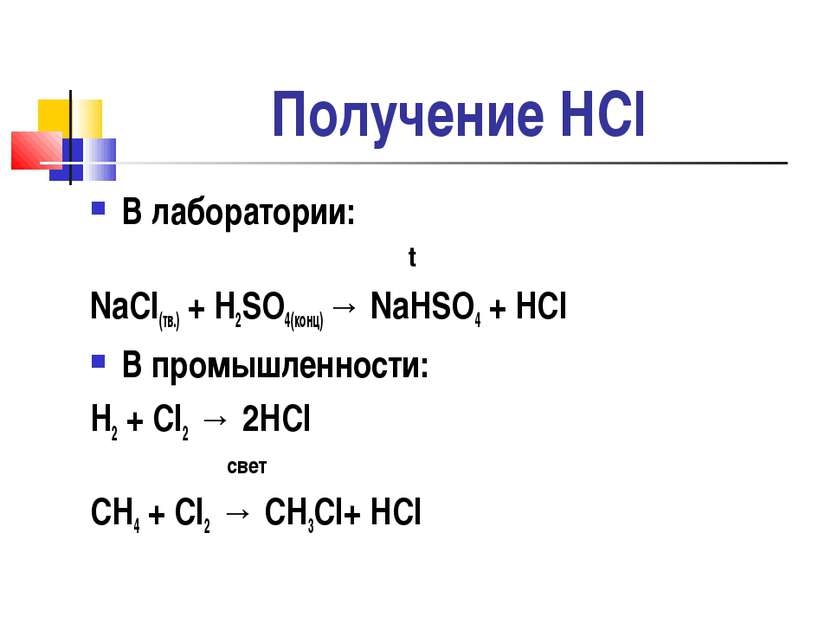
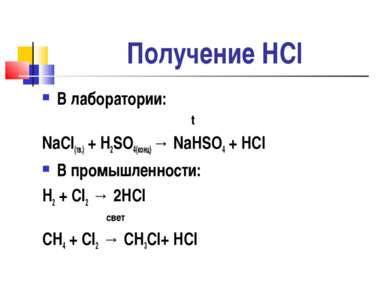 Получение HCl В лаборатории: t NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl В промышленности: H2 + Cl2 → 2HCl свет CH4 + Cl2 → CH3Cl+ HCl
Получение HCl В лаборатории: t NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl В промышленности: H2 + Cl2 → 2HCl свет CH4 + Cl2 → CH3Cl+ HCl
Cлайд 4
 Соляная кислота HCl Соляная кислота сильная, т.е. в водных растворах полностью распадается на ионы: HCl → H+ + Cl- Растворы кислоты не имеют запаха.
Соляная кислота HCl Соляная кислота сильная, т.е. в водных растворах полностью распадается на ионы: HCl → H+ + Cl- Растворы кислоты не имеют запаха.
Cлайд 5
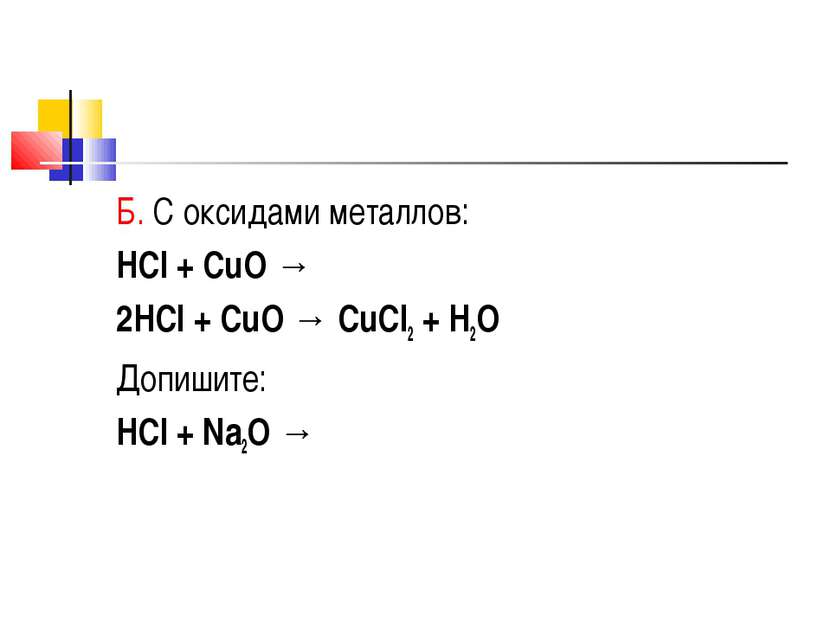
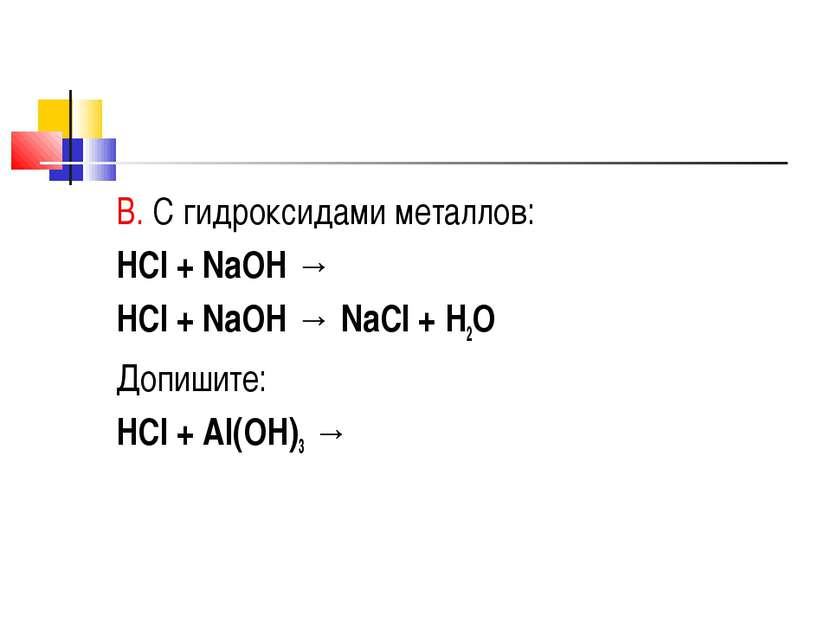
 Химические свойства Кислотные свойства А. Взаимодействие с металлами, стоящими в ряду активности до водорода: HCl + Zn → 2HCl + Zn → ZnCl2 + H2 Допишите: HCl + Al →
Химические свойства Кислотные свойства А. Взаимодействие с металлами, стоящими в ряду активности до водорода: HCl + Zn → 2HCl + Zn → ZnCl2 + H2 Допишите: HCl + Al →
Cлайд 8
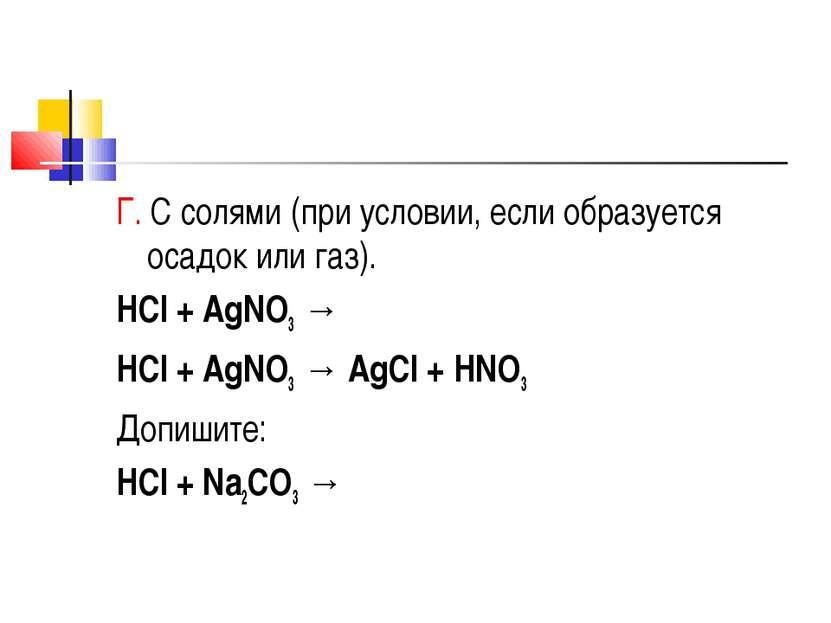
 Г. С солями (при условии, если образуется осадок или газ). HCl + AgNO3 → HCl + AgNO3 → AgCl + HNO3 Допишите: HCl + Na2CO3 →
Г. С солями (при условии, если образуется осадок или газ). HCl + AgNO3 → HCl + AgNO3 → AgCl + HNO3 Допишите: HCl + Na2CO3 →