X
Код презентации скопируйте его
Непредельные углеводороды. Алкены
Скачать эту презентациюПрезентация на тему Непредельные углеводороды. Алкены
Скачать эту презентациюCлайд 2
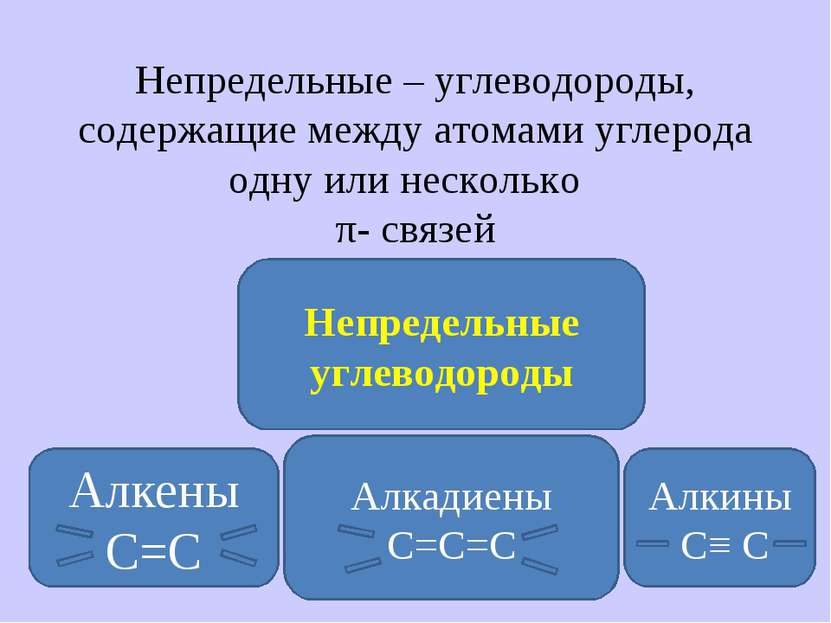
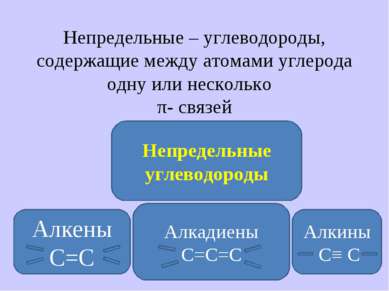 Непредельные – углеводороды, содержащие между атомами углерода одну или несколько π- связей Непредельные углеводороды Алкены С=С Алкины С≡ С Алкадиены С=С=С
Непредельные – углеводороды, содержащие между атомами углерода одну или несколько π- связей Непредельные углеводороды Алкены С=С Алкины С≡ С Алкадиены С=С=С
Cлайд 3
 Алкены (олефины, этиленовые) Строение тип гибридизации – sp2 валентный угол – 1200 геом.форма молекулы – плоская длина связи С=С 0,134 нм
Алкены (олефины, этиленовые) Строение тип гибридизации – sp2 валентный угол – 1200 геом.форма молекулы – плоская длина связи С=С 0,134 нм
Cлайд 4
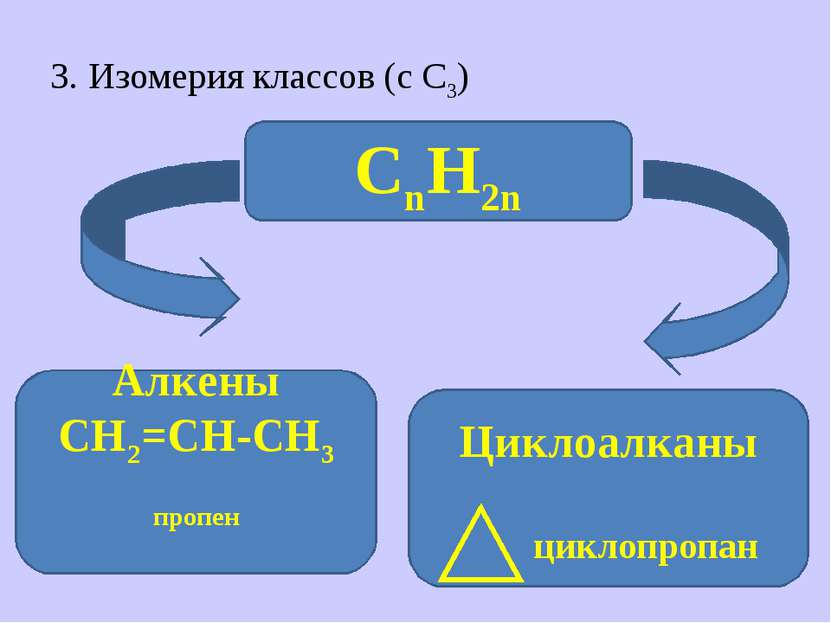
 II. Гомологический ряд алкенов Составьте структурные и молекулярные формулы первых 3-х гомологов алкенов и, пользуясь Справочной таблицей, дайте им названия по международной номенклатуре.
II. Гомологический ряд алкенов Составьте структурные и молекулярные формулы первых 3-х гомологов алкенов и, пользуясь Справочной таблицей, дайте им названия по международной номенклатуре.
Cлайд 7
 III.Изомерия и номенклатура алкенов. Просмотрите видеоролик о номенклатуре алкенов. Какой вид изомерии присущ как алканам, так и алкенам? Какое минимальное количество атомов углерода должно быть у изомера с данным видом изомерии? Запишите название вида изомерии и постройте два изомера углеродного скелета для алкена общего состава С4Н8 и дайте им названия.
III.Изомерия и номенклатура алкенов. Просмотрите видеоролик о номенклатуре алкенов. Какой вид изомерии присущ как алканам, так и алкенам? Какое минимальное количество атомов углерода должно быть у изомера с данным видом изомерии? Запишите название вида изомерии и постройте два изомера углеродного скелета для алкена общего состава С4Н8 и дайте им названия.
Cлайд 8
 4. Что ещё можно изменить в строении алкенов помимо углеродного скелета? 5.Какое минимальное количество атомов углерода должно быть у первого пред-ставителя данной изомерии? 6. Запишите название данной изомерии и постройте формулы двух изомерных алкенов общего состава С5Н10 и дайте им названия. �
4. Что ещё можно изменить в строении алкенов помимо углеродного скелета? 5.Какое минимальное количество атомов углерода должно быть у первого пред-ставителя данной изомерии? 6. Запишите название данной изомерии и постройте формулы двух изомерных алкенов общего состава С5Н10 и дайте им названия. �
Cлайд 10
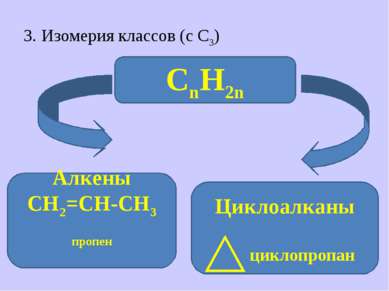
 Изомерия №№1-3 относится к структурной изомерии (положение атомов в пространстве не меняется)
Изомерия №№1-3 относится к структурной изомерии (положение атомов в пространстве не меняется)
Cлайд 11
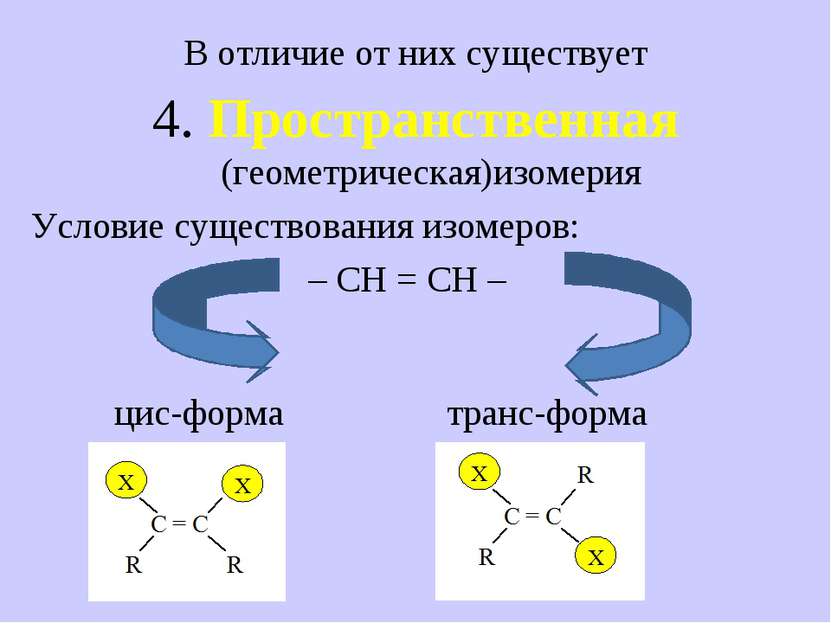
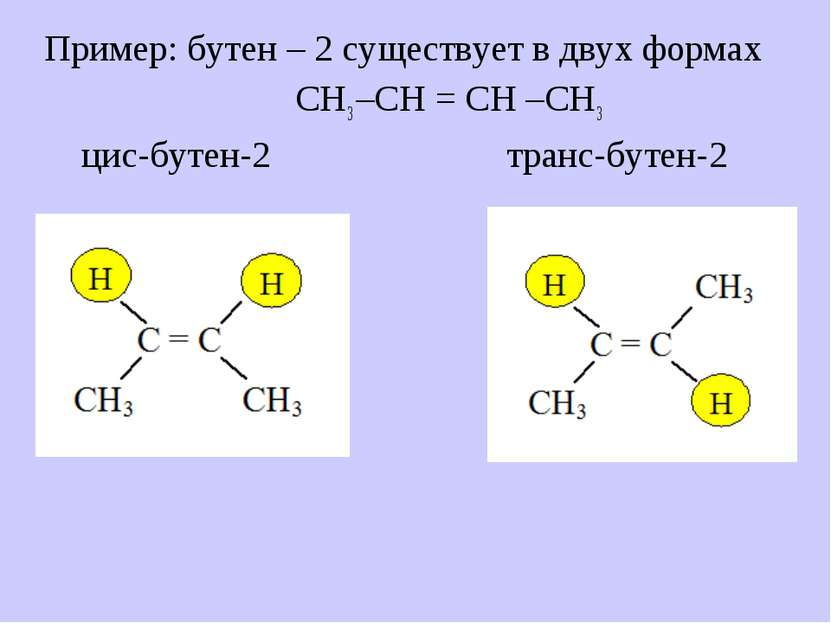
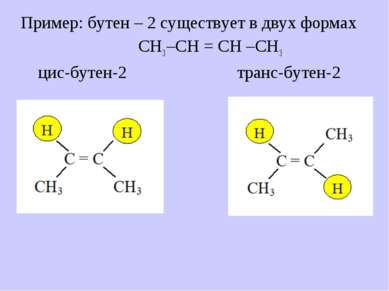
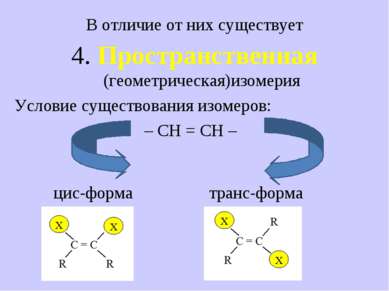 В отличие от них существует 4. Пространственная (геометрическая)изомерия Условие существования изомеров: – СН = СН – цис-форма транс-форма
В отличие от них существует 4. Пространственная (геометрическая)изомерия Условие существования изомеров: – СН = СН – цис-форма транс-форма
Cлайд 14
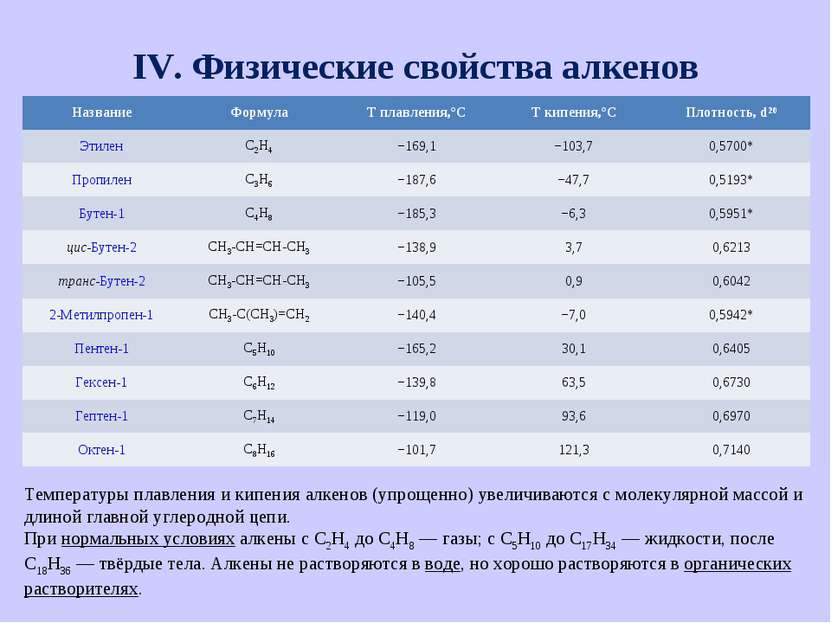
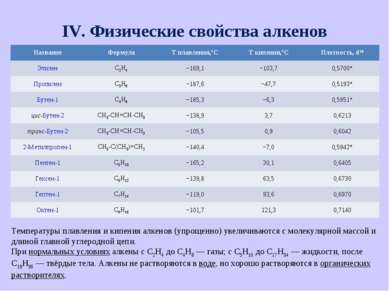 IV. Физические свойства алкенов Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях. Название Формула Т плавления,°С Т кипения,°С Плотность, d20 Этилен С2H4 −169,1 −103,7 0,5700* Пропилен C3H6 −187,6 −47,7 0,5193* Бутен-1 C4H8 −185,3 −6,3 0,5951* цис-Бутен-2 CH3-CH=CH-CH3 −138,9 3,7 0,6213 транс-Бутен-2 CH3-CH=CH-CH3 −105,5 0,9 0,6042 2-Метилпропен-1 CH3-C(CH3)=CH2 −140,4 −7,0 0,5942* Пентен-1 С5H10 −165,2 30,1 0,6405 Гексен-1 С6H12 −139,8 63,5 0,6730 Гептен-1 С7H14 −119,0 93,6 0,6970 Октен-1 С8H16 −101,7 121,3 0,7140
IV. Физические свойства алкенов Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи. При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях. Название Формула Т плавления,°С Т кипения,°С Плотность, d20 Этилен С2H4 −169,1 −103,7 0,5700* Пропилен C3H6 −187,6 −47,7 0,5193* Бутен-1 C4H8 −185,3 −6,3 0,5951* цис-Бутен-2 CH3-CH=CH-CH3 −138,9 3,7 0,6213 транс-Бутен-2 CH3-CH=CH-CH3 −105,5 0,9 0,6042 2-Метилпропен-1 CH3-C(CH3)=CH2 −140,4 −7,0 0,5942* Пентен-1 С5H10 −165,2 30,1 0,6405 Гексен-1 С6H12 −139,8 63,5 0,6730 Гептен-1 С7H14 −119,0 93,6 0,6970 Октен-1 С8H16 −101,7 121,3 0,7140
Cлайд 15
 V. Химические свойства алкенов Какой тип химических свойств, связанный с составом, будет характерен для алкенов? ГОРЕНИЕ Горение Составьте уравнение реакции горения а) этилена б) пропилена Вопрос: Каково процентное содержание углерода в алкенах по сравнению с алканами? Как вы считаете, отразится ли это на характере пламени?
V. Химические свойства алкенов Какой тип химических свойств, связанный с составом, будет характерен для алкенов? ГОРЕНИЕ Горение Составьте уравнение реакции горения а) этилена б) пропилена Вопрос: Каково процентное содержание углерода в алкенах по сравнению с алканами? Как вы считаете, отразится ли это на характере пламени?
Cлайд 16
 Вопрос: Какой тип реакции, связанный со строением, будет характерен для всех непредельных углеводородов? Реакция присоединения Что будет происходить с π- связью в результате этой реакции? 2.Реакции присоединения(идут с разрывом π- связи) - характерная реакция для алкенов
Вопрос: Какой тип реакции, связанный со строением, будет характерен для всех непредельных углеводородов? Реакция присоединения Что будет происходить с π- связью в результате этой реакции? 2.Реакции присоединения(идут с разрывом π- связи) - характерная реакция для алкенов
Cлайд 17
 2.1.Присоединение водорода (гидрирование) Составьте уравнение гидрирования пропилена (при нагревании, в присутствии катализатора). Назовите продукт реакции. СН3-СН=СН2 + Н2 СН3-СН2 - СН3 2.2.Присоединение галогенов (галогенирование) Составьте уравнение бромирования пропилена. Назовите продукт реакции. СН3-СН=СН2 + Br2 СН3-СНBr- СН2Br Реакция сопровождается обесцвечиванием бромной воды. Применяется для обнаружения непредельности соединения (π- связи)
2.1.Присоединение водорода (гидрирование) Составьте уравнение гидрирования пропилена (при нагревании, в присутствии катализатора). Назовите продукт реакции. СН3-СН=СН2 + Н2 СН3-СН2 - СН3 2.2.Присоединение галогенов (галогенирование) Составьте уравнение бромирования пропилена. Назовите продукт реакции. СН3-СН=СН2 + Br2 СН3-СНBr- СН2Br Реакция сопровождается обесцвечиванием бромной воды. Применяется для обнаружения непредельности соединения (π- связи)
Cлайд 18
 2.3.Присоединение галогенводородов (гидрогалогенирование) Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова: при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода при двойной связи, а галоген — к менее гидрогенизированному. Правило Марковникова можно объяснить тем, что у несимметричных алкенов (например, в пропилене) электронная плотность распределена неравномерно. Реакция идет по ионному механизму. Правило Марковникова соблюдается при присоединении к несимметричным алкенам и других электрофильных реагентов (H2O, H2SО4, НСl и др.).
2.3.Присоединение галогенводородов (гидрогалогенирование) Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова: при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода при двойной связи, а галоген — к менее гидрогенизированному. Правило Марковникова можно объяснить тем, что у несимметричных алкенов (например, в пропилене) электронная плотность распределена неравномерно. Реакция идет по ионному механизму. Правило Марковникова соблюдается при присоединении к несимметричным алкенам и других электрофильных реагентов (H2O, H2SО4, НСl и др.).
Cлайд 19
 Составьте уравнение гидробромирования пропилена. Назовите продукт реакции. СН3-СН=СН2 + НBr СН3-СНBr - СН3 2.4.Присоединение воды (гидратация) Проходит также по правилу Марковникова Составьте уравнение гидратации пропилена. Назовите продукт реакции (пользуясь Справочной таблицей). СН3-СН=СН2 + НОН СН3-СНОН - СН3
Составьте уравнение гидробромирования пропилена. Назовите продукт реакции. СН3-СН=СН2 + НBr СН3-СНBr - СН3 2.4.Присоединение воды (гидратация) Проходит также по правилу Марковникова Составьте уравнение гидратации пропилена. Назовите продукт реакции (пользуясь Справочной таблицей). СН3-СН=СН2 + НОН СН3-СНОН - СН3
Cлайд 21
 Вопрос: А возможны реакции разложения для этиленовых? Почему? 3. Реакции разложения (дегидрирования) Составьте уравнение дегидрирования пропилена. Дайте название продукту реакции (пользуясь Справочной таблицей) С3Н6 С3Н4 + H2 (при to, в присут. катал-ра) 4. Реакции окисления (ок-ль KMnO4) СН3-СН=СН2+[О]+НОН СН3-СНОН – СН2ОН В ходе реакции происходит обесвечивание раствора перманганата калия. Качественная реакция на напредельность.
Вопрос: А возможны реакции разложения для этиленовых? Почему? 3. Реакции разложения (дегидрирования) Составьте уравнение дегидрирования пропилена. Дайте название продукту реакции (пользуясь Справочной таблицей) С3Н6 С3Н4 + H2 (при to, в присут. катал-ра) 4. Реакции окисления (ок-ль KMnO4) СН3-СН=СН2+[О]+НОН СН3-СНОН – СН2ОН В ходе реакции происходит обесвечивание раствора перманганата калия. Качественная реакция на напредельность.
Cлайд 22
 Из природного газа и нефти Разложение(дегидрирование) алканов СnH2n+2 СnH2n + H2 (to, кат-р) 3. Разложение галогенпроизводных: С2H5Cl С2H4 +KCl (нагревание со спиртовым раствором щелочи) 4. Получение этилена (лабораторный способ) С2H5ОН С2H4 + H2О (при нагревании, в присутствии конц. серной кислоты) VI. Получение алкенов
Из природного газа и нефти Разложение(дегидрирование) алканов СnH2n+2 СnH2n + H2 (to, кат-р) 3. Разложение галогенпроизводных: С2H5Cl С2H4 +KCl (нагревание со спиртовым раствором щелочи) 4. Получение этилена (лабораторный способ) С2H5ОН С2H4 + H2О (при нагревании, в присутствии конц. серной кислоты) VI. Получение алкенов