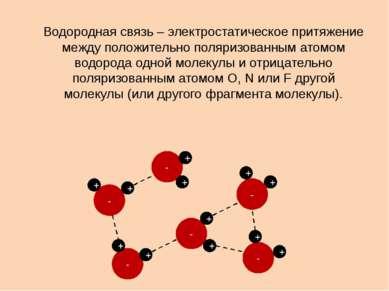
X
Код презентации скопируйте его
Химическая связь (8 класс)
Скачать эту презентациюПрезентация на тему Химическая связь (8 класс)
Скачать эту презентациюCлайд 2
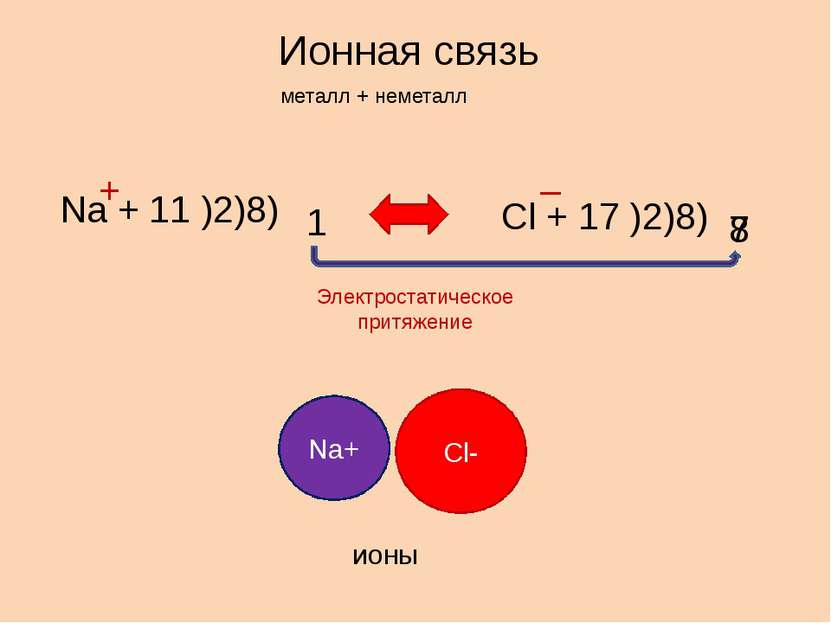
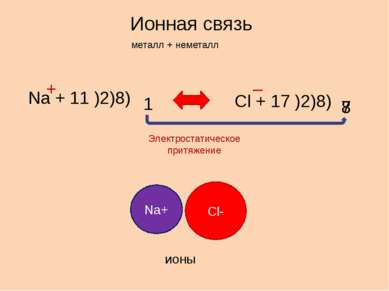 Ионная связь металл + неметалл Na + 11 )2)8) 1 Cl + 17 )2)8) 7 8 + – Электростатическое притяжение Na+ Cl- ионы
Ионная связь металл + неметалл Na + 11 )2)8) 1 Cl + 17 )2)8) 7 8 + – Электростатическое притяжение Na+ Cl- ионы
Cлайд 3
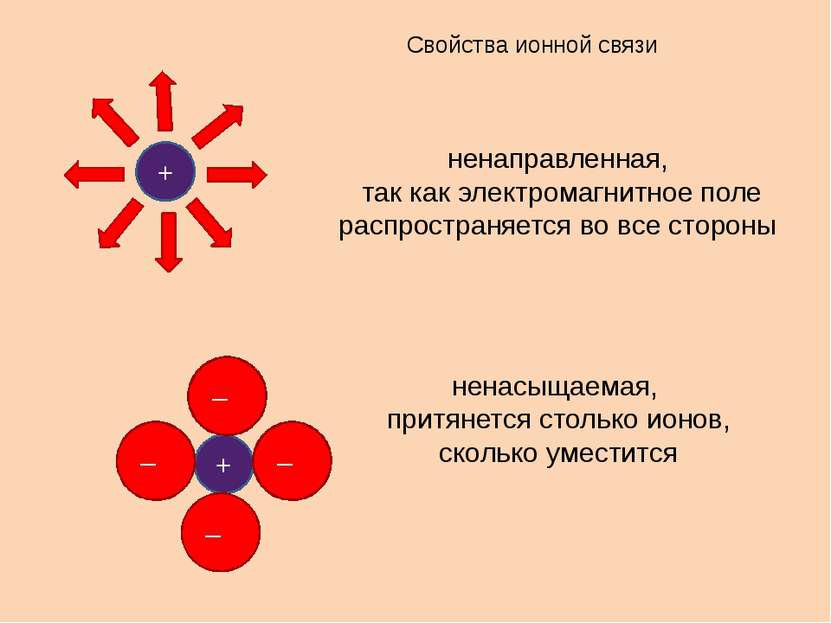
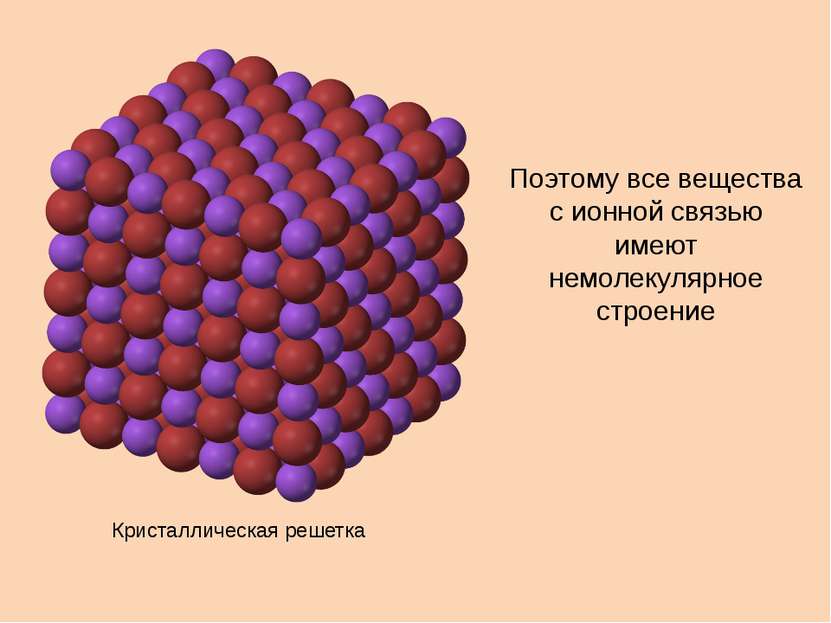
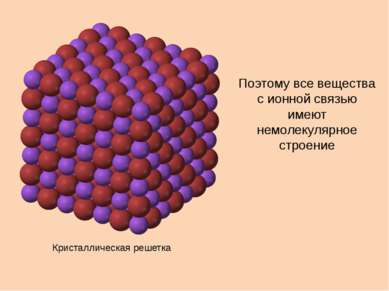
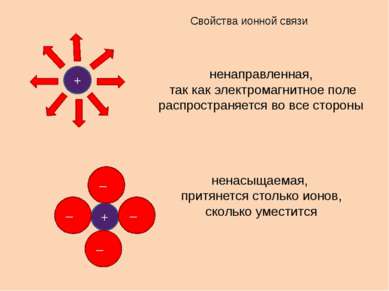 Свойства ионной связи ненаправленная, так как электромагнитное поле распространяется во все стороны ненасыщаемая, притянется столько ионов, сколько уместится + + – – – –
Свойства ионной связи ненаправленная, так как электромагнитное поле распространяется во все стороны ненасыщаемая, притянется столько ионов, сколько уместится + + – – – –
Cлайд 5
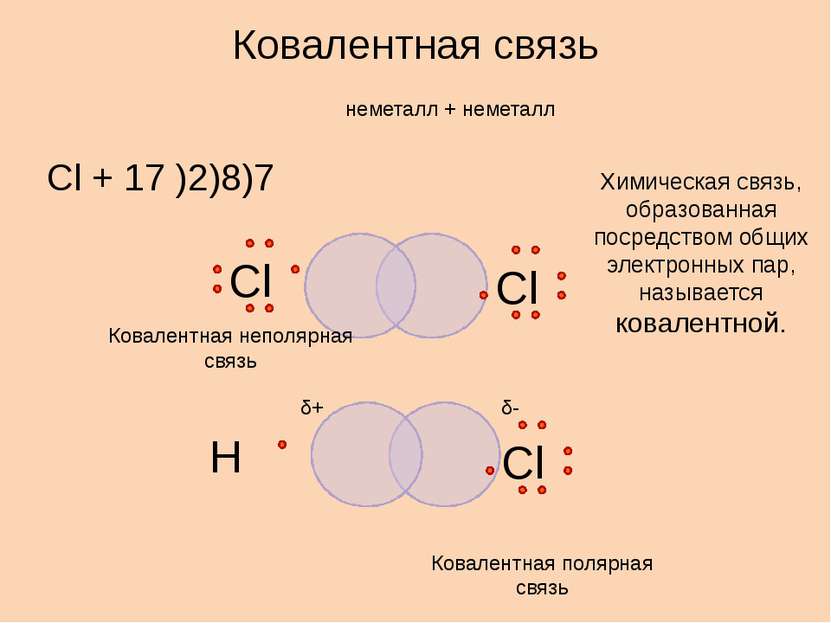
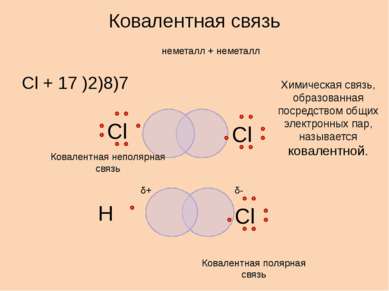 неметалл + неметалл Cl + 17 )2)8)7 Ковалентная связь Химическая связь, образованная посредством общих электронных пар, называется ковалентной. δ+ δ- Ковалентная полярная связь Ковалентная неполярная связь Сl Сl Сl Н
неметалл + неметалл Cl + 17 )2)8)7 Ковалентная связь Химическая связь, образованная посредством общих электронных пар, называется ковалентной. δ+ δ- Ковалентная полярная связь Ковалентная неполярная связь Сl Сl Сl Н
Cлайд 6
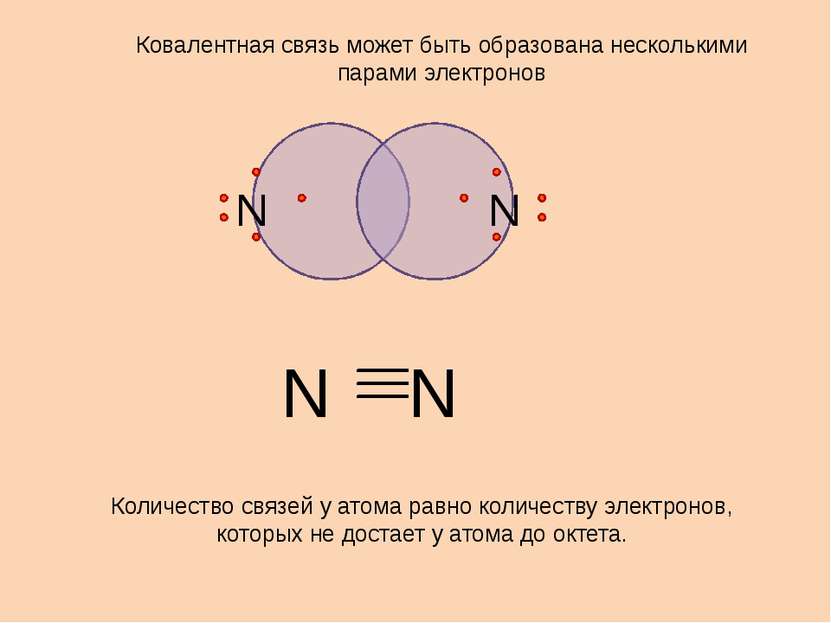
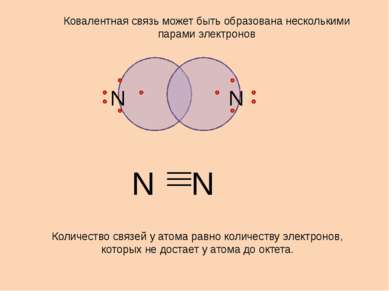 N N Ковалентная связь может быть образована несколькими парами электронов Количество связей у атома равно количеству электронов, которых не достает у атома до октета. N N
N N Ковалентная связь может быть образована несколькими парами электронов Количество связей у атома равно количеству электронов, которых не достает у атома до октета. N N
Cлайд 7
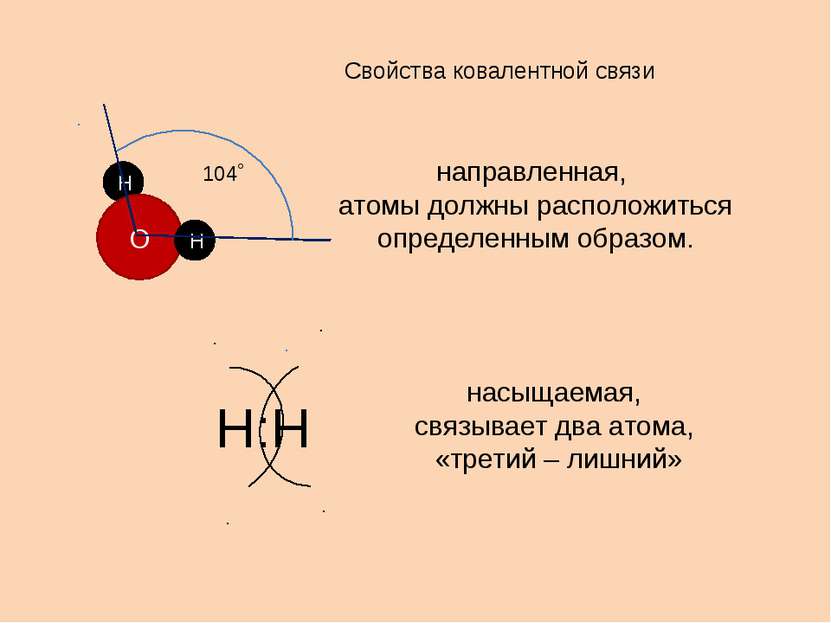
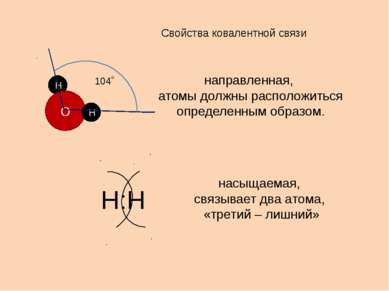 Свойства ковалентной связи направленная, атомы должны расположиться определенным образом. насыщаемая, связывает два атома, «третий – лишний» Н О Н 104˚ Н:Н
Свойства ковалентной связи направленная, атомы должны расположиться определенным образом. насыщаемая, связывает два атома, «третий – лишний» Н О Н 104˚ Н:Н
Cлайд 8
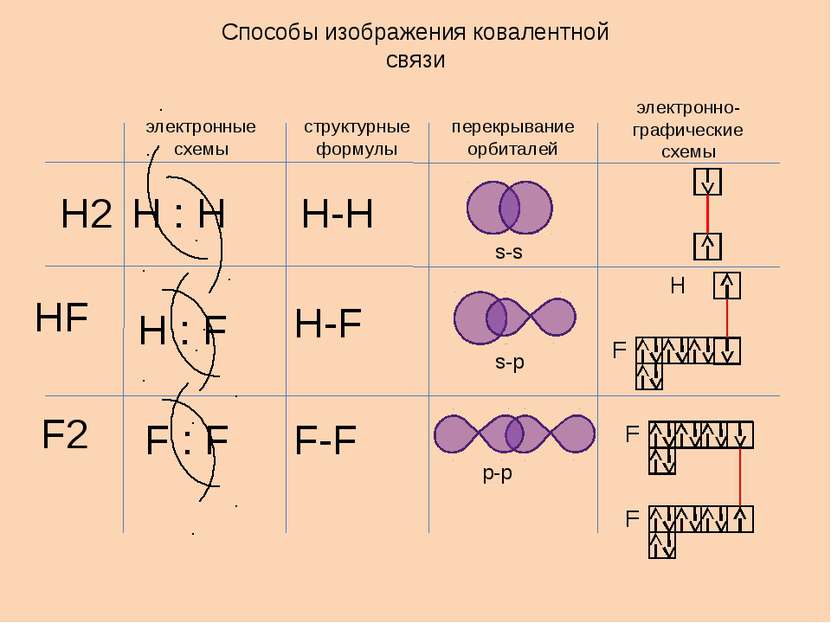
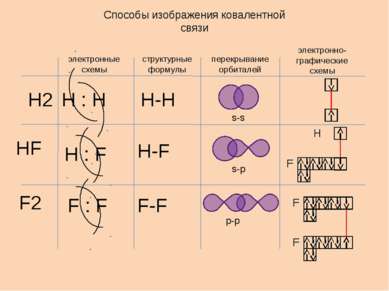 Способы изображения ковалентной связи электронные схемы структурные формулы перекрывание орбиталей электронно-графические схемы Н2 НF F2 Н-F Н-H F-F s-s s-p p-p H Н : Н Н : F F : F F F F
Способы изображения ковалентной связи электронные схемы структурные формулы перекрывание орбиталей электронно-графические схемы Н2 НF F2 Н-F Н-H F-F s-s s-p p-p H Н : Н Н : F F : F F F F
Cлайд 10
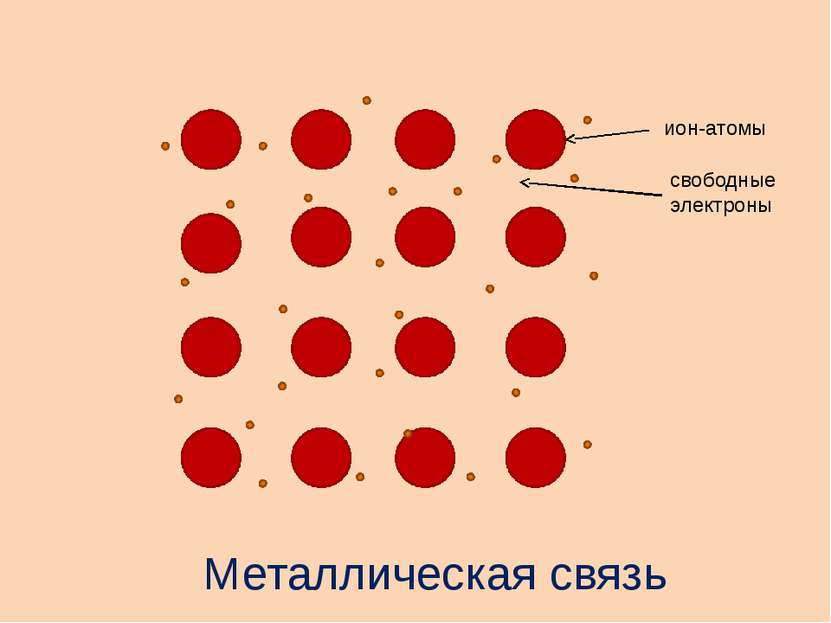
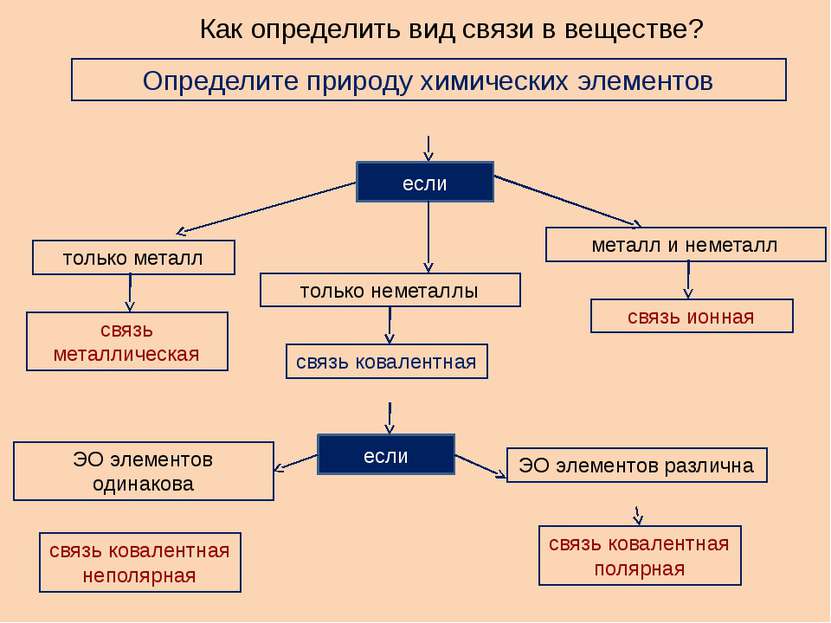
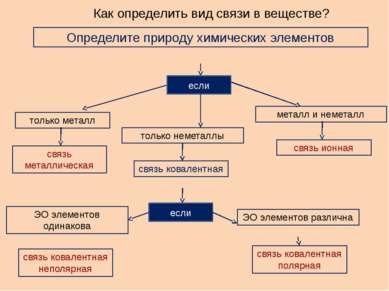 Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл и неметалл если связь металлическая связь ковалентная связь ионная связь ковалентная полярная связь ковалентная неполярная ЭО элементов одинакова ЭО элементов различна
Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл и неметалл если связь металлическая связь ковалентная связь ионная связь ковалентная полярная связь ковалентная неполярная ЭО элементов одинакова ЭО элементов различна