X
Код презентации скопируйте его
Растворение. Растворы (8 класс)
Скачать эту презентациюПрезентация на тему Растворение. Растворы (8 класс)
Скачать эту презентациюCлайд 2
 Значение растворов Для зарождения жизни (океан) Для поддержания жизни (кровь, др.) Для питания растений и животных Для стирки и мытья Для получения химических веществ
Значение растворов Для зарождения жизни (океан) Для поддержания жизни (кровь, др.) Для питания растений и животных Для стирки и мытья Для получения химических веществ
Cлайд 3
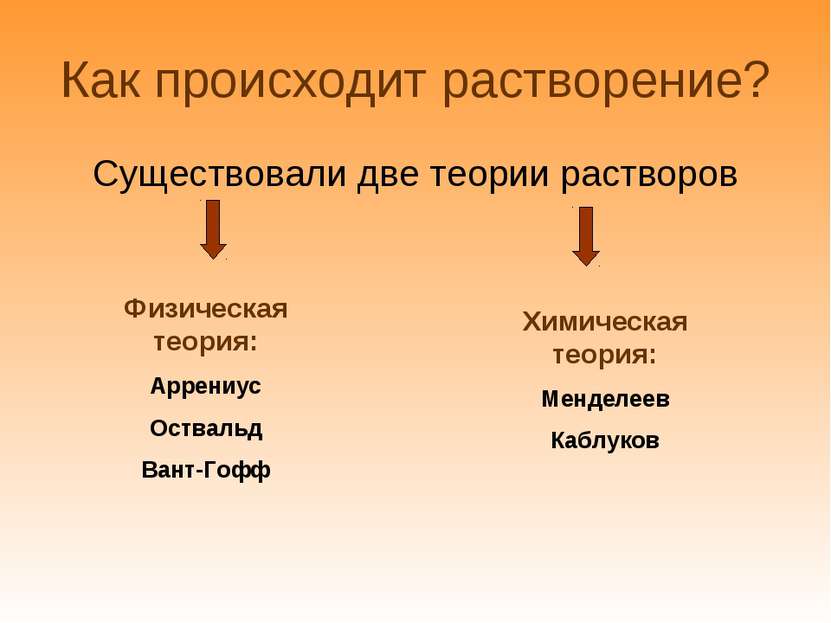
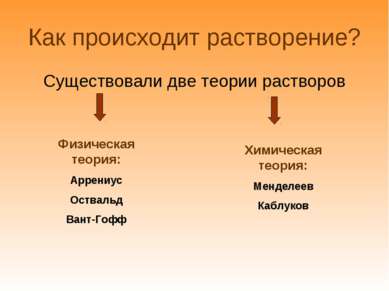 Как происходит растворение? Существовали две теории растворов Физическая теория: Аррениус Оствальд Вант-Гофф Химическая теория: Менделеев Каблуков
Как происходит растворение? Существовали две теории растворов Физическая теория: Аррениус Оствальд Вант-Гофф Химическая теория: Менделеев Каблуков
Cлайд 4
 Физическая теория Растворение – это проникновение частиц одного вещества между частицами другого (растворителя); Это основано на явлении диффузии; Нового вещества в растворе не образуется; Растворение – физическое явление. Раствор – это система из 2-х компонентов: растворителя и растворенного вещества.
Физическая теория Растворение – это проникновение частиц одного вещества между частицами другого (растворителя); Это основано на явлении диффузии; Нового вещества в растворе не образуется; Растворение – физическое явление. Раствор – это система из 2-х компонентов: растворителя и растворенного вещества.
Cлайд 5
 Химическая теория При растворении в воде серной кислоты выделяется тепло; Растворение – это химическое явление; Растворенное вещество вступает в реакцию с водой и образуются гидраты; Гидраты – это продукты взаимодействия воды и раст. вещества; Растворы – это системы из 3-х компонентов: растворителя, растворенного вещества и продуктов их взаимодействия
Химическая теория При растворении в воде серной кислоты выделяется тепло; Растворение – это химическое явление; Растворенное вещество вступает в реакцию с водой и образуются гидраты; Гидраты – это продукты взаимодействия воды и раст. вещества; Растворы – это системы из 3-х компонентов: растворителя, растворенного вещества и продуктов их взаимодействия
Cлайд 6
 Проанализируем теории Правы ли сторонники физической теории? (правы, диффузия идет); Правы ли сторонники химической теории? (правы, хим. реакция идет, тепло выделяется); Какая их теорий глубже рассматривает процесс растворения? (химическая) Обе теории верны, значит их нужно объединить (физико-химическая теория); Вывод: растворение – это физико-химический процесс
Проанализируем теории Правы ли сторонники физической теории? (правы, диффузия идет); Правы ли сторонники химической теории? (правы, хим. реакция идет, тепло выделяется); Какая их теорий глубже рассматривает процесс растворения? (химическая) Обе теории верны, значит их нужно объединить (физико-химическая теория); Вывод: растворение – это физико-химический процесс
Cлайд 7
 Закрепление знаний Какие два процесса происходят при растворении вещества? Как доказать, что растворение – химический процесс? Какая современная теория объясняет процесс растворения? Как называются продукты взаимодействия веществ с водой?
Закрепление знаний Какие два процесса происходят при растворении вещества? Как доказать, что растворение – химический процесс? Какая современная теория объясняет процесс растворения? Как называются продукты взаимодействия веществ с водой?
Cлайд 8
 Доказательства протекания химических процессов Тепловые явления при растворении: Экзотермические (серная кислота + вода) (Щелочь + вода) Эндотермические (поваренная соль + вода) Изменение окраски: Сульфат меди безводный CuSO4 - ,бесцветное вещество Сульфат меди пятиводный (кристаллогидрат) CuSO4 ٠ 5 Н2О вещество синего цвета
Доказательства протекания химических процессов Тепловые явления при растворении: Экзотермические (серная кислота + вода) (Щелочь + вода) Эндотермические (поваренная соль + вода) Изменение окраски: Сульфат меди безводный CuSO4 - ,бесцветное вещество Сульфат меди пятиводный (кристаллогидрат) CuSO4 ٠ 5 Н2О вещество синего цвета
Cлайд 9
 Уточним понятия Гидраты – непрочные соединения вещества с водой, существующие в растворах; Кристаллогидраты – твердые кристаллические вещества, выделенные из воды. При выпаривании они выносят из раствора присоединенную к ним воду, удерживая ее в своей кристаллической решетке CuSO4 ٠ 5 Н2О
Уточним понятия Гидраты – непрочные соединения вещества с водой, существующие в растворах; Кристаллогидраты – твердые кристаллические вещества, выделенные из воды. При выпаривании они выносят из раствора присоединенную к ним воду, удерживая ее в своей кристаллической решетке CuSO4 ٠ 5 Н2О
Cлайд 10
 Растворимость Это масса вещества, способная раствориться в 100 г растворителя (воды) при стандартных условиях. Растворимость зависит от: Природы вещества, т.е. особенностей его строения От температуры
Растворимость Это масса вещества, способная раствориться в 100 г растворителя (воды) при стандартных условиях. Растворимость зависит от: Природы вещества, т.е. особенностей его строения От температуры
Cлайд 11
 Зависимость растворимости от температуры У твердых веществ при повышении температуры растворимость увеличивается (быстрее движутся молекулы, ускоряется диффузия) У газов при повышении температуры растворимость уменьшается (молекулы улетучиваются)
Зависимость растворимости от температуры У твердых веществ при повышении температуры растворимость увеличивается (быстрее движутся молекулы, ускоряется диффузия) У газов при повышении температуры растворимость уменьшается (молекулы улетучиваются)
Cлайд 12
 По растворимости выделяют Хорошо растворимые вещества (в 100г воды растворяется > 1г вещества) Малорастворимые (в 100г воды растворяется < 1г вещества) Нерастворимые (в 100г воды растворяется < 0,01г вещества) Найдите примеры в таблице, стр. 191 Смотри таблицу растворимости
По растворимости выделяют Хорошо растворимые вещества (в 100г воды растворяется > 1г вещества) Малорастворимые (в 100г воды растворяется < 1г вещества) Нерастворимые (в 100г воды растворяется < 0,01г вещества) Найдите примеры в таблице, стр. 191 Смотри таблицу растворимости
Cлайд 13
 Работа с графиками Рассмотрите рисунок 123, стр. 189 Вверх или вниз идут графики? Что обозначено по вертикали и по горизонтали? Какова растворимость хлорида бария при 400 С? А при 900С? Вывод? По графику любого вещества приведите значения его растворимости при разных температурах.
Работа с графиками Рассмотрите рисунок 123, стр. 189 Вверх или вниз идут графики? Что обозначено по вертикали и по горизонтали? Какова растворимость хлорида бария при 400 С? А при 900С? Вывод? По графику любого вещества приведите значения его растворимости при разных температурах.
Cлайд 14
 Виды растворов Ненасыщенные растворы (вещество еще может растворяться при данной температуре) Насыщенные (вещество уже не может растворяться при данной температуре) Пересыщенные (содержится больше вещества, чем может раствориться) Образование и значение пересыщенных растворов см. на стр. 190
Виды растворов Ненасыщенные растворы (вещество еще может растворяться при данной температуре) Насыщенные (вещество уже не может растворяться при данной температуре) Пересыщенные (содержится больше вещества, чем может раствориться) Образование и значение пересыщенных растворов см. на стр. 190