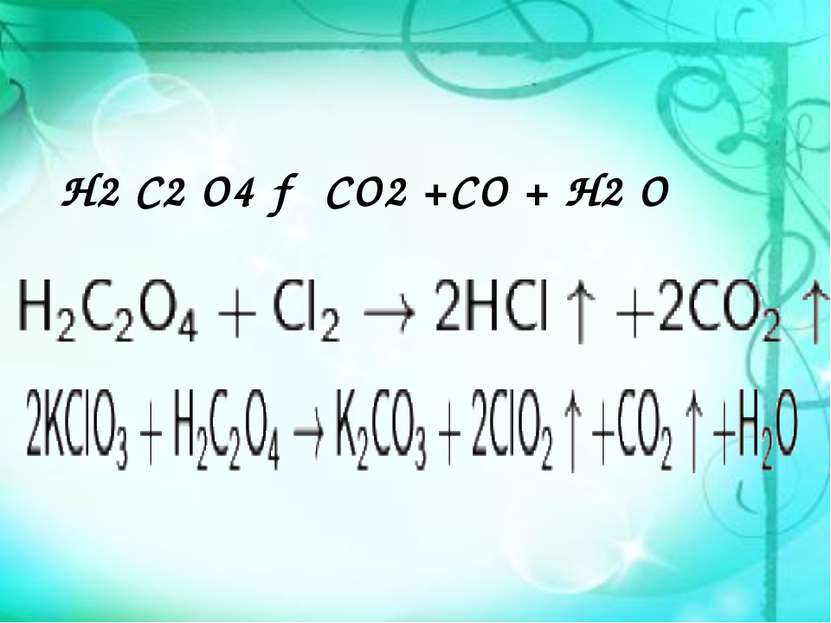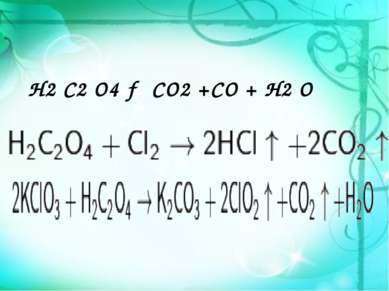X
Код презентации скопируйте его
Щавелевая кислота
Скачать эту презентациюПрезентация на тему Щавелевая кислота
Скачать эту презентациюCлайд 2
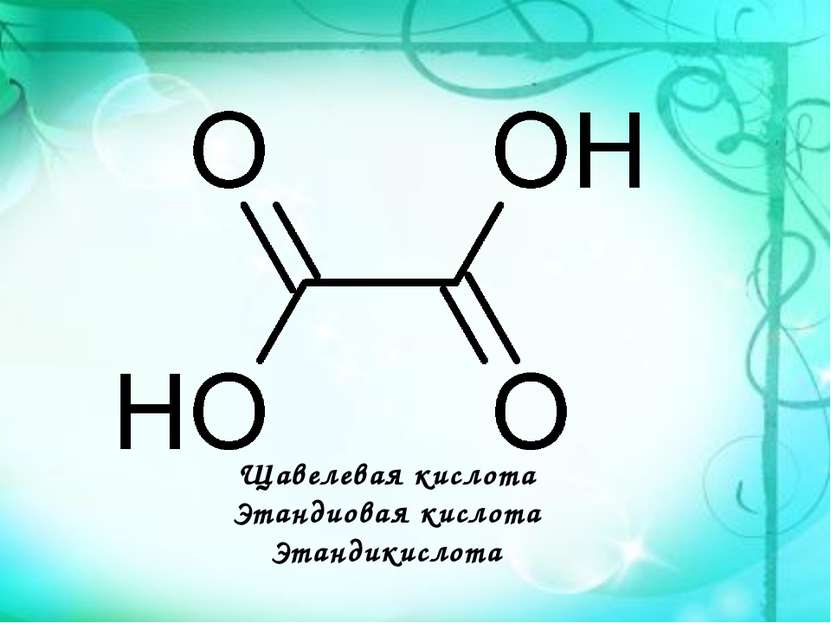
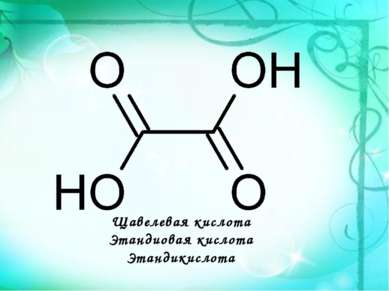 Щавелевая кислота Этандиовая кислота Этандикислота НООС─СООН является простейшим представителем двухосновных карбоновых кислот. Она и ее соли содержатся в листьях растений: щавеля( в виде оксалата калия), ревеня, кислицы.
Щавелевая кислота Этандиовая кислота Этандикислота НООС─СООН является простейшим представителем двухосновных карбоновых кислот. Она и ее соли содержатся в листьях растений: щавеля( в виде оксалата калия), ревеня, кислицы.
Cлайд 4
 Физические свойства Молярнаямасса 90,04 г/моль Внешний вид бесцветные моноклинные кристаллы Плотность 1,36 г/см³ Растворимость в воде (г на 100г) 10 (20 °C); 25 (44,5 °C); 120 (100 °C) Растворимость в этаноле, ацетоне, диэтиловомэфире хорошо растворима Температура плавления 189,5 °C Щавелевая кислота дигидрат (этандиоевая кислота дигидрат) - бесцветное кристаллическое вещество с моноклинной кристаллической решеткой. Ограниченно растворима в воде (9.5г/100мл при 15°C), этаноле, диэтиловом эфире. Не растворима в хлороформе, петролейном эфире, бензоле.
Физические свойства Молярнаямасса 90,04 г/моль Внешний вид бесцветные моноклинные кристаллы Плотность 1,36 г/см³ Растворимость в воде (г на 100г) 10 (20 °C); 25 (44,5 °C); 120 (100 °C) Растворимость в этаноле, ацетоне, диэтиловомэфире хорошо растворима Температура плавления 189,5 °C Щавелевая кислота дигидрат (этандиоевая кислота дигидрат) - бесцветное кристаллическое вещество с моноклинной кристаллической решеткой. Ограниченно растворима в воде (9.5г/100мл при 15°C), этаноле, диэтиловом эфире. Не растворима в хлороформе, петролейном эфире, бензоле.
Cлайд 5
 Щавелевая кислота получена впервые в 1773 г. Совари из кисличной соли, Бергман получил ее окислением сахара азотной кислотой и описал под именем сахарной кислоты; Шееле в 1776 г. установил идентичность обеих кислот. Приготовление Щ. кислоты из сахара было первым случаем получения органического соединения вне организма. Карл Бергман Щавелевая кислота получена впервые в 1773 г. Совари из кисличной соли, Бергман получил ее окислением сахара азотной кислотой и описал под именем сахарной кислоты; Шееле в 1776 г. установил идентичность обеих кислот. Приготовление Щ. кислоты из сахара было первым случаем получения органического соединения вне организма. В свободном состоянии Щ. кислота вообще в природе встречается редко, до сих пор найдена только в грибе Boletus sulfureus; в виде солей находится в растениях и продуктах животного царства.
Щавелевая кислота получена впервые в 1773 г. Совари из кисличной соли, Бергман получил ее окислением сахара азотной кислотой и описал под именем сахарной кислоты; Шееле в 1776 г. установил идентичность обеих кислот. Приготовление Щ. кислоты из сахара было первым случаем получения органического соединения вне организма. Карл Бергман Щавелевая кислота получена впервые в 1773 г. Совари из кисличной соли, Бергман получил ее окислением сахара азотной кислотой и описал под именем сахарной кислоты; Шееле в 1776 г. установил идентичность обеих кислот. Приготовление Щ. кислоты из сахара было первым случаем получения органического соединения вне организма. В свободном состоянии Щ. кислота вообще в природе встречается редко, до сих пор найдена только в грибе Boletus sulfureus; в виде солей находится в растениях и продуктах животного царства.
Cлайд 6
 Впервые щавелевая кислота синтезирована в 1824 году немецким химиком Фридрихом Вёлером из дициана.
Впервые щавелевая кислота синтезирована в 1824 году немецким химиком Фридрихом Вёлером из дициана.
Cлайд 7
 Химические свойства Щаве левая кислота обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой кислоты называются оксалатами. Щавелевая кислота (или оксалат-ион C2O42−) является восстановителем (обесцвечивает раствор KMnO4). Известны молекулярные соединения щавелевой кислоты с кислыми оксалатами, например так называемая кисличная соль KHC2O4 x H2O4O, и комплексные соединения оксалатов с переходными металлами. например K2[Fe(C2O4)2].
Химические свойства Щаве левая кислота обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой кислоты называются оксалатами. Щавелевая кислота (или оксалат-ион C2O42−) является восстановителем (обесцвечивает раствор KMnO4). Известны молекулярные соединения щавелевой кислоты с кислыми оксалатами, например так называемая кисличная соль KHC2O4 x H2O4O, и комплексные соединения оксалатов с переходными металлами. например K2[Fe(C2O4)2].
Cлайд 9
 Щавелевую кислоту получают • из окиси углерода игидроксиданатрия промежуточным получением формиата натрия, при нагревании которого образуется оксалат натрия, подкисляя который, выделяют щавелевую кислоту • окислением углеводов, спиртов или гликолей смесью серной и азотной кислот в присутствии V2O5. •окислением этилена или ацетилена азотной кислотой в присутствии PdCl2илиPd(NO3)2
Щавелевую кислоту получают • из окиси углерода игидроксиданатрия промежуточным получением формиата натрия, при нагревании которого образуется оксалат натрия, подкисляя который, выделяют щавелевую кислоту • окислением углеводов, спиртов или гликолей смесью серной и азотной кислот в присутствии V2O5. •окислением этилена или ацетилена азотной кислотой в присутствии PdCl2илиPd(NO3)2
Cлайд 10
 Широкоприменяют: • в текстильной и кожевенной промышленности в качестве протравы; • входит в составы бытовых и промышленных чистящих средств, средств для очистки металлических поверхностей от оксидных пленок; • как инсектицид; • в фотографии как восстановитель; • как реагент для обработки сточных вод; • как осаждающий агент при выделении редкоземельных металлов и др.
Широкоприменяют: • в текстильной и кожевенной промышленности в качестве протравы; • входит в составы бытовых и промышленных чистящих средств, средств для очистки металлических поверхностей от оксидных пленок; • как инсектицид; • в фотографии как восстановитель; • как реагент для обработки сточных вод; • как осаждающий агент при выделении редкоземельных металлов и др.