X
Код презентации скопируйте его
Проверочная работа
Скачать эту презентациюПрезентация на тему Проверочная работа
Скачать эту презентациюCлайд 1
 Проверочная работа 1 вариант Электронное строение атомов бора и фосфора Укажите число электронов на внешнем энергетическом уровне атома серы Укажите число электронных уровней у атома бария Наиболее выраженными металлическими свойствами обладает: магний или стронций Наиболее выраженными неметаллическими свойствами обладает: углерод или фтор 2 вариант Электронное строение атомов азота и алюминия Укажите число электронов на внешнем энергетическом уровне атома хлора Укажите число электронных уровней у атома лития Наименее выраженными неметаллическими свойствами обладает: азот или мышьяк Наименее выраженными металлическими свойствами обладает: натрий или алюминий
Проверочная работа 1 вариант Электронное строение атомов бора и фосфора Укажите число электронов на внешнем энергетическом уровне атома серы Укажите число электронных уровней у атома бария Наиболее выраженными металлическими свойствами обладает: магний или стронций Наиболее выраженными неметаллическими свойствами обладает: углерод или фтор 2 вариант Электронное строение атомов азота и алюминия Укажите число электронов на внешнем энергетическом уровне атома хлора Укажите число электронных уровней у атома лития Наименее выраженными неметаллическими свойствами обладает: азот или мышьяк Наименее выраженными металлическими свойствами обладает: натрий или алюминий
Cлайд 3
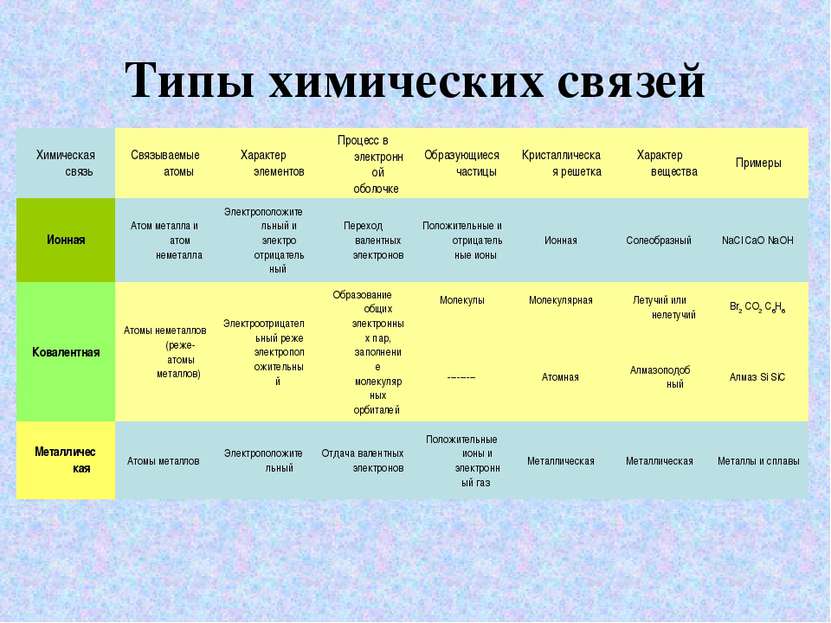
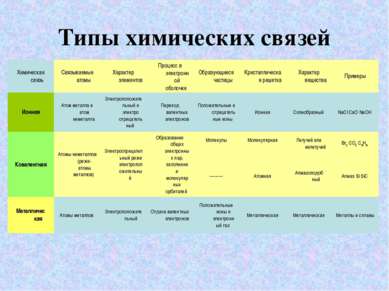
 Ковалентная связь Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером. Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи. Ряд электроотрицательностей
Ковалентная связь Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером. Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи. Ряд электроотрицательностей
Cлайд 4
 Ионная связь Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента. Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов. При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион. Схема образования ионной связи.
Ионная связь Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента. Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов. При отдаче электронов образуется положительно заряженный ион-катион, при присоединении-отрицательный-анион. Схема образования ионной связи.
Cлайд 5
 Металлическая связь СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ. Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом.
Металлическая связь СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ. Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла). Свободные электроны иногда называют электронным газом.