X
Код презентации скопируйте его
Подгруппа Селена
Скачать эту презентациюПрезентация на тему Подгруппа Селена
Скачать эту презентациюCлайд 1
 Т 3 Л 7 Подгруппа Селена Селен Sе, теллур Те и полоний Ро р-элементы с конфигурацией валентных электронов s2р4. В образование связей у селена и его аналогов вовлекаются непарные электроны, а также одна или две электронные пары. Поэтому у р-элементов VI группы наблюдаются четные степени окисления: –2, +2, +4, +6.
Т 3 Л 7 Подгруппа Селена Селен Sе, теллур Те и полоний Ро р-элементы с конфигурацией валентных электронов s2р4. В образование связей у селена и его аналогов вовлекаются непарные электроны, а также одна или две электронные пары. Поэтому у р-элементов VI группы наблюдаются четные степени окисления: –2, +2, +4, +6.
Cлайд 2
 В подгруппе селена, как и в других подгруппах р-элементов, с увеличением размеров атомов наблюдается общая тенденция к увеличению характерного координационного числа. Так, для серы и селена наиболее типичны координационные числа 3 и 4, а для теллура 6, иногда даже 7 и 8. По содержанию на Земле селен и теллур рассеянные, а полоний — редкий элементы. Природный селен состоит из шести устойчивых изотопов, теллур – из семи. Получены также радиоактивные изотопы селена и теллура. Полоний стабильных изотопов не имеет, для него известно свыше двадцати радиоактивных изотопов.
В подгруппе селена, как и в других подгруппах р-элементов, с увеличением размеров атомов наблюдается общая тенденция к увеличению характерного координационного числа. Так, для серы и селена наиболее типичны координационные числа 3 и 4, а для теллура 6, иногда даже 7 и 8. По содержанию на Земле селен и теллур рассеянные, а полоний — редкий элементы. Природный селен состоит из шести устойчивых изотопов, теллур – из семи. Получены также радиоактивные изотопы селена и теллура. Полоний стабильных изотопов не имеет, для него известно свыше двадцати радиоактивных изотопов.
Cлайд 3
 Собственные минералы селена и теллура встречаются редко. Чаще всего Sе и Те сопутствуют самородной сере и в виде селенидов и теллуридов присутствуют в сульфидных рудах. Полоний содержится в урановых и ториевых минералах как продукт распада радиоактивного ряда урана.
Собственные минералы селена и теллура встречаются редко. Чаще всего Sе и Те сопутствуют самородной сере и в виде селенидов и теллуридов присутствуют в сульфидных рудах. Полоний содержится в урановых и ториевых минералах как продукт распада радиоактивного ряда урана.
Cлайд 4
 Простые вещества. В ряду O—S—Sе—Te—Po тип устойчивых молекул изменяется: от двухатомных кислорода О2, затем циклических S8 и Se8; и цепных молекул Sе∞ и Te∞ до металлического кристалла Po. Как и сера, селен имеет полиморфные модификации. Наиболее устойчив, гексагональный или серый селен - хрупкие кристаллы с металлическим блеском. Его кристаллы образованы зигзагообразными цепями Sе∞. При быстром охлаждении жидкого селена получается красно-коричневая стекловидная (аморфная) модификация. Она образована неупорядоченно расположенными молекулами Sе∞, разной длины. Кристаллические разновидности красного селена состоят из циклических молекул Sе8, подобных S8.
Простые вещества. В ряду O—S—Sе—Te—Po тип устойчивых молекул изменяется: от двухатомных кислорода О2, затем циклических S8 и Se8; и цепных молекул Sе∞ и Te∞ до металлического кристалла Po. Как и сера, селен имеет полиморфные модификации. Наиболее устойчив, гексагональный или серый селен - хрупкие кристаллы с металлическим блеском. Его кристаллы образованы зигзагообразными цепями Sе∞. При быстром охлаждении жидкого селена получается красно-коричневая стекловидная (аморфная) модификация. Она образована неупорядоченно расположенными молекулами Sе∞, разной длины. Кристаллические разновидности красного селена состоят из циклических молекул Sе8, подобных S8.
Cлайд 5
 Серый селен — полупроводник ( Е = 1,8 эВ). Его электрическая проводимость резко (примерно в 1000 раз) возрастает при освещении. Полупроводниковые свойства проявляет также жидкий селен. На границе селена с металлическим проводником образуется запорный слой – участок, способный пропускать электрический ток только в одном направлении. Селен применяется в полупроводниковой технике для изготовления выпрямителей фотоэлементов с запорным слоем.
Серый селен — полупроводник ( Е = 1,8 эВ). Его электрическая проводимость резко (примерно в 1000 раз) возрастает при освещении. Полупроводниковые свойства проявляет также жидкий селен. На границе селена с металлическим проводником образуется запорный слой – участок, способный пропускать электрический ток только в одном направлении. Селен применяется в полупроводниковой технике для изготовления выпрямителей фотоэлементов с запорным слоем.
Cлайд 6
 Устойчивые модификации теллура образованы зигзагообразными молекулами Te∞. Гексагональная модификация теллура — серебристо-белое металлоподобное кристаллическое вещество. Однако он хрупок, легко растирается в порошок. Его электрическая проводимость незначительна, но при освещении увеличивается, т. е. теллур — полупроводник ( Е = 0,35 эВ). Аморфный теллур (коричневого цвета) менее устойчив, чем аморфный селен, и при 25 оС переходит в кристаллический.
Устойчивые модификации теллура образованы зигзагообразными молекулами Te∞. Гексагональная модификация теллура — серебристо-белое металлоподобное кристаллическое вещество. Однако он хрупок, легко растирается в порошок. Его электрическая проводимость незначительна, но при освещении увеличивается, т. е. теллур — полупроводник ( Е = 0,35 эВ). Аморфный теллур (коричневого цвета) менее устойчив, чем аморфный селен, и при 25 оС переходит в кристаллический.
Cлайд 7
 Будучи изоморфными, гексагональные селен и теллур образуют между собой непрерывный ряд твердых растворов. При высоких температурах пары селена и теллура состоят из парамагнитных молекул Sе2 и Те2. При понижении температуры они полимеризуются в молекулы Э4, Э6 и Э8. Селен, теллур и их соединения очень ядовиты.
Будучи изоморфными, гексагональные селен и теллур образуют между собой непрерывный ряд твердых растворов. При высоких температурах пары селена и теллура состоят из парамагнитных молекул Sе2 и Те2. При понижении температуры они полимеризуются в молекулы Э4, Э6 и Э8. Селен, теллур и их соединения очень ядовиты.
Cлайд 8
 П о л о н и й - мягкий металл серебристо-белого цвета, по физическим свойствам напоминающий висмут и свинец (Тпл. 254 0С). Как видно, в ряду O—S—Sе—Te—Po структурные изменения и ослабление ковалентности связи Э—Э соответствуют изменению физических свойств; так, кислород и сера — диэлектрики, селен и теллур — полупроводники, а полоний обладает металлической проводимостью.
П о л о н и й - мягкий металл серебристо-белого цвета, по физическим свойствам напоминающий висмут и свинец (Тпл. 254 0С). Как видно, в ряду O—S—Sе—Te—Po структурные изменения и ослабление ковалентности связи Э—Э соответствуют изменению физических свойств; так, кислород и сера — диэлектрики, селен и теллур — полупроводники, а полоний обладает металлической проводимостью.
Cлайд 9
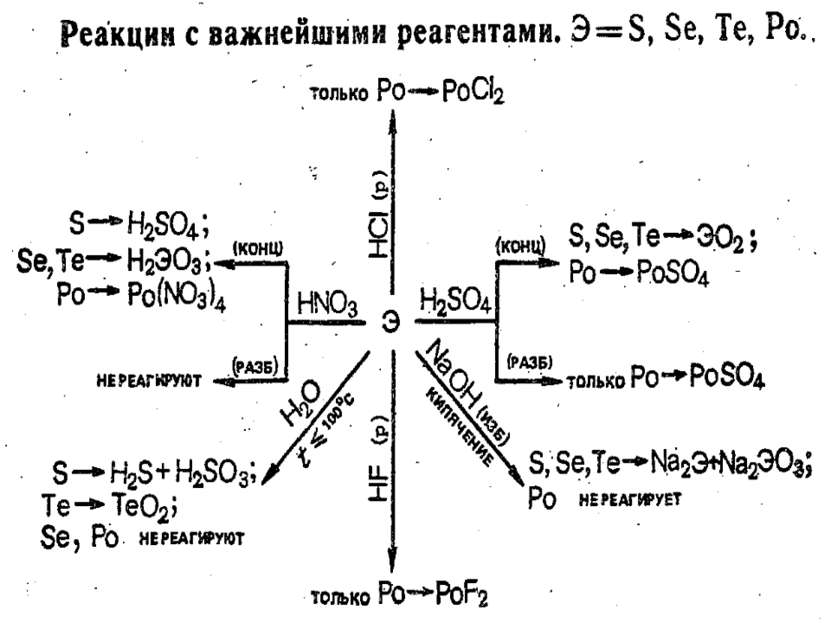
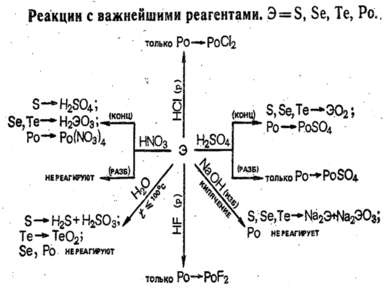
 В ряду O—S—Sе—Te—Po уменьшается окислительная и возрастает восстановительная активность, о чем, в частности, свидетельствует сопоставление их электродных потенциалов. Селен с водой и разбавленными кислотами не реагирует (только при Т 100 °С), в то время как теллур медленно при н.у. окисляется водой: Те + 2Н2O = ТеO2 + 2Н2 Полоний реагирует с соляной кислотой как типичный металл, с водой при Т 100 °С: Ро + 2НСl = РоСl2 + Н2
В ряду O—S—Sе—Te—Po уменьшается окислительная и возрастает восстановительная активность, о чем, в частности, свидетельствует сопоставление их электродных потенциалов. Селен с водой и разбавленными кислотами не реагирует (только при Т 100 °С), в то время как теллур медленно при н.у. окисляется водой: Те + 2Н2O = ТеO2 + 2Н2 Полоний реагирует с соляной кислотой как типичный металл, с водой при Т 100 °С: Ро + 2НСl = РоСl2 + Н2
Cлайд 10
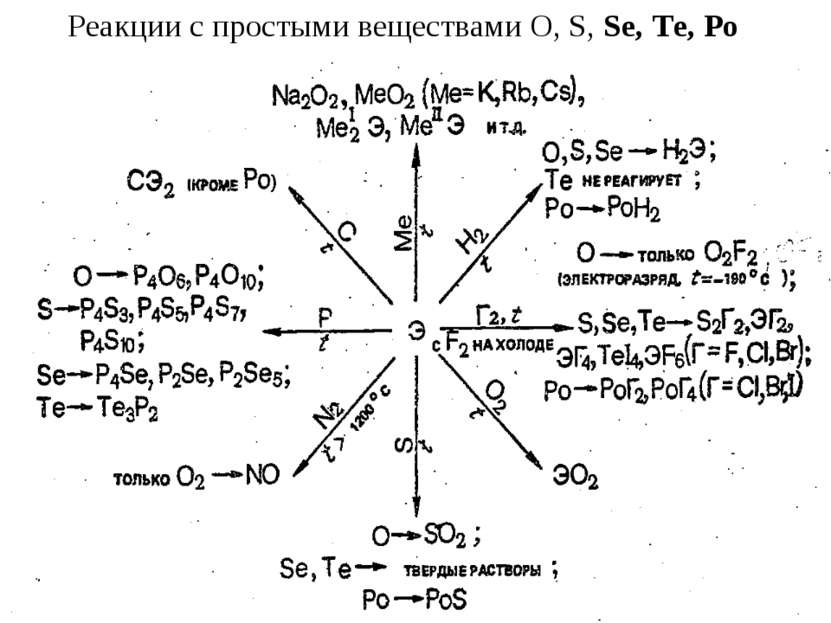
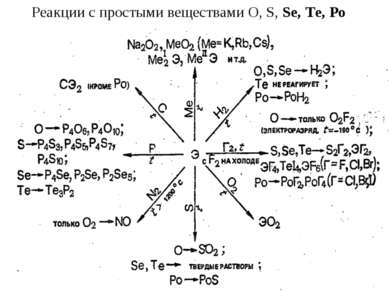
 S, Se, Te с кислотами-неокислителями не реагируют. При нагревании Se, Te и Po довольно легко окисляются кислородом и галогенами, при сплавлении взаимодействуют с металлами. Подобно другим неметаллам Sе и Те окисляются концентрированной HNO3 до кислот Se + 4HNO3 = H2SeO3 + 4NO2 + H2O. Полоний же в этих условиях образует солеподобные соединения: Po + 8HNO3 = Po(NO3)4 + 4NO2 + 4H2O. При кипячении в щелочных растворах селен и теллур, подобно сере, диспропорционируют: 0 +4 -2 3Э + 6КОН = К2ЭО3 + 2K2Э + 3Н2O
S, Se, Te с кислотами-неокислителями не реагируют. При нагревании Se, Te и Po довольно легко окисляются кислородом и галогенами, при сплавлении взаимодействуют с металлами. Подобно другим неметаллам Sе и Те окисляются концентрированной HNO3 до кислот Se + 4HNO3 = H2SeO3 + 4NO2 + H2O. Полоний же в этих условиях образует солеподобные соединения: Po + 8HNO3 = Po(NO3)4 + 4NO2 + 4H2O. При кипячении в щелочных растворах селен и теллур, подобно сере, диспропорционируют: 0 +4 -2 3Э + 6КОН = К2ЭО3 + 2K2Э + 3Н2O
Cлайд 11
 Селен и теллур извлекают из отходов производства серной кислоты, накапливающихся в пылеуловителях, и из анодного шлама, образуемого при электролитической очистке цветных металлов. Для этого отходы и шлам окисляют, например, с помощью МnO2, образующиеся при этом SеO2 и ТеO2 разделяют и восстанавливают диоксидом серы: ЭO2 + 2SO2 = Э + 2SO3 Как полупроводники селен и теллур используются для изготовления фотоэлементов оптических и сигнальных приборов. Кроме того, селен используют в стекольной промышленности для получения стекол рубинового цвета и др. Изотоп 210Ро (Т 1/2 = 138,4 дня) применяют как источник -частиц.
Селен и теллур извлекают из отходов производства серной кислоты, накапливающихся в пылеуловителях, и из анодного шлама, образуемого при электролитической очистке цветных металлов. Для этого отходы и шлам окисляют, например, с помощью МnO2, образующиеся при этом SеO2 и ТеO2 разделяют и восстанавливают диоксидом серы: ЭO2 + 2SO2 = Э + 2SO3 Как полупроводники селен и теллур используются для изготовления фотоэлементов оптических и сигнальных приборов. Кроме того, селен используют в стекольной промышленности для получения стекол рубинового цвета и др. Изотоп 210Ро (Т 1/2 = 138,4 дня) применяют как источник -частиц.
Cлайд 12
 Соединения со степенью окисления селена, теллура и полония -2. У селена, теллура и полония степень окисления -2 проявляется соответственно в селенидах, теллуридах и полонидах — соединениях с менее электроотрицательными, чем они сами, элементами. В этих типах соединений проявляется аналогия элементов селена и теллура с кислородом и серой. Например:
Соединения со степенью окисления селена, теллура и полония -2. У селена, теллура и полония степень окисления -2 проявляется соответственно в селенидах, теллуридах и полонидах — соединениях с менее электроотрицательными, чем они сами, элементами. В этих типах соединений проявляется аналогия элементов селена и теллура с кислородом и серой. Например:
Cлайд 13
 По методам получения, кристаллической структуре, растворимости и химическим свойствам селениды и теллуриды аналогичны сульфидам. Среди них имеются основные (К2Sе, К2Те) и кислотные (СSе2, СТе2) соединения: К2Sе + H2O КSеН + КОН; основный СSе2 + 3H2O = H2СO3 + 2 H2Sе кислотный Вследствие больших размеров и низкой электроотрицательности атомов Sе-2 и Те-2 в качестве лигандов выступают редко. Поэтому реакции между селенидами и тем более между теллуридами разной химической природы не характерны.
По методам получения, кристаллической структуре, растворимости и химическим свойствам селениды и теллуриды аналогичны сульфидам. Среди них имеются основные (К2Sе, К2Те) и кислотные (СSе2, СТе2) соединения: К2Sе + H2O КSеН + КОН; основный СSе2 + 3H2O = H2СO3 + 2 H2Sе кислотный Вследствие больших размеров и низкой электроотрицательности атомов Sе-2 и Те-2 в качестве лигандов выступают редко. Поэтому реакции между селенидами и тем более между теллуридами разной химической природы не характерны.
Cлайд 14
 В соответствии с усилением металлических признаков простых веществ в ряду O—S—Sе—Te—Po возрастает склонность к образованию соединений типа интерметаллических. Большая группа селенидов и теллуридов (ZnSe, РbSe, CdTe, HgTe, PbTe и др.) — полупроводники. Наибольшее применение в качестве полупроводников имеют селениды и теллуриды элементов подгруппы цинка.
В соответствии с усилением металлических признаков простых веществ в ряду O—S—Sе—Te—Po возрастает склонность к образованию соединений типа интерметаллических. Большая группа селенидов и теллуридов (ZnSe, РbSe, CdTe, HgTe, PbTe и др.) — полупроводники. Наибольшее применение в качестве полупроводников имеют селениды и теллуриды элементов подгруппы цинка.
Cлайд 15
 Селенид водорода H2Sе и теллурид водорода H2Те в обычных условиях — газы с очень неприятным запахом, по структуре и свойствам напоминают Н2S. В ряду H2O—H2S—H2Sе—H2Te по мере увеличения длины и уменьшения энергии связи ЭН устойчивость молекул падает. В отличие от оксида и сульфида водорода селенид и теллурид водорода — эндотермические соединения ( Go298 О). При нагревании H2Te легко распадается, а H2Ро разлагается уже при получении.
Селенид водорода H2Sе и теллурид водорода H2Те в обычных условиях — газы с очень неприятным запахом, по структуре и свойствам напоминают Н2S. В ряду H2O—H2S—H2Sе—H2Te по мере увеличения длины и уменьшения энергии связи ЭН устойчивость молекул падает. В отличие от оксида и сульфида водорода селенид и теллурид водорода — эндотермические соединения ( Go298 О). При нагревании H2Te легко распадается, а H2Ро разлагается уже при получении.
Cлайд 16
 В воде Н2Sе и Н2Те растворяются лучше, чем Н2S. Их растворы — слабые кислоты. В ряду Н2O—Н2S—Н2Sе—Н2Те сила кислот возрастает, что объясняется уменьшением энергии связи ЭН. В этом же ряду растет восстановительная способность Н2Э. Для Н2Sе известны и кислые, и средние соли, для Н2Те – только средние. Существуют полиселениды и полителлуриды М2+Эn (n=2-6), но Н2Эn не получены. Селенид водорода и его производные я д о в и т ы!
В воде Н2Sе и Н2Те растворяются лучше, чем Н2S. Их растворы — слабые кислоты. В ряду Н2O—Н2S—Н2Sе—Н2Те сила кислот возрастает, что объясняется уменьшением энергии связи ЭН. В этом же ряду растет восстановительная способность Н2Э. Для Н2Sе известны и кислые, и средние соли, для Н2Те – только средние. Существуют полиселениды и полителлуриды М2+Эn (n=2-6), но Н2Эn не получены. Селенид водорода и его производные я д о в и т ы!
Cлайд 17
 Соединении селена (II), теллура(II) и полония (II). Из производных Sе(II), Те(II) и Ро(II) лучше других изучены галогениды. Относительная устойчивость соединений Э(II) в ряду О—S—Sе—Те—Ро увеличивается. В то время как для S и Sе более характерны галогениды типа Э2Наl2, для теллура и полония они неизвестны, но устойчивы дигалогениды ТеНаl2 и РоНаl2. Галогениды Sе(II) — кислотные соединения, а аналогичные производные Те(II), в особенности Ро(II), по свойствам приближаются к солям.
Соединении селена (II), теллура(II) и полония (II). Из производных Sе(II), Те(II) и Ро(II) лучше других изучены галогениды. Относительная устойчивость соединений Э(II) в ряду О—S—Sе—Те—Ро увеличивается. В то время как для S и Sе более характерны галогениды типа Э2Наl2, для теллура и полония они неизвестны, но устойчивы дигалогениды ТеНаl2 и РоНаl2. Галогениды Sе(II) — кислотные соединения, а аналогичные производные Те(II), в особенности Ро(II), по свойствам приближаются к солям.
Cлайд 18
 Для химии Sе (II) и Те(II) очень характерны реакции диспропорцио-нирования, протекающие при нагревании и гидролизе галогенидов: +2 t +4 0 2TeCl2 = TeCl4 + Te +2 0 +4 2SеCl2 + 3H2O = Sе + H2SеO3 + 4HCl
Для химии Sе (II) и Те(II) очень характерны реакции диспропорцио-нирования, протекающие при нагревании и гидролизе галогенидов: +2 t +4 0 2TeCl2 = TeCl4 + Te +2 0 +4 2SеCl2 + 3H2O = Sе + H2SеO3 + 4HCl
Cлайд 19
 Соединения селена (IV), теллура (IV) и полония (IV). Степень окисления +4 селена, теллура и полония проявляется в диоксидах ЭО2, тетрагалогенидах ЭНаl4, оксодигалогенидах ЭОНаl2, а также соответствующих анионных комплексах, например, типа [ЭО3]2-, [ЭНаl6]2-. Для полония (IV), кроме того, характерны солеподобные соединения типа Ро(SO4)2, Ро(NO3)4. В отличие от серы у селена и его аналогов диоксиды ЭO2 в обычных условиях полимерные соединения.
Соединения селена (IV), теллура (IV) и полония (IV). Степень окисления +4 селена, теллура и полония проявляется в диоксидах ЭО2, тетрагалогенидах ЭНаl4, оксодигалогенидах ЭОНаl2, а также соответствующих анионных комплексах, например, типа [ЭО3]2-, [ЭНаl6]2-. Для полония (IV), кроме того, характерны солеподобные соединения типа Ро(SO4)2, Ро(NO3)4. В отличие от серы у селена и его аналогов диоксиды ЭO2 в обычных условиях полимерные соединения.
Cлайд 20
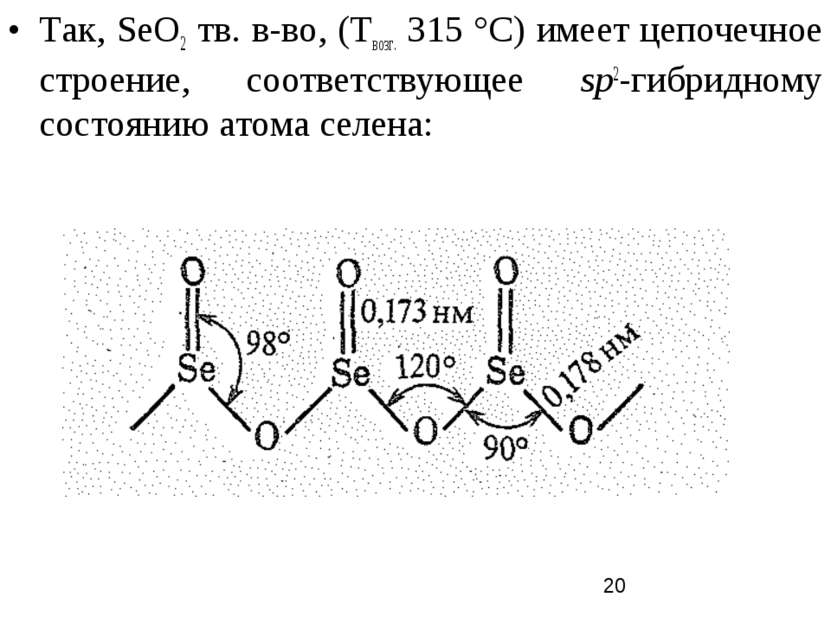
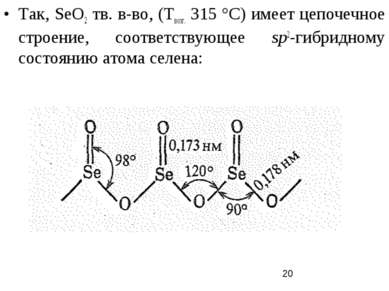 Так, SеO2 тв. в-во, (Твозг. 315 °С) имеет цепочечное строение, соответствующее sp2-гибридному состоянию атома селена:
Так, SеO2 тв. в-во, (Твозг. 315 °С) имеет цепочечное строение, соответствующее sp2-гибридному состоянию атома селена:
Cлайд 21
 В ряду SеO2—ТеO2—РоO2 отчетливо наблюдается ослабление кислотных свойств. Так, SеO2 легко растворяется в воде, образуя селенистую кислоту Н2SеО3 (K1 = 2 10-3): SеO2 + Н2O = Н2SеО3 (S, Se)
В ряду SеO2—ТеO2—РоO2 отчетливо наблюдается ослабление кислотных свойств. Так, SеO2 легко растворяется в воде, образуя селенистую кислоту Н2SеО3 (K1 = 2 10-3): SеO2 + Н2O = Н2SеО3 (S, Se)
Cлайд 22
 ТеО2 в воде не растворяется, но взаимодействует с растворами щелочей: ТеО2 + 2КОН + 2Н2О = К2[Те(ОH)6] РоО2 с щелочами реагирует только при сплавлении ЭО2 + КОН = К2ЭО3 + Н2О (Э = Se, Te, Po) Производные ЭО32- — называются селенитами, теллуритами и полонитами. Po с кислотами взаимодействует как основный оксид: РоО2 + 2Н2SО4 = Ро(SО4)2 + 2H2O
ТеО2 в воде не растворяется, но взаимодействует с растворами щелочей: ТеО2 + 2КОН + 2Н2О = К2[Те(ОH)6] РоО2 с щелочами реагирует только при сплавлении ЭО2 + КОН = К2ЭО3 + Н2О (Э = Se, Te, Po) Производные ЭО32- — называются селенитами, теллуритами и полонитами. Po с кислотами взаимодействует как основный оксид: РоО2 + 2Н2SО4 = Ро(SО4)2 + 2H2O
Cлайд 23
 В отличие от Н2SО3 триоксоселенат (IV) водорода Н2SеО3 выделен в свободном состоянии. Это — твердое вещество, которое легко теряет воду (при 70 оС). Н2ТеО3 склонен к полимеризации, и поэтому при действии кислот на теллуриты выделяется осадок переменного состава ТеО2 nН2О (K1 = 3 10-6 ). Кислотные свойства в ряду Н2SО3 - Н2SеО3 - Н2ТеО3 ослабевают.
В отличие от Н2SО3 триоксоселенат (IV) водорода Н2SеО3 выделен в свободном состоянии. Это — твердое вещество, которое легко теряет воду (при 70 оС). Н2ТеО3 склонен к полимеризации, и поэтому при действии кислот на теллуриты выделяется осадок переменного состава ТеО2 nН2О (K1 = 3 10-6 ). Кислотные свойства в ряду Н2SО3 - Н2SеО3 - Н2ТеО3 ослабевают.
Cлайд 24
 Оксид SеO2 (а также SеО32-) по сравнению с SO2 (в SО32-) проявляют в большей степени окислительные свойства, чем восстановительные. Например, SеO2 легко окисляет SО2: 2SО2 + SеО2 = Sе + 2SО3 Для окисления же производных Э (IV) необходимы сильные окислители. H2SeO3 + H2O2 = H2SeO4 + H2O
Оксид SеO2 (а также SеО32-) по сравнению с SO2 (в SО32-) проявляют в большей степени окислительные свойства, чем восстановительные. Например, SеO2 легко окисляет SО2: 2SО2 + SеО2 = Sе + 2SО3 Для окисления же производных Э (IV) необходимы сильные окислители. H2SeO3 + H2O2 = H2SeO4 + H2O
Cлайд 25
 Соединения селена (VI), теллура (VI) и полония (VI). Для селена (VI) и теллура (VI) известны бинарные соединения с кислородом и фтором: Соединения полония (VI) неустойчивы.
Соединения селена (VI), теллура (VI) и полония (VI). Для селена (VI) и теллура (VI) известны бинарные соединения с кислородом и фтором: Соединения полония (VI) неустойчивы.
Cлайд 26
 Триоксид селена SеO3 (Тпл. 118,5 °С, Tразл. 185 °С) белого цвета, известен в виде стекловидной и асбестовидной модификаций. С водой SеO3 взаимодействует очень энергично образуя селеновую кислоту. Триоксид теллура ТеО3 также имеет две модификации. В воде практически не растворяется, но взаимодействует со щелочами.
Триоксид селена SеO3 (Тпл. 118,5 °С, Tразл. 185 °С) белого цвета, известен в виде стекловидной и асбестовидной модификаций. С водой SеO3 взаимодействует очень энергично образуя селеновую кислоту. Триоксид теллура ТеО3 также имеет две модификации. В воде практически не растворяется, но взаимодействует со щелочами.
Cлайд 27
 Триоксид селена SеО3 получают кипячением К2SеO4 с жидким SО3, а ТеО3 — обезвоживанием гексаоксотеллурата (VI) водорода: K2SеO4 + SO3 = K2SO4 + SеО3; H6TeO6 = TeO3 + 3H2O Селеновую H2SеО4 и теллуровую H6TeO6 кислоты можно получить окислением Э+4 или Э0 сильными окислителями: H2SеО3 + H2O2 = H2SеO4 + H2O; Te + HClO4 = H6TeO6 + HCl. Te + HClO3 + 3H2O = H6TeO6 + HCl
Триоксид селена SеО3 получают кипячением К2SеO4 с жидким SО3, а ТеО3 — обезвоживанием гексаоксотеллурата (VI) водорода: K2SеO4 + SO3 = K2SO4 + SеО3; H6TeO6 = TeO3 + 3H2O Селеновую H2SеО4 и теллуровую H6TeO6 кислоты можно получить окислением Э+4 или Э0 сильными окислителями: H2SеО3 + H2O2 = H2SеO4 + H2O; Te + HClO4 = H6TeO6 + HCl. Te + HClO3 + 3H2O = H6TeO6 + HCl
Cлайд 28
 Тетраоксоселенат (VI) водорода H2SеO4 белое кристаллическое вещество (Тпл. 62,4 °С). Как и Н2SO4, он жадно поглощает воду, обугливает органические вещества Его водный раствор сильная кислота, Называемая селеновой (К1 = 1 103, К2 = 1,2 10-2). Из растворов выделяются кристаллогидраты (Н2SеО4 Н2O, Н2SеО4 2Н2O, Н2SеО4 4Н2O), являющиеся селенатами оксония.
Тетраоксоселенат (VI) водорода H2SеO4 белое кристаллическое вещество (Тпл. 62,4 °С). Как и Н2SO4, он жадно поглощает воду, обугливает органические вещества Его водный раствор сильная кислота, Называемая селеновой (К1 = 1 103, К2 = 1,2 10-2). Из растворов выделяются кристаллогидраты (Н2SеО4 Н2O, Н2SеО4 2Н2O, Н2SеО4 4Н2O), являющиеся селенатами оксония.
Cлайд 29
 Гексаоксотеллурат (VI) водорода H6TeO6 белое кристаллическое вещество, хорошо растворимое в горячей воде. Теллуровая кислота очень слабая (К1 = 2 10-8, К2 = 5 10-11). При нейтрализации Н6ТеО6 щелочью образуются гидротеллураты например: М+1[ТеО(ОН)5] - (М+1Н5ТеO6), М2+1[ТеО2(ОН)4] - (М2+1H4ТеО6). Получены также производные типа Аg6ТеО6, Нg3ТеО6. H6TeO6 тоже сильный окислитель, но слабее, чем H2SеO4.
Гексаоксотеллурат (VI) водорода H6TeO6 белое кристаллическое вещество, хорошо растворимое в горячей воде. Теллуровая кислота очень слабая (К1 = 2 10-8, К2 = 5 10-11). При нейтрализации Н6ТеО6 щелочью образуются гидротеллураты например: М+1[ТеО(ОН)5] - (М+1Н5ТеO6), М2+1[ТеО2(ОН)4] - (М2+1H4ТеО6). Получены также производные типа Аg6ТеО6, Нg3ТеО6. H6TeO6 тоже сильный окислитель, но слабее, чем H2SеO4.
Cлайд 30
 Соединения селена (VI) менее устойчивы, чем соответствующие соединения серы (VI). Так, при нагревании SеO3 и Н2SеO4 разлагаются с выделением кислорода. 2Н2SеO4 =(T)= 2Н2SеO3 + O2 Поэтому Н2SеO4 — более сильный окислитель, чем Н2SO4: Аu растворяется в горячей конц. H2SеO4: 2Au + 6H2SeO4(к) = Au2(SeO4)3 + 3H2SeO3 + 3H2O.
Соединения селена (VI) менее устойчивы, чем соответствующие соединения серы (VI). Так, при нагревании SеO3 и Н2SеO4 разлагаются с выделением кислорода. 2Н2SеO4 =(T)= 2Н2SеO3 + O2 Поэтому Н2SеO4 — более сильный окислитель, чем Н2SO4: Аu растворяется в горячей конц. H2SеO4: 2Au + 6H2SeO4(к) = Au2(SeO4)3 + 3H2SeO3 + 3H2O.
Cлайд 31
 Также, Н2SеO4 окисляет концентрированную соляную кислоту: +6 -1 +4 0 Н2SеO4 + 2HCl = Н2SеO3 + Cl2 + H2O За счет выделения атомарного хлора смесь Н2SеO4 и НСl — сильнейший окислитель, растворяет золото и платину. Окислительные свойства H6TeO6 выражены слабее, чем у H2SеO4.
Также, Н2SеO4 окисляет концентрированную соляную кислоту: +6 -1 +4 0 Н2SеO4 + 2HCl = Н2SеO3 + Cl2 + H2O За счет выделения атомарного хлора смесь Н2SеO4 и НСl — сильнейший окислитель, растворяет золото и платину. Окислительные свойства H6TeO6 выражены слабее, чем у H2SеO4.
Cлайд 32
 Помимо полупроводниковой техники соединения селена и теллура используются в органическом синтезе, в частности для получения разнообразных селен- и теллурорганических соединений. Добавка селена к стеклу и эмали окрашивает их в красный цвет. Многие соединения селена и теллура токсичны. Полоний еще опаснее ввиду его радиоактивности.
Помимо полупроводниковой техники соединения селена и теллура используются в органическом синтезе, в частности для получения разнообразных селен- и теллурорганических соединений. Добавка селена к стеклу и эмали окрашивает их в красный цвет. Многие соединения селена и теллура токсичны. Полоний еще опаснее ввиду его радиоактивности.
Cлайд 33
 Ст. ок. +4 SO2 SeO2 TeO2 PoO2 газ тв. в-во. тв. в-во. крист. бесцв. белый белый желтый Тпл. оС -75 (возг.) 733 (разлаг.) 337 500 уменьшение растворимости в воде ослабление кислотных свойств рост восстановительной активности Ст. ок. +6 SO3 SeO3 TeO3 бесц. белое желтое летуч. тв. в-во. тв. в-во. Тпл. оС 16,8 121 разлаг. 400
Ст. ок. +4 SO2 SeO2 TeO2 PoO2 газ тв. в-во. тв. в-во. крист. бесцв. белый белый желтый Тпл. оС -75 (возг.) 733 (разлаг.) 337 500 уменьшение растворимости в воде ослабление кислотных свойств рост восстановительной активности Ст. ок. +6 SO3 SeO3 TeO3 бесц. белое желтое летуч. тв. в-во. тв. в-во. Тпл. оС 16,8 121 разлаг. 400
Cлайд 34
 Ст. ок. +4 Н2SO3 Н2SеO3 Н2ТеO3 неустойч. тв. в-во в раств. в раств. белое полимеризуется сернистая селенистая теллуристая к-та ослабление кислотных свойств 2 10-2 2 10-3 3 10-6 Ст. ок. +6 Н2SO4 Н2SеO4 Н6ТеO6 бесцв. белое белое маслянистая ж. крист. в-во крист. в-во Тпл. 10,3 62,4 136 серная селеновая теллуровая 1 103 1 103 2 10-8 рост окислительной активности
Ст. ок. +4 Н2SO3 Н2SеO3 Н2ТеO3 неустойч. тв. в-во в раств. в раств. белое полимеризуется сернистая селенистая теллуристая к-та ослабление кислотных свойств 2 10-2 2 10-3 3 10-6 Ст. ок. +6 Н2SO4 Н2SеO4 Н6ТеO6 бесцв. белое белое маслянистая ж. крист. в-во крист. в-во Тпл. 10,3 62,4 136 серная селеновая теллуровая 1 103 1 103 2 10-8 рост окислительной активности