X
Код презентации скопируйте его
Закон сохранения массы веществ. Уравнения химических реакций
Скачать эту презентациюПрезентация на тему Закон сохранения массы веществ. Уравнения химических реакций
Скачать эту презентациюCлайд 1
 Закон сохранения массы веществ. Уравнения химических реакций. Общая средняя школа № 36 имени Казыбек би Составила : учитель химии, биологии высшей квалификационной категории: Палжанова А.Ш. 2011 год
Закон сохранения массы веществ. Уравнения химических реакций. Общая средняя школа № 36 имени Казыбек би Составила : учитель химии, биологии высшей квалификационной категории: Палжанова А.Ш. 2011 год
Cлайд 2
 Единственный путь, ведущий к знанию, - это деятельность. Цели урока: Обучающие - экспериментально доказать закон сохранения массы веществ. На основе этого закона сформировать понятие о материальном балансе химической реакции. Сформировать понятие об уравнении химической реакции как об условной записи, отображающей превращения веществ. Развивающие - развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами ; развивать способность к логическому мышлению. Воспитательные - продолжить формирование научного мировоззрения учащихся; воспитывать коммуникативную компетентность, а также наблюдательность, внимание, инициативу. На примере жизни и деятельности М. В. Ломоносова воспитывать интерес к изучению химии.
Единственный путь, ведущий к знанию, - это деятельность. Цели урока: Обучающие - экспериментально доказать закон сохранения массы веществ. На основе этого закона сформировать понятие о материальном балансе химической реакции. Сформировать понятие об уравнении химической реакции как об условной записи, отображающей превращения веществ. Развивающие - развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами ; развивать способность к логическому мышлению. Воспитательные - продолжить формирование научного мировоззрения учащихся; воспитывать коммуникативную компетентность, а также наблюдательность, внимание, инициативу. На примере жизни и деятельности М. В. Ломоносова воспитывать интерес к изучению химии.
Cлайд 3
 Открытие закона сохранения массы веществ 1789г. Роберт Бойль 1673г. 1748г. М. В. Ломоносов Антуан Лавуазье
Открытие закона сохранения массы веществ 1789г. Роберт Бойль 1673г. 1748г. М. В. Ломоносов Антуан Лавуазье
Cлайд 4
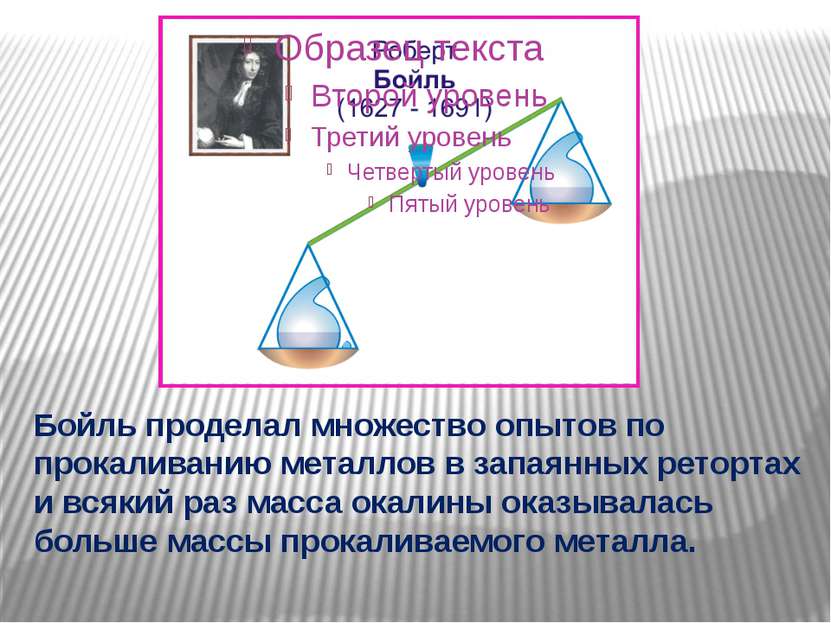
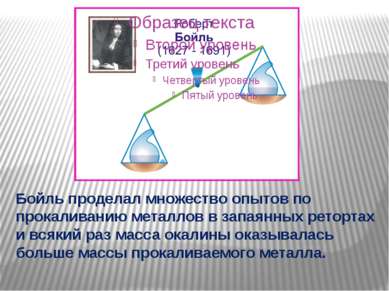 Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз масса окалины оказывалась больше массы прокаливаемого металла.
Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз масса окалины оказывалась больше массы прокаливаемого металла.
Cлайд 6
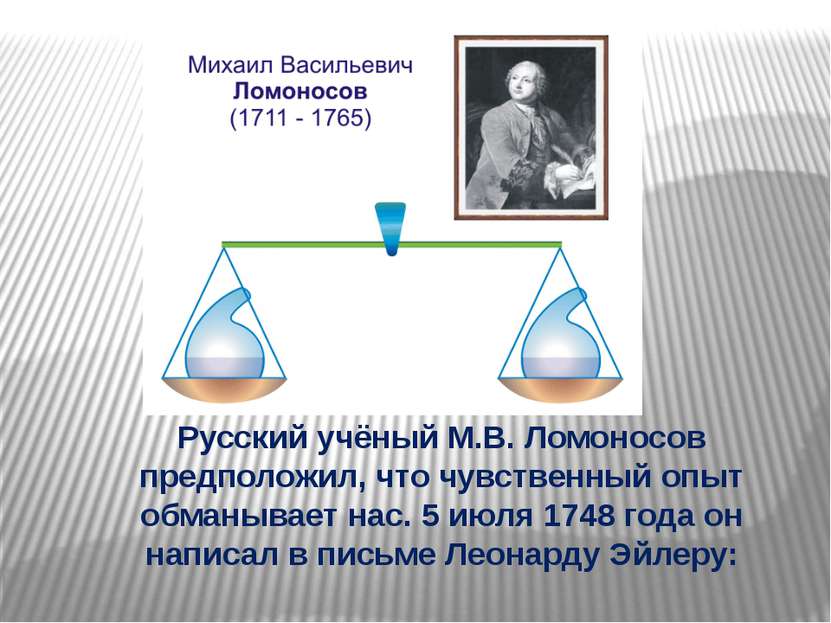
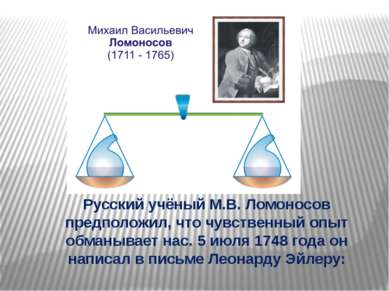 Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748 года он написал в письме Леонарду Эйлеру:
Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748 года он написал в письме Леонарду Эйлеру:
Cлайд 7
 «Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет...»
«Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет...»
Cлайд 8
 «Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции» - современная формулировка закона сохранения массы веществ.
«Масса веществ, вступивших в реакцию, равна массе образовавшихся веществ в результате реакции» - современная формулировка закона сохранения массы веществ.
Cлайд 10
 Лишь в 1756 году Ломоносову удалось проверить опытным путём теоретически открытый закон сохранения массы веществ. Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.
Лишь в 1756 году Ломоносову удалось проверить опытным путём теоретически открытый закон сохранения массы веществ. Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.
Cлайд 12
 Значительно позже этот закон,независимо от М.В. Ломоносова,был открыт французским ученым А.Лавуазье.
Значительно позже этот закон,независимо от М.В. Ломоносова,был открыт французским ученым А.Лавуазье.
Cлайд 14
 Химическая формула – условная запись состава вещества с помощью химических знаков и индексов. Индекс показывает число атомов в формульной единице вещества. Коэффициент показывает число несоединенных друг с другом частиц 5Н2О Коэффициент Химическая формула Индекс На основании данного закона составляют уравнения химических реакций с помощью химических формул, коэффициентов и математических знаков.
Химическая формула – условная запись состава вещества с помощью химических знаков и индексов. Индекс показывает число атомов в формульной единице вещества. Коэффициент показывает число несоединенных друг с другом частиц 5Н2О Коэффициент Химическая формула Индекс На основании данного закона составляют уравнения химических реакций с помощью химических формул, коэффициентов и математических знаков.
Cлайд 15
 Химические уравнения Химическое уравнение – условная запись химической реакции с помощью химических формул и коэффициентов
Химические уравнения Химическое уравнение – условная запись химической реакции с помощью химических формул и коэффициентов
Cлайд 16
 Алгоритм составления уравнений Порядок выполнения операций Пример 1. В левой части уравнения записать исходные вещества, в правой — продукты реакции (молекулы газов водорода, хлора, кислорода, азота состоят из двух атомов) Al + O2=Al2+3O3-2 2. Определить число атомов каждого элемента в левой и правой частях схемы реакции Лево право Al-1 атом 2атома O-2 атома 3атома 3. Среди элементов с разным числом атомов до и после реакции выбрать тот, число атомов которого больше O — 2 атома слева O — 3 атомов справа 4. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения НОК — 6 5. Разделить НОК на число атомов этого элемента в левой части уравнения, получив коэффициент для левой части уравнения 6 : 2 = 3 Al + 3O2 = Al2O3 6. Разделить НОК на число атомов этого элемента в правой части уравнения, получив коэффициент для правой части уравнения 6 : 3 = 2 Al + 3O2 = 2Al2O3 7. Необходимо подсчитать число атомов других элементов в левой и правой частях уравнения и с помощью коэффициентов уравнять их, т. е. число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым Al + 3O2 = 2Al2O3 Al-1Al–4 O– 6O- 6В левую часть уравнения перед фосфором необходимо поставить коэффициент 4. 4Al + 3O2 = 2Al2O3
Алгоритм составления уравнений Порядок выполнения операций Пример 1. В левой части уравнения записать исходные вещества, в правой — продукты реакции (молекулы газов водорода, хлора, кислорода, азота состоят из двух атомов) Al + O2=Al2+3O3-2 2. Определить число атомов каждого элемента в левой и правой частях схемы реакции Лево право Al-1 атом 2атома O-2 атома 3атома 3. Среди элементов с разным числом атомов до и после реакции выбрать тот, число атомов которого больше O — 2 атома слева O — 3 атомов справа 4. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения НОК — 6 5. Разделить НОК на число атомов этого элемента в левой части уравнения, получив коэффициент для левой части уравнения 6 : 2 = 3 Al + 3O2 = Al2O3 6. Разделить НОК на число атомов этого элемента в правой части уравнения, получив коэффициент для правой части уравнения 6 : 3 = 2 Al + 3O2 = 2Al2O3 7. Необходимо подсчитать число атомов других элементов в левой и правой частях уравнения и с помощью коэффициентов уравнять их, т. е. число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым Al + 3O2 = 2Al2O3 Al-1Al–4 O– 6O- 6В левую часть уравнения перед фосфором необходимо поставить коэффициент 4. 4Al + 3O2 = 2Al2O3