X
Код презентации скопируйте его
Азотная кислота. Опасность и сила
Скачать эту презентациюПрезентация на тему Азотная кислота. Опасность и сила
Скачать эту презентациюCлайд 2
 СОДЕРЖАНИЕ: Строение Получение.Лабороторный способ Промышленный способ Физические свойства Химические свойства.Общие с другими кислотами Химические свойства.Специфические Таблица 2 Применение
СОДЕРЖАНИЕ: Строение Получение.Лабороторный способ Промышленный способ Физические свойства Химические свойства.Общие с другими кислотами Химические свойства.Специфические Таблица 2 Применение
Cлайд 3
 Одна связь с кислородом образуется по донорно-акцепторному механизму, но из-за близости расположения атомов в молекуле становятся равноценными. К содержанию
Одна связь с кислородом образуется по донорно-акцепторному механизму, но из-за близости расположения атомов в молекуле становятся равноценными. К содержанию
Cлайд 5
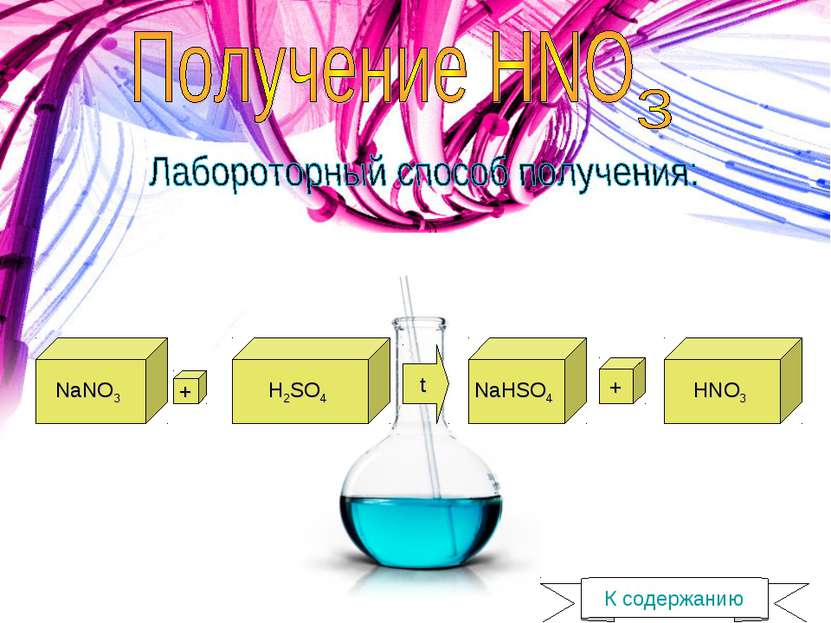
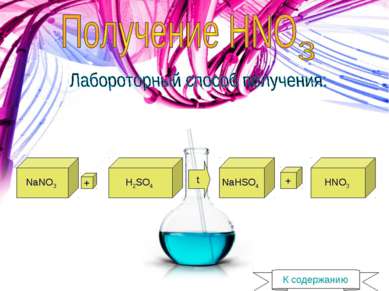
 1) 4NH3 + 5O2 -> 4NO + 6H2O + Q 2) 2 NO + O2 -> 2NO2 3) 2 H2O + 4NO2 + O2 -> 4HNO3 К содержанию
1) 4NH3 + 5O2 -> 4NO + 6H2O + Q 2) 2 NO + O2 -> 2NO2 3) 2 H2O + 4NO2 + O2 -> 4HNO3 К содержанию
Cлайд 6
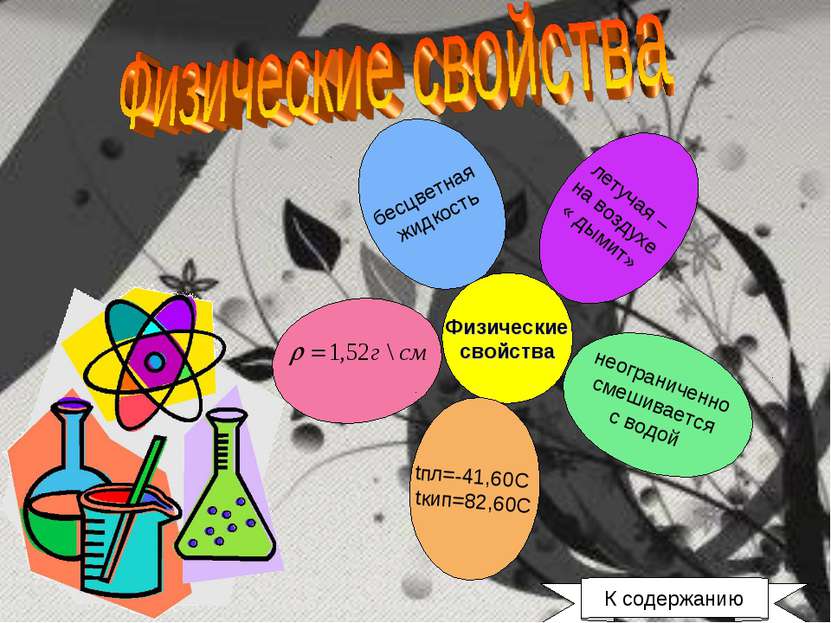
 Физические свойства бесцветная жидкость летучая – на воздухе « дымит» неограниченно смешивается с водой tпл=-41,60C tкип=82,60C К содержанию
Физические свойства бесцветная жидкость летучая – на воздухе « дымит» неограниченно смешивается с водой tпл=-41,60C tкип=82,60C К содержанию
Cлайд 7
 Общие с другими кислотами: 1.Сильный электролит, хорошо диссоциируют на ионы. HNO3 -> H+ +NO3- Изменяет окраску индикатора. 2. Реагирует с основными оксидами СuO+2 HNO3 -> Cu(NO3)2 +H2O 3.реагирует с основаниями HNO3 + KOH -> KNO3 + H2O 4. реагирует с солями более летучих кислот Na2CO3 + 2HNO3 -> 2NaNO3 +H2CO3 cухая / \ H2O CO2 К содержанию
Общие с другими кислотами: 1.Сильный электролит, хорошо диссоциируют на ионы. HNO3 -> H+ +NO3- Изменяет окраску индикатора. 2. Реагирует с основными оксидами СuO+2 HNO3 -> Cu(NO3)2 +H2O 3.реагирует с основаниями HNO3 + KOH -> KNO3 + H2O 4. реагирует с солями более летучих кислот Na2CO3 + 2HNO3 -> 2NaNO3 +H2CO3 cухая / \ H2O CO2 К содержанию
Cлайд 8
 Специфические: 5. при нагревании и под действием света разлагается. 4HNO3 -> 2H2O +4NO2 + O2 6.Азотная кислота специфически взаимодействует с металлами, продукты реакции зависят от активности металла и концентрации кислоты (см. таблицу 2) а)4HNO3(конц) + Cu -> Cu(NO3)2 + 2NO2↑ + 2H2O «лисий хвост» б)4HNO3(разб) + 3Ag -> 3AgNO3 + NO↑ + 2H2O 7.азотная кислота сильнейший окислитель 2HNO3(конц.) + S -> H2SO4 + 2NO 5HNO3 + 3P + 2H2O -> 3H3PO4 + 5NO↑ К содержанию
Специфические: 5. при нагревании и под действием света разлагается. 4HNO3 -> 2H2O +4NO2 + O2 6.Азотная кислота специфически взаимодействует с металлами, продукты реакции зависят от активности металла и концентрации кислоты (см. таблицу 2) а)4HNO3(конц) + Cu -> Cu(NO3)2 + 2NO2↑ + 2H2O «лисий хвост» б)4HNO3(разб) + 3Ag -> 3AgNO3 + NO↑ + 2H2O 7.азотная кислота сильнейший окислитель 2HNO3(конц.) + S -> H2SO4 + 2NO 5HNO3 + 3P + 2H2O -> 3H3PO4 + 5NO↑ К содержанию
Cлайд 9
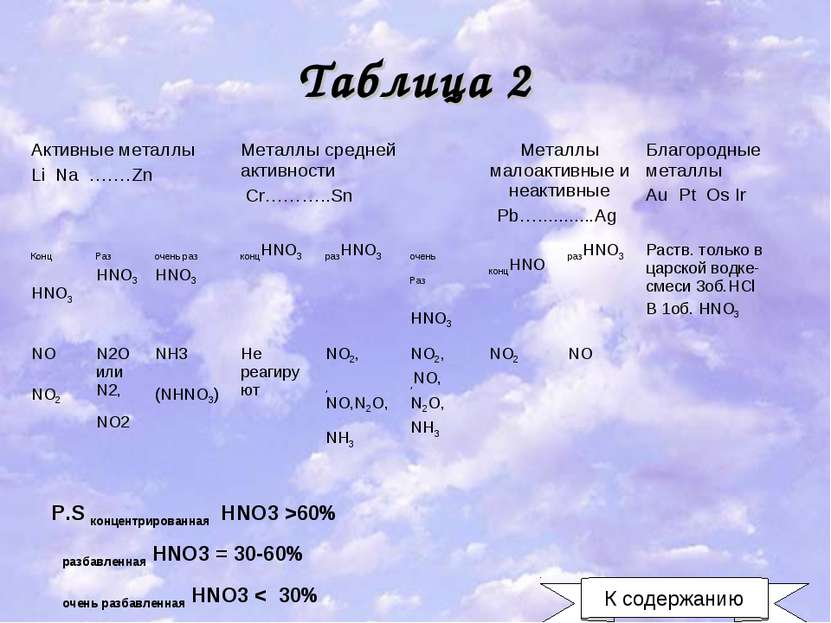
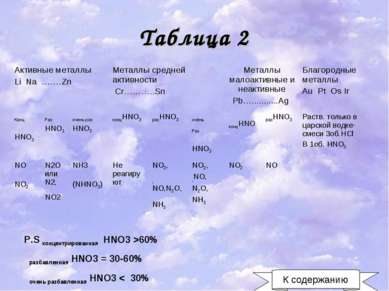 Таблица 2 P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 < 30% К содержанию Активные металлы Li Na …….Zn Металлы средней активности Cr………..Sn Металлы малоактивные и неактивные Pb…...........Ag Благородные металлы Au Pt Os Ir Конц HNO3 Раз HNO3 очень раз HNO3 концHNO3 разHNO3 очень Раз HNO3 концHNO разHNO3 Раств. только в царской водке-смеси 3об.HCl B 1об. HNO3 NO NO2 N2O или N2, NO2 NH3 (NHNO3) Не реагируют NO2, ,NO,N2O,NH3 NO2, ,NO, N2O, NH3 NO2 NO
Таблица 2 P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 < 30% К содержанию Активные металлы Li Na …….Zn Металлы средней активности Cr………..Sn Металлы малоактивные и неактивные Pb…...........Ag Благородные металлы Au Pt Os Ir Конц HNO3 Раз HNO3 очень раз HNO3 концHNO3 разHNO3 очень Раз HNO3 концHNO разHNO3 Раств. только в царской водке-смеси 3об.HCl B 1об. HNO3 NO NO2 N2O или N2, NO2 NH3 (NHNO3) Не реагируют NO2, ,NO,N2O,NH3 NO2, ,NO, N2O, NH3 NO2 NO