X
Код презентации скопируйте его
Брэнды и дженерики
Скачать эту презентациюПрезентация на тему Брэнды и дженерики
Скачать эту презентациюCлайд 2
 Зачем фармацевту информация об особенностях дженериков? Исключение претензий со стороны потребителей после приобретения ими в аптеке «кота в мешке» Повышение уровня продаж оригинальных препаратов – увеличение прибыли предприятия Предотвращение ситуаций сообщения пациентам неполной или недостоверной информации о препарате
Зачем фармацевту информация об особенностях дженериков? Исключение претензий со стороны потребителей после приобретения ими в аптеке «кота в мешке» Повышение уровня продаж оригинальных препаратов – увеличение прибыли предприятия Предотвращение ситуаций сообщения пациентам неполной или недостоверной информации о препарате
Cлайд 3
 Особенности национальной любви к дженерикам Недостаточная осведомленность населения в области фармакологии и фармакотерапии Низкий уровень разъяснительной работы среди населения в области лекарственной безопасности Низкая покупательная способность пациентов Более доступная цена Возможная сопоставимая терапевтическая эффективность (все-таки они помогают) Коммерческая эффективность
Особенности национальной любви к дженерикам Недостаточная осведомленность населения в области фармакологии и фармакотерапии Низкий уровень разъяснительной работы среди населения в области лекарственной безопасности Низкая покупательная способность пациентов Более доступная цена Возможная сопоставимая терапевтическая эффективность (все-таки они помогают) Коммерческая эффективность
Cлайд 4
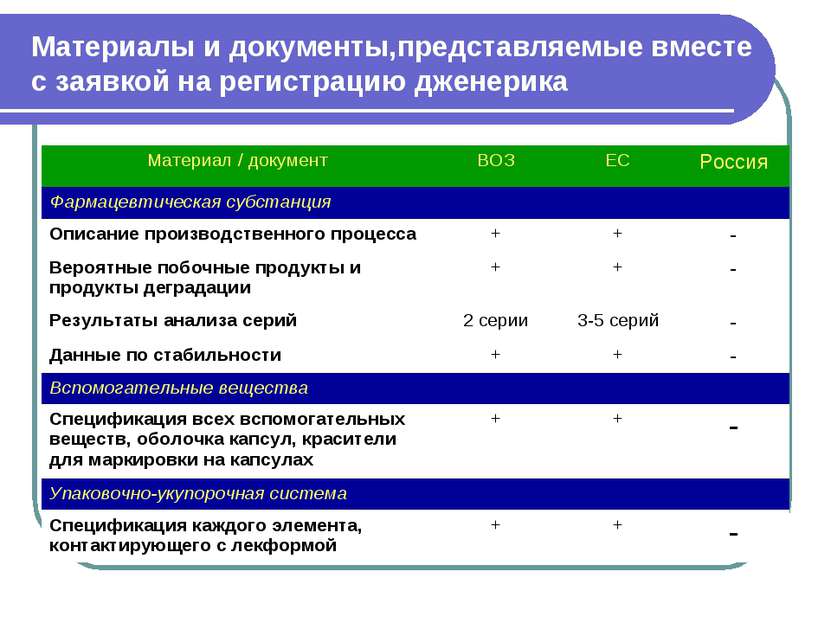
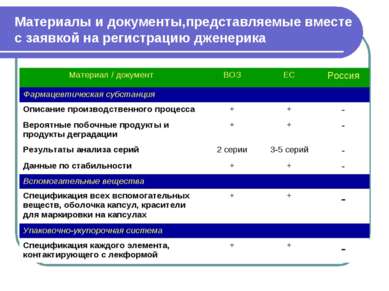 Материалы и документы,представляемые вместе с заявкой на регистрацию дженерика Материал / документ ВОЗ ЕС Россия Фармацевтическая субстанция Описание производственного процесса + + - Вероятные побочные продукты и продукты деградации + + - Результаты анализа серий 2 серии 3-5 серий - Данные по стабильности + + - Вспомогательные вещества Спецификация всех вспомогательных веществ, оболочка капсул, красители для маркировки на капсулах + + - Упаковочно-укупорочная система Спецификация каждого элемента, контактирующего с лекформой + + -
Материалы и документы,представляемые вместе с заявкой на регистрацию дженерика Материал / документ ВОЗ ЕС Россия Фармацевтическая субстанция Описание производственного процесса + + - Вероятные побочные продукты и продукты деградации + + - Результаты анализа серий 2 серии 3-5 серий - Данные по стабильности + + - Вспомогательные вещества Спецификация всех вспомогательных веществ, оболочка капсул, красители для маркировки на капсулах + + - Упаковочно-укупорочная система Спецификация каждого элемента, контактирующего с лекформой + + -
Cлайд 5
 «Засилие» дженериков В Российской Федерации зарегистрировано более 17 000 наименований лекарственных препаратов 78% из них являются «аналогами» оригинальных препаратов
«Засилие» дженериков В Российской Федерации зарегистрировано более 17 000 наименований лекарственных препаратов 78% из них являются «аналогами» оригинальных препаратов
Cлайд 6
 Примеры сравнения брэндов и дженериков Амлодипин и норваск Амиодарон и кордарон Ренитек и энам Козаар и лозап Конкор и бисогамма Диротон и лизиноприл Верапамил и изоптин Коринфар и адалат Седуксен и реланиум Эгилок, беталок ЗОК и метопролол
Примеры сравнения брэндов и дженериков Амлодипин и норваск Амиодарон и кордарон Ренитек и энам Козаар и лозап Конкор и бисогамма Диротон и лизиноприл Верапамил и изоптин Коринфар и адалат Седуксен и реланиум Эгилок, беталок ЗОК и метопролол
Cлайд 7
 Оригинальный препарат Original (англ.) – первый, новый, истинный, прежде неизвестный, предшествующий, исходный… Новый препарат, произведенный на основе разработки новых активных субстанций Патент и эксклюзивные права 20 лет принадлежат компании-создателю Регистрируется на основании доказательных данных многоцентровых рандомизированных исследования
Оригинальный препарат Original (англ.) – первый, новый, истинный, прежде неизвестный, предшествующий, исходный… Новый препарат, произведенный на основе разработки новых активных субстанций Патент и эксклюзивные права 20 лет принадлежат компании-создателю Регистрируется на основании доказательных данных многоцентровых рандомизированных исследования
Cлайд 8
 Дженерик Generic (англ.) – общий, родовой, групповой Дже нерик (иногда — генерик, женерик) —лекарственное средство, которое выпускается без лицензии компании-разработчика инновационного лекарственного средства, и размещается на рынке после окончания срока действия патента или других исключительных прав Все воспроизведения оригинального препарата, непатентованные копии Регистрируются на основании «биоэквивалентности*» В России в большинстве случаев патентное право защищает не молекулу, а процесс Состав таблетки НЕ идентичен оригиналу * - исследования по биоэквивалентности часто не проводятся
Дженерик Generic (англ.) – общий, родовой, групповой Дже нерик (иногда — генерик, женерик) —лекарственное средство, которое выпускается без лицензии компании-разработчика инновационного лекарственного средства, и размещается на рынке после окончания срока действия патента или других исключительных прав Все воспроизведения оригинального препарата, непатентованные копии Регистрируются на основании «биоэквивалентности*» В России в большинстве случаев патентное право защищает не молекулу, а процесс Состав таблетки НЕ идентичен оригиналу * - исследования по биоэквивалентности часто не проводятся
Cлайд 9
 Критерии сравнения Дженерик содержит то же активное лекарственное вещество (субстанцию), что и оригинальный (патентованный) препарат. Дженерик отличается от оригинального препарата вспомогательными (?) веществами (неактивными ингредиентами, наполнителями, консервантами, красителями и др.). Различия наблюдаются и в самом технологическом процессе производства дженериков. Соблюдение технологии производства и контроль качества выпускаемой продукции у брендов всегда на более высоком уровне
Критерии сравнения Дженерик содержит то же активное лекарственное вещество (субстанцию), что и оригинальный (патентованный) препарат. Дженерик отличается от оригинального препарата вспомогательными (?) веществами (неактивными ингредиентами, наполнителями, консервантами, красителями и др.). Различия наблюдаются и в самом технологическом процессе производства дженериков. Соблюдение технологии производства и контроль качества выпускаемой продукции у брендов всегда на более высоком уровне
Cлайд 10
 Эквивалентность брэндов и дженериков (требования FDA) Фармацевтически эквивалентные лекарственные препараты содержат одинаковые активные ингредиенты в одинаковой лекарственной форме, предназначены для одного способа введения и идентичны по силе действия или концентрации активных веществ (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000). Биоэквивалентные лекарственные препараты — это фармацевтически эквивалентные или фармацевтически альтернативные препараты, которые имеют сравнимую биодоступностъ при исследовании в сходных экспериментальных условиях (FDA, Electronic Orange Book, Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000). Эквивалентность препаратов оценивается также по уровню требований к контролю качества производства (соответствие стандартам GMP), к инструкциями к лекарствам, к этикетированию и т.д. Эквивалентность лекарств оценивается также по физико-химическим свойствам действующих веществ (степень дисперсности, полиморфизм и др.), свойствам вспомогательных веществ, особенностям технологического процесса, условиям хранения, упаковке (стекло, пластмасса, бумага и т.п.). Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000).
Эквивалентность брэндов и дженериков (требования FDA) Фармацевтически эквивалентные лекарственные препараты содержат одинаковые активные ингредиенты в одинаковой лекарственной форме, предназначены для одного способа введения и идентичны по силе действия или концентрации активных веществ (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000). Биоэквивалентные лекарственные препараты — это фармацевтически эквивалентные или фармацевтически альтернативные препараты, которые имеют сравнимую биодоступностъ при исследовании в сходных экспериментальных условиях (FDA, Electronic Orange Book, Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000). Эквивалентность препаратов оценивается также по уровню требований к контролю качества производства (соответствие стандартам GMP), к инструкциями к лекарствам, к этикетированию и т.д. Эквивалентность лекарств оценивается также по физико-химическим свойствам действующих веществ (степень дисперсности, полиморфизм и др.), свойствам вспомогательных веществ, особенностям технологического процесса, условиям хранения, упаковке (стекло, пластмасса, бумага и т.п.). Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000).
Cлайд 11
 Фармацевтическая эквивалентность Фармацевтически эквивалентные лекарственные препараты содержат одинаковые активные ингредиенты в одинаковой лекарственной форме, предназначены для одного способа введения и идентичны по силе действия или концентрации активных веществ (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000). Стоимость субстанции (действующего вещества) составляет 50% себестоимости лекарственного средства Дженериковые компании постоянно совершенствуют способы снижения стоимости вспомогательных веществ Вспомогательные вещества могут на 50% изменять терапевтическую эффективность и биодоступность фармацевтического средства Выявление многих токсических примесей возможно только благодаря специальному химическому анализу, не предусмотренному в фармакопейных статьях РФ
Фармацевтическая эквивалентность Фармацевтически эквивалентные лекарственные препараты содержат одинаковые активные ингредиенты в одинаковой лекарственной форме, предназначены для одного способа введения и идентичны по силе действия или концентрации активных веществ (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000). Стоимость субстанции (действующего вещества) составляет 50% себестоимости лекарственного средства Дженериковые компании постоянно совершенствуют способы снижения стоимости вспомогательных веществ Вспомогательные вещества могут на 50% изменять терапевтическую эффективность и биодоступность фармацевтического средства Выявление многих токсических примесей возможно только благодаря специальному химическому анализу, не предусмотренному в фармакопейных статьях РФ
Cлайд 12
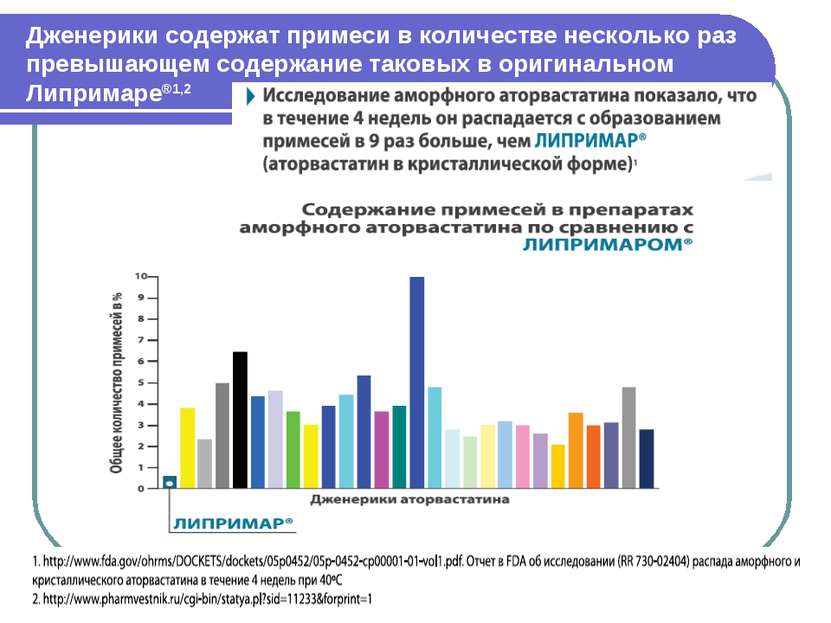
 Дженерики содержат примеси в количестве несколько раз превышающем содержание таковых в оригинальном Липримаре®1,2
Дженерики содержат примеси в количестве несколько раз превышающем содержание таковых в оригинальном Липримаре®1,2
Cлайд 13
 Electronic Orange Book – результаты поиска Периндаприл (Perindapril)– не зарегистрирован Аторвастатин – кодуэт, липитор (PFIZER) Квинаприл – квинаретик (ACTAVIS); квинаприл (AUROBINDO, MYLAN, GENPHARM, INVAGEN, LUPIN, RANBAXY, SANDOZ, TEVA, TORPHARM, WATSON LABS FLORIDA); аккуретик*, аккуприл* (PFIZER) Амлодипин – норваск* (PFIZER) + 22 фирмы (в т.ч. DR REDDYS LABS LTD и GEDEON RICHTER USA) Ренитек – нет (в т.ч. и поиск по эналаприлам) Лизиноприл – 42 фирмы Бисопролол – 7 фирм Лозартан – козаар*, гизаар* (MERCK) Симвастатин – зокор 80* (MERCK), симвастатин (15 фирм) Триметазидин (Trimetazidine) – нет регистрации Клонидин (клофелин) – 11 фирм
Electronic Orange Book – результаты поиска Периндаприл (Perindapril)– не зарегистрирован Аторвастатин – кодуэт, липитор (PFIZER) Квинаприл – квинаретик (ACTAVIS); квинаприл (AUROBINDO, MYLAN, GENPHARM, INVAGEN, LUPIN, RANBAXY, SANDOZ, TEVA, TORPHARM, WATSON LABS FLORIDA); аккуретик*, аккуприл* (PFIZER) Амлодипин – норваск* (PFIZER) + 22 фирмы (в т.ч. DR REDDYS LABS LTD и GEDEON RICHTER USA) Ренитек – нет (в т.ч. и поиск по эналаприлам) Лизиноприл – 42 фирмы Бисопролол – 7 фирм Лозартан – козаар*, гизаар* (MERCK) Симвастатин – зокор 80* (MERCK), симвастатин (15 фирм) Триметазидин (Trimetazidine) – нет регистрации Клонидин (клофелин) – 11 фирм
Cлайд 14
 Рекомендации ВОЗ в отношении биоэквивалентности Биоэквивалентность дженерика следует определять по отношению к оригинальному лекарственному препарату. Если он не представлен на национальном рынке, то его берут из указанного в перечне (первичный рынок), где, по мнению компании-производителя, он более всего отвечает требованиям, предъявляемым к качеству, безопасности, эффективности и маркировке. При невозможности использования оригинального лекарственного препарата стандартом может служить лекарственный препарат, лидирующий на рынке страны, если подтверждены его качество, безопасность и эффективность. При отсутствии препарата-лидера регистрируемый дженерик производят в соответствии с местными, государственными или региональными стандартами, в том числе Международной фармакопеей и Руководством ВОЗ по регистрационным требованиям для определения взаимозаменяемости лекарственных препаратов, выпускаемых несколькими производителями (WorldHealth Organization, 1996, WHO Expert Expert Committee on Specifications for Pharmaceutical Preparations: thirty-fourth report. WHO Technical Report Series No. 863, Geneva, pp. 114-154).
Рекомендации ВОЗ в отношении биоэквивалентности Биоэквивалентность дженерика следует определять по отношению к оригинальному лекарственному препарату. Если он не представлен на национальном рынке, то его берут из указанного в перечне (первичный рынок), где, по мнению компании-производителя, он более всего отвечает требованиям, предъявляемым к качеству, безопасности, эффективности и маркировке. При невозможности использования оригинального лекарственного препарата стандартом может служить лекарственный препарат, лидирующий на рынке страны, если подтверждены его качество, безопасность и эффективность. При отсутствии препарата-лидера регистрируемый дженерик производят в соответствии с местными, государственными или региональными стандартами, в том числе Международной фармакопеей и Руководством ВОЗ по регистрационным требованиям для определения взаимозаменяемости лекарственных препаратов, выпускаемых несколькими производителями (WorldHealth Organization, 1996, WHO Expert Expert Committee on Specifications for Pharmaceutical Preparations: thirty-fourth report. WHO Technical Report Series No. 863, Geneva, pp. 114-154).
Cлайд 15
 Терапевтическая эквивалентность Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000). В отличие от биоэквивалентности, определение которой регламентируется жесткими стандартами и не вызывает, как правило, неоднозначностей в трактовке результатов, отсутствие четких определений терапевтической эквивалентности приводит к неуверенности как врачей, так и пациентов в правильности выбора тех или иных препаратов генерического ряда. В опубликованном в 1998 году FDA проекте правил оценки терапевтической эквивалентности дженериков предлагается указывать на этикетке препарата наличие или отсутствие терапевтической эквивалентности, а также препарат, с которым производилось сравнение (как правило, это оригинальный препарат).
Терапевтическая эквивалентность Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке (FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 20th Edition, 2000). В отличие от биоэквивалентности, определение которой регламентируется жесткими стандартами и не вызывает, как правило, неоднозначностей в трактовке результатов, отсутствие четких определений терапевтической эквивалентности приводит к неуверенности как врачей, так и пациентов в правильности выбора тех или иных препаратов генерического ряда. В опубликованном в 1998 году FDA проекте правил оценки терапевтической эквивалентности дженериков предлагается указывать на этикетке препарата наличие или отсутствие терапевтической эквивалентности, а также препарат, с которым производилось сравнение (как правило, это оригинальный препарат).
Cлайд 16
 Мнение специалиста Марцевич Сергей Юрьевич Профессор, доктор медицинских наук. Профессор кафедры доказательной медицины ФДПОП ММА им М.И. Сеченова. Председатель секции рациональной фармакотерапии ВНОК, член-корреспондент Российской академии естественных наук «Знакомство с данными … исследований по сравнению клинической эффективности оригинальных препаратов и дженериков показывает, что в их действии могут наблюдаться весьма существенные отличия…» «…все крупные исследования, оценивающие влияние препарата на прогноз жизни и заболевания, в огромном большинстве используют только оригинальные лекарственные препараты…»
Мнение специалиста Марцевич Сергей Юрьевич Профессор, доктор медицинских наук. Профессор кафедры доказательной медицины ФДПОП ММА им М.И. Сеченова. Председатель секции рациональной фармакотерапии ВНОК, член-корреспондент Российской академии естественных наук «Знакомство с данными … исследований по сравнению клинической эффективности оригинальных препаратов и дженериков показывает, что в их действии могут наблюдаться весьма существенные отличия…» «…все крупные исследования, оценивающие влияние препарата на прогноз жизни и заболевания, в огромном большинстве используют только оригинальные лекарственные препараты…»
Cлайд 17
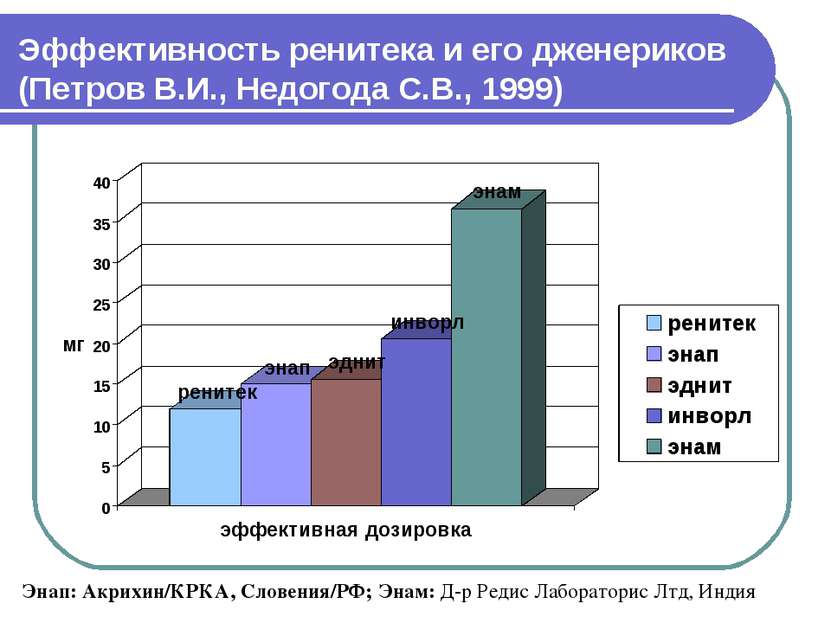
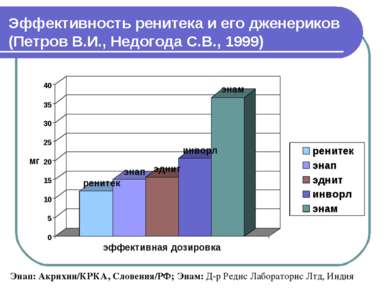 Эффективность ренитека и его дженериков (Петров В.И., Недогода С.В., 1999) Энап: Акрихин/КРКА, Словения/РФ; Энам: Д-р Редис Лабораторис Лтд, Индия
Эффективность ренитека и его дженериков (Петров В.И., Недогода С.В., 1999) Энап: Акрихин/КРКА, Словения/РФ; Энам: Д-р Редис Лабораторис Лтд, Индия
Cлайд 18
 Дженерики: преимущества и недостатки Таблиц взаимозаменяемости дженерических препаратов в РФ не существует. В Интернете можно воспользоваться таблицами из базы FDA (Electronic Orange Book FDA). Дженерики не хуже и не лучше оригинальных ЛС, они - иные ЛС. Пример: дженерики аторвастатина - аторвастатин в аморфной форме распад в течение 7 недель в 10 раз быстрее оригинального препарата содержат примеси от 2 до 10% (оригинальный препарат менее 1%). ЗЫРЯНОВ Сергей Кенсоринович, доц. кафедры клинической фармакологии РГМУ
Дженерики: преимущества и недостатки Таблиц взаимозаменяемости дженерических препаратов в РФ не существует. В Интернете можно воспользоваться таблицами из базы FDA (Electronic Orange Book FDA). Дженерики не хуже и не лучше оригинальных ЛС, они - иные ЛС. Пример: дженерики аторвастатина - аторвастатин в аморфной форме распад в течение 7 недель в 10 раз быстрее оригинального препарата содержат примеси от 2 до 10% (оригинальный препарат менее 1%). ЗЫРЯНОВ Сергей Кенсоринович, доц. кафедры клинической фармакологии РГМУ
Cлайд 19
 Electronic Orange Book Approved Drug Products with Therapeutic Equivalence Evaluations Current through December 2008** ** In order to provide timely consumer information on generic drugs, the Electronic Orange Book is updated daily as new generic approvals occur. Refer to FAQ for additional information. Оранжевая книга FDA U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research Office of Pharmaceutical Science Office of Generic Drugs Publications
Electronic Orange Book Approved Drug Products with Therapeutic Equivalence Evaluations Current through December 2008** ** In order to provide timely consumer information on generic drugs, the Electronic Orange Book is updated daily as new generic approvals occur. Refer to FAQ for additional information. Оранжевая книга FDA U.S. Department of Health and Human Services Food and Drug Administration Center for Drug Evaluation and Research Office of Pharmaceutical Science Office of Generic Drugs Publications
Cлайд 20
 Сравнение терапевтической эффективности липримара и его дженериков Эффективная дозировка – от 20 мг/сут Скорость наступления клинических эффектов – 25-40 дней постоянного приема Клинические эффекты: Урежение приступов загрудинных болей, повышение порога переносимых физических нагрузок Снижение среднесуточного АД Уменьшение и полное исчезновение аритмий На фоне применения аториса, атомакса и торвакарда подобных клинических эффектов не зарегистрировано
Сравнение терапевтической эффективности липримара и его дженериков Эффективная дозировка – от 20 мг/сут Скорость наступления клинических эффектов – 25-40 дней постоянного приема Клинические эффекты: Урежение приступов загрудинных болей, повышение порога переносимых физических нагрузок Снижение среднесуточного АД Уменьшение и полное исчезновение аритмий На фоне применения аториса, атомакса и торвакарда подобных клинических эффектов не зарегистрировано
Cлайд 21
 при принятии врачом решения о переводе пациента с оригинального препарата на генерический у 2/3 больных возникали проблемы, средний показатель при других видах замен ЛС (с дженерика на оригинальный, с дженерика на дженерик) составил 10%. Результаты исследования FDA 1996 г.
при принятии врачом решения о переводе пациента с оригинального препарата на генерический у 2/3 больных возникали проблемы, средний показатель при других видах замен ЛС (с дженерика на оригинальный, с дженерика на дженерик) составил 10%. Результаты исследования FDA 1996 г.
Cлайд 22
 Мнение Association of American Physicians (основана в 1885 г.) Американская ассоциация врачей не рекомендует в качестве замены отпускать лекарственный препарат, которому FDA присвоило код «В» (в США к категории препаратов с кодом «В» FDA относит лекарственные средства, которые по разным причинам в данный момент нельзя считать терапевтически эквивалентными соответствующим препаратам сравнения) (Drug evaluations annual, American Medical Association, 1999, p. 7). Любой врач в США может легко узнать код нужного ему рецептурного лекарственного препарата, заглянув в ежегодно переиздаваемую «Оранжевую книгу», доступную и в сети Интернет. В руководстве ВОЗ по регистрационным требованиям, предъявляемым для определения взаимозаменяемости генерических лекарственных препаратов, также указывается, что «невозможность гарантировать взаимозаменяемость (лекарственных препаратов) может нанести вред здоровью и безопасности пациентов» (WHO Technical Report Series, No. 863, 1996).
Мнение Association of American Physicians (основана в 1885 г.) Американская ассоциация врачей не рекомендует в качестве замены отпускать лекарственный препарат, которому FDA присвоило код «В» (в США к категории препаратов с кодом «В» FDA относит лекарственные средства, которые по разным причинам в данный момент нельзя считать терапевтически эквивалентными соответствующим препаратам сравнения) (Drug evaluations annual, American Medical Association, 1999, p. 7). Любой врач в США может легко узнать код нужного ему рецептурного лекарственного препарата, заглянув в ежегодно переиздаваемую «Оранжевую книгу», доступную и в сети Интернет. В руководстве ВОЗ по регистрационным требованиям, предъявляемым для определения взаимозаменяемости генерических лекарственных препаратов, также указывается, что «невозможность гарантировать взаимозаменяемость (лекарственных препаратов) может нанести вред здоровью и безопасности пациентов» (WHO Technical Report Series, No. 863, 1996).
Cлайд 23
 Особенности отечественного амлодипина Компания «Pfizer» не передавала лицензию на производство и распространение «Норваска» Действие глобального патента на Норваск завершилось лишь в 2008 году! Существующие на российском рынке другие амлодипины («дженерики») были выпущены до завершения действия глобального патента
Особенности отечественного амлодипина Компания «Pfizer» не передавала лицензию на производство и распространение «Норваска» Действие глобального патента на Норваск завершилось лишь в 2008 году! Существующие на российском рынке другие амлодипины («дженерики») были выпущены до завершения действия глобального патента
Cлайд 24
 Особенности дженериков аторвастатина Компания «Pfizer» не передавала лицензию на производство и распространение «Липримара» Глобальный патент на «Липримар» действует до 2011 года Все другие аторвастатины («дженерики») являются непатентованными копиями
Особенности дженериков аторвастатина Компания «Pfizer» не передавала лицензию на производство и распространение «Липримара» Глобальный патент на «Липримар» действует до 2011 года Все другие аторвастатины («дженерики») являются непатентованными копиями
Cлайд 26
 Почему все-таки Оригинальный препарат? Оригинальный препарат: Стабильность физико-химических свойств действующего вещества Высококачественные наполнители и оболочка Доказательства высокой эффективности и безопасности Копия (дженерик): Наличие токсических веществ, продуктов деградации и распада Меньший срок годности Измененные показатели биодоступности Высокий риск токсических и аллергических реакций Риск неожиданных межлекарственных взаимодействий Отсутствие доказательств эффективности и безопасности
Почему все-таки Оригинальный препарат? Оригинальный препарат: Стабильность физико-химических свойств действующего вещества Высококачественные наполнители и оболочка Доказательства высокой эффективности и безопасности Копия (дженерик): Наличие токсических веществ, продуктов деградации и распада Меньший срок годности Измененные показатели биодоступности Высокий риск токсических и аллергических реакций Риск неожиданных межлекарственных взаимодействий Отсутствие доказательств эффективности и безопасности
Cлайд 28
 Е.М. Тареев «Для того, чтобы в наш век лечиться, нужно иметь хорошее здоровье!» Академик Академии медицинских наук СССР (1948), Герой Социалистического Труда (1965), лауреат Сталинской (1946), Ленинской (1974), и Государственной премий СССР (1983), заслуженный деятель науки РСФСР(1948). Один из основоположников советской нефрологии, гепатологии, ревматологиии паразитологии.
Е.М. Тареев «Для того, чтобы в наш век лечиться, нужно иметь хорошее здоровье!» Академик Академии медицинских наук СССР (1948), Герой Социалистического Труда (1965), лауреат Сталинской (1946), Ленинской (1974), и Государственной премий СССР (1983), заслуженный деятель науки РСФСР(1948). Один из основоположников советской нефрологии, гепатологии, ревматологиии паразитологии.
Cлайд 29
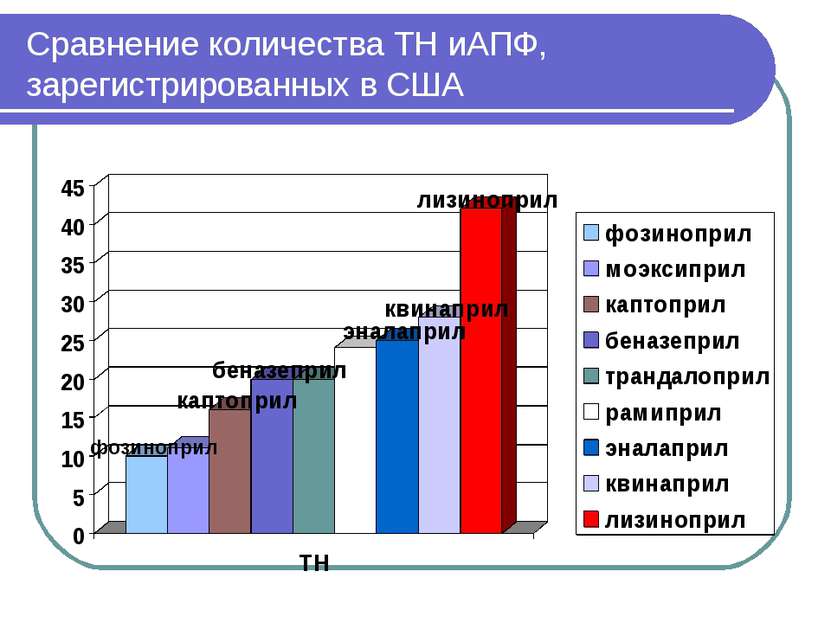
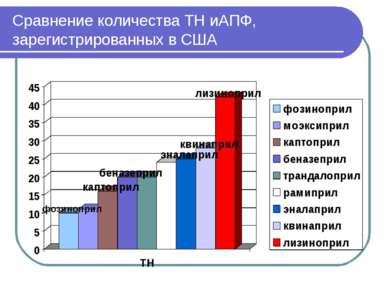
 иАПФ, зарегистрированные в США (результаты поиска в Electronic Orange Book по “…pril” Беназеприл - 20 Каптоприл - 16 Эналаприл - 25 Фозиноприл - 10 Лизиноприл – 42 Моэксиприл - 11 Квинаприл - 28 Рамиприл – 24 Трандалоприл - 20 Периндаприл (PERINDAPRIL)– нет Цилазаприл (CILAZAPRIL) - нет Спираприл (SPIRAPRIL) - нет Зофеноприл (ZOFENOPRIL) - нет
иАПФ, зарегистрированные в США (результаты поиска в Electronic Orange Book по “…pril” Беназеприл - 20 Каптоприл - 16 Эналаприл - 25 Фозиноприл - 10 Лизиноприл – 42 Моэксиприл - 11 Квинаприл - 28 Рамиприл – 24 Трандалоприл - 20 Периндаприл (PERINDAPRIL)– нет Цилазаприл (CILAZAPRIL) - нет Спираприл (SPIRAPRIL) - нет Зофеноприл (ZOFENOPRIL) - нет
Cлайд 31
 Маркировка лекарственных средств по системе FDA A Drug products that FDA considers to be therapeutically equivalent to other pharmaceutically equivalent products, i.e., drug products for which: (1) there are no known or suspected bioequivalence problems. These are designated AA, AN, AO, AP, or AT, depending on the dosage form; or (2) actual or potential bioequivalence problems have been resolved with adequate in vivo and/or in vitro evidence supporting bioequivalence. These are designated AB. B Drug products that FDA at this time, considers NOT to be therapeutically equivalent to other pharmaceutically equivalent products, i.e., drug products for which actual or potential bioequivalence problems have not been resolved by adequate evidence of bioequivalence. Often the problem is with specific dosage forms rather than with the active ingredients. These are designated BC, BD, BE, BN, BP, BR, BS, BT, BX, or B*.AA Products in conventional dosage forms not presenting bioequivalence problems Products coded as AA contain active ingredients and dosage forms that are not regarded as presenting either actual or potential bioequivalence problems or drug quality or standards issues. However, all oral dosage forms must, nonetheless, meet an appropriate in vitro bioequivalence standard that is acceptable to the Agency in order to be approved. Код «А» - препарат с подтвержденной терапевтической эквивалентностью (сведения о прблемах биоэквивалентности препарата отсутствуют) Код «АВ» - то же, что и код «А», но сведения о прблемах биоэквивалентности имели место (но были опровергнуты дополнительными исследованиями) Код «В» - терапевтическая эквивалентность препарата не подтверждена
Маркировка лекарственных средств по системе FDA A Drug products that FDA considers to be therapeutically equivalent to other pharmaceutically equivalent products, i.e., drug products for which: (1) there are no known or suspected bioequivalence problems. These are designated AA, AN, AO, AP, or AT, depending on the dosage form; or (2) actual or potential bioequivalence problems have been resolved with adequate in vivo and/or in vitro evidence supporting bioequivalence. These are designated AB. B Drug products that FDA at this time, considers NOT to be therapeutically equivalent to other pharmaceutically equivalent products, i.e., drug products for which actual or potential bioequivalence problems have not been resolved by adequate evidence of bioequivalence. Often the problem is with specific dosage forms rather than with the active ingredients. These are designated BC, BD, BE, BN, BP, BR, BS, BT, BX, or B*.AA Products in conventional dosage forms not presenting bioequivalence problems Products coded as AA contain active ingredients and dosage forms that are not regarded as presenting either actual or potential bioequivalence problems or drug quality or standards issues. However, all oral dosage forms must, nonetheless, meet an appropriate in vitro bioequivalence standard that is acceptable to the Agency in order to be approved. Код «А» - препарат с подтвержденной терапевтической эквивалентностью (сведения о прблемах биоэквивалентности препарата отсутствуют) Код «АВ» - то же, что и код «А», но сведения о прблемах биоэквивалентности имели место (но были опровергнуты дополнительными исследованиями) Код «В» - терапевтическая эквивалентность препарата не подтверждена