X
Код презентации скопируйте его
Фенолы
Скачать эту презентациюПрезентация на тему Фенолы
Скачать эту презентациюCлайд 2
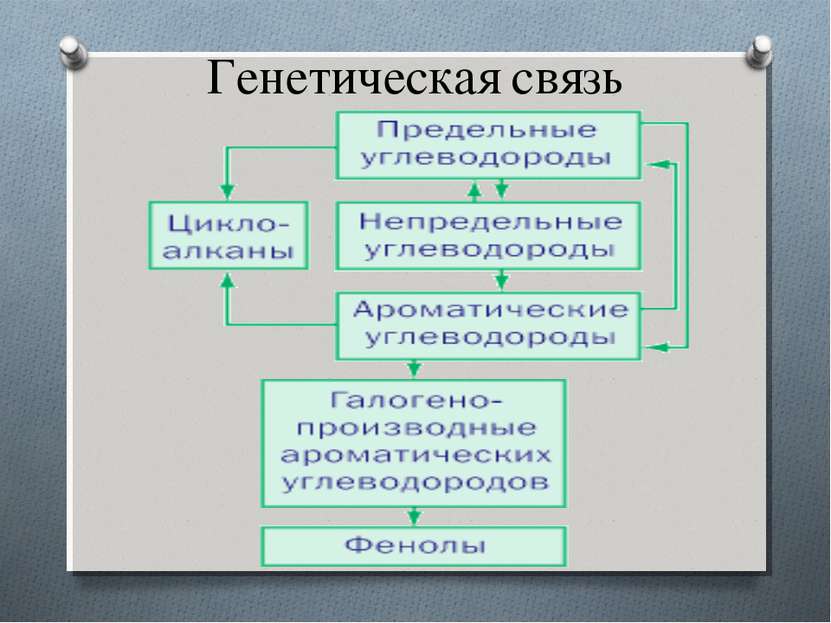
 План: Фенолы Классификация фенолов Номенклатура Строение молекулы Физические свойства фенола Химические свойства фенола Получение фенолов Применение фенола Генетическая связь
План: Фенолы Классификация фенолов Номенклатура Строение молекулы Физические свойства фенола Химические свойства фенола Получение фенолов Применение фенола Генетическая связь
Cлайд 3
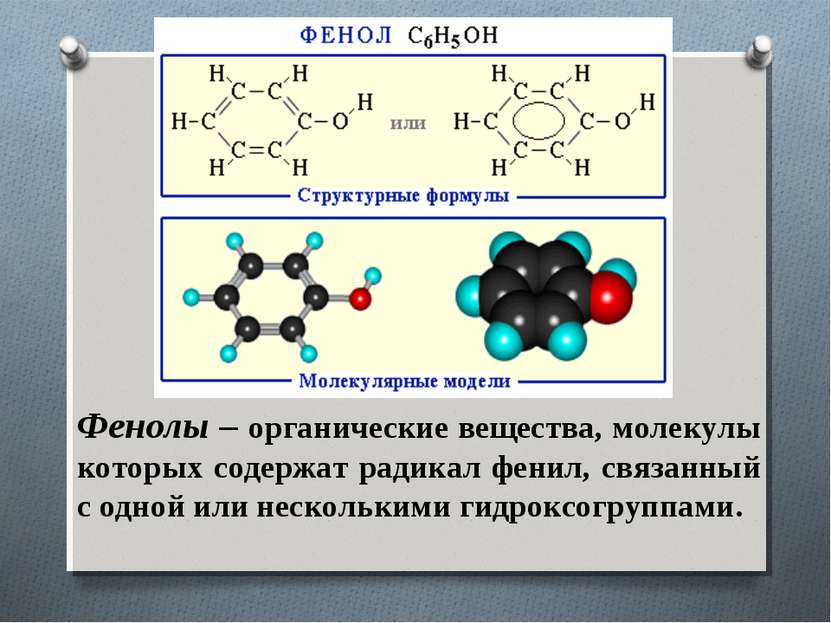
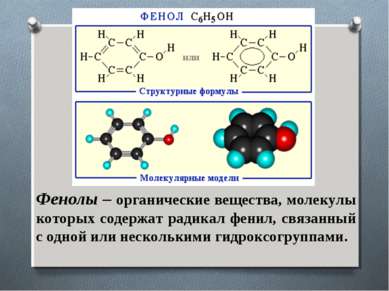 Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Фенолы – органические вещества, молекулы которых содержат радикал фенил, связанный с одной или несколькими гидроксогруппами.
Cлайд 4
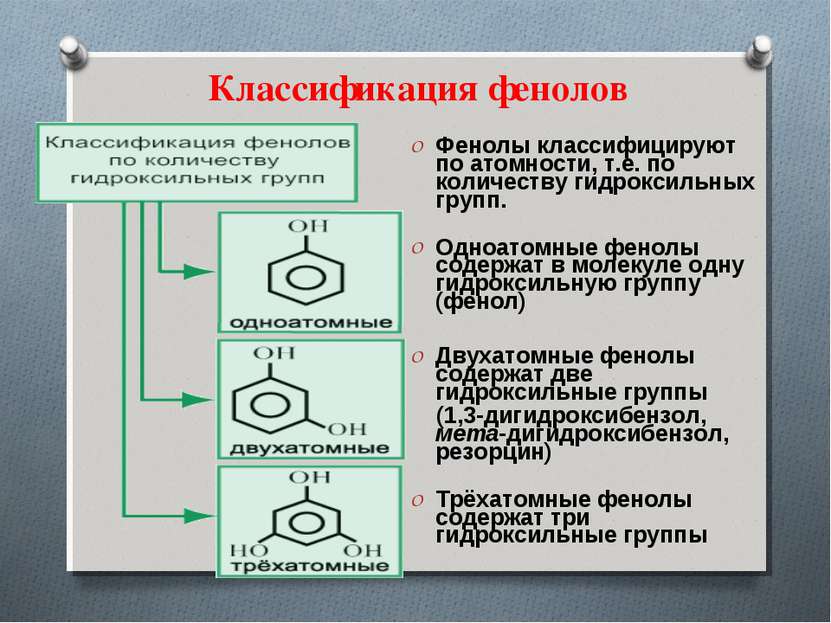
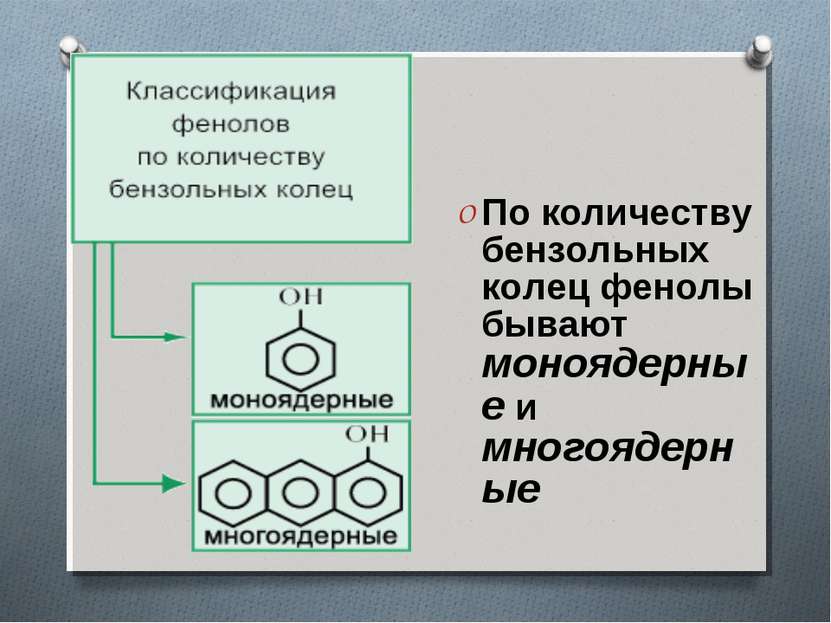
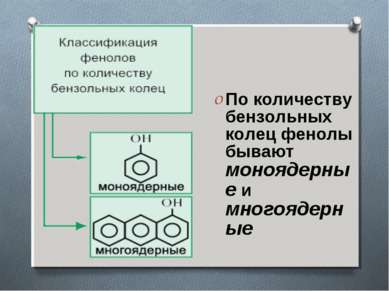
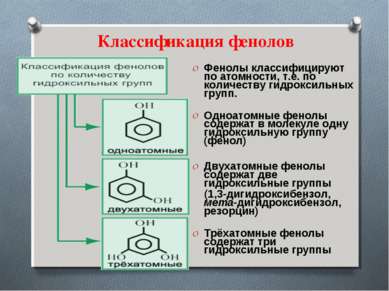 Классификация фенолов Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп. Одноатомные фенолы содержат в молекуле одну гидроксильную группу (фенол) Двухатомные фенолы содержат две гидроксильные группы (1,3-дигидроксибензол, мета-дигидроксибензол, резорцин) Трёхатомные фенолы содержат три гидроксильные группы
Классификация фенолов Фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп. Одноатомные фенолы содержат в молекуле одну гидроксильную группу (фенол) Двухатомные фенолы содержат две гидроксильные группы (1,3-дигидроксибензол, мета-дигидроксибензол, резорцин) Трёхатомные фенолы содержат три гидроксильные группы
Cлайд 6
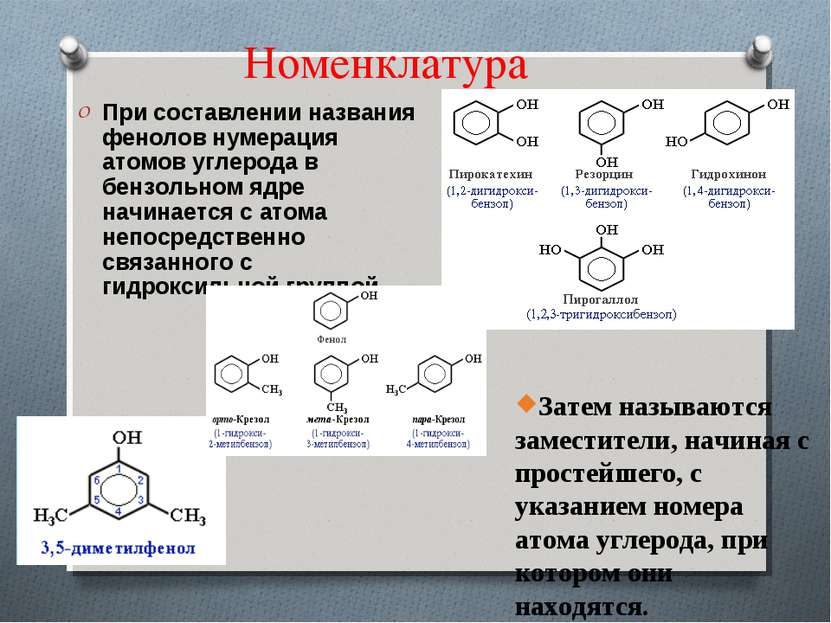
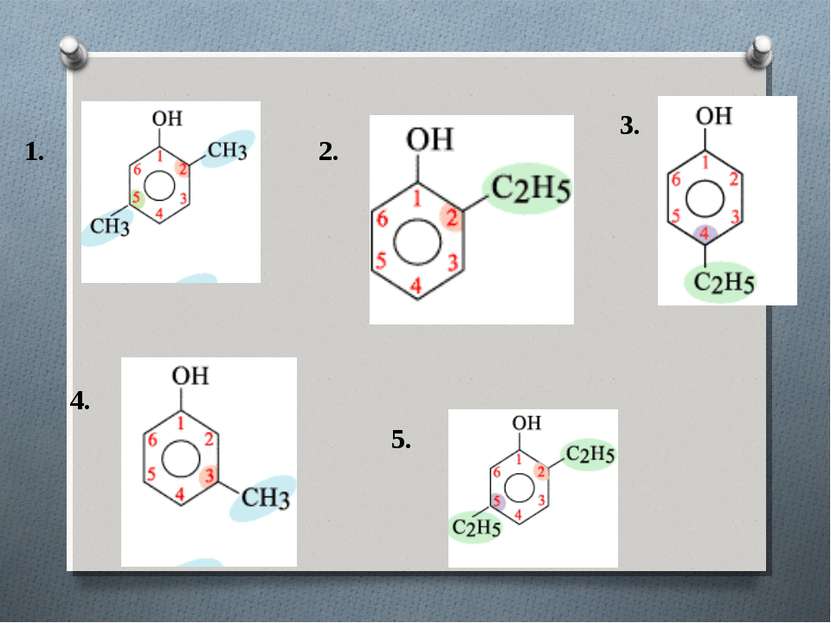
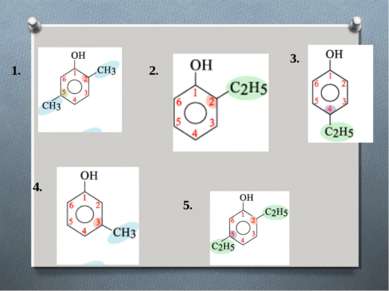
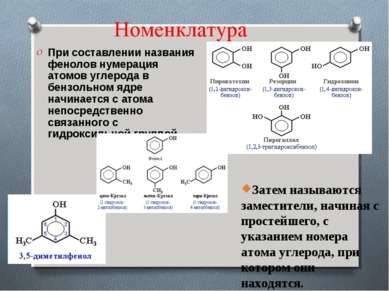 Номенклатура При составлении названия фенолов нумерация атомов углерода в бензольном ядре начинается с атома непосредственно связанного с гидроксильной группой . Затем называются заместители, начиная с простейшего, с указанием номера атома углерода, при котором они находятся.
Номенклатура При составлении названия фенолов нумерация атомов углерода в бензольном ядре начинается с атома непосредственно связанного с гидроксильной группой . Затем называются заместители, начиная с простейшего, с указанием номера атома углерода, при котором они находятся.
Cлайд 8
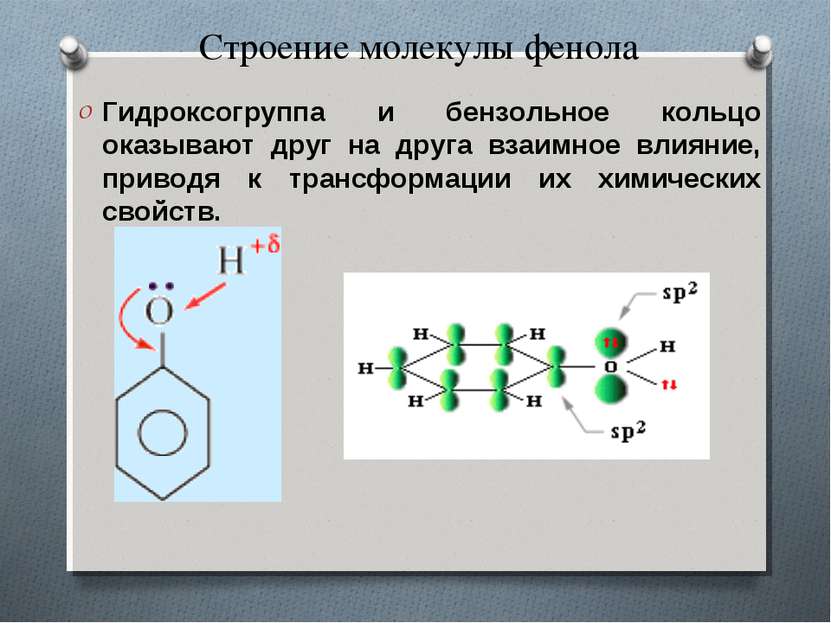
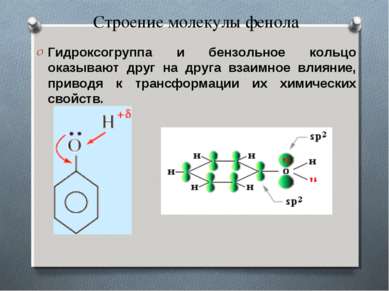 Строение молекулы фенола Гидроксогруппа и бензольное кольцо оказывают друг на друга взаимное влияние, приводя к трансформации их химических свойств.
Строение молекулы фенола Гидроксогруппа и бензольное кольцо оказывают друг на друга взаимное влияние, приводя к трансформации их химических свойств.
Cлайд 9
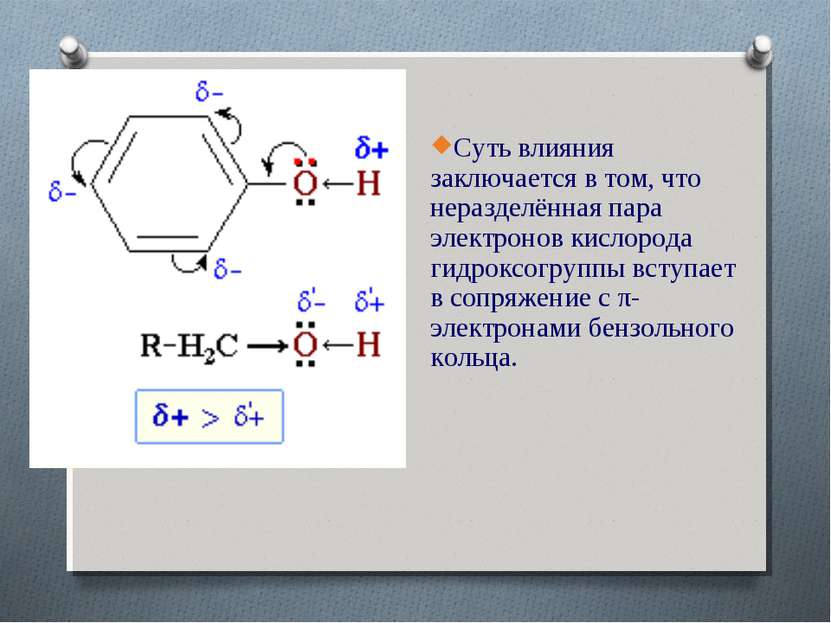
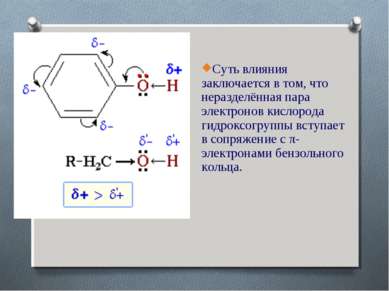 Суть влияния заключается в том, что неразделённая пара электронов кислорода гидроксогруппы вступает в сопряжение с π-электронами бензольного кольца.
Суть влияния заключается в том, что неразделённая пара электронов кислорода гидроксогруппы вступает в сопряжение с π-электронами бензольного кольца.
Cлайд 10
 Физические свойства фенола Фенол - твёрдое бесцветное кристаллическое вещество. Вследствие частичного окисления на воздухе он бывает окрашен в розовый цвет. Его температура плавления +42ºС, температура кипения +181ºС. Фенол обладает резким характерным запахом. В холодной воде он мало растворим, но уже при 70 ºС растворяется в любых отношениях.
Физические свойства фенола Фенол - твёрдое бесцветное кристаллическое вещество. Вследствие частичного окисления на воздухе он бывает окрашен в розовый цвет. Его температура плавления +42ºС, температура кипения +181ºС. Фенол обладает резким характерным запахом. В холодной воде он мало растворим, но уже при 70 ºС растворяется в любых отношениях.
Cлайд 11
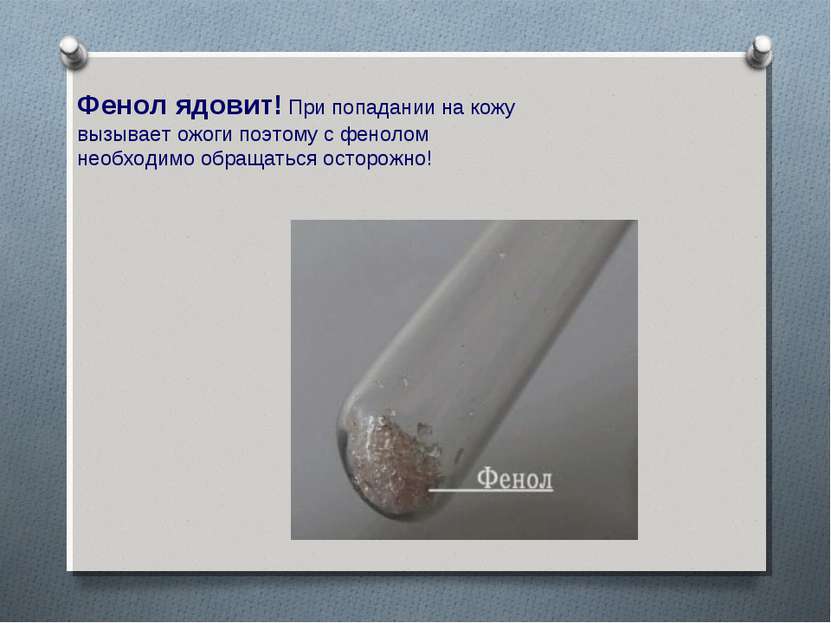
 Фенол ядовит! При попадании на кожу вызывает ожоги поэтому с фенолом необходимо обращаться осторожно!
Фенол ядовит! При попадании на кожу вызывает ожоги поэтому с фенолом необходимо обращаться осторожно!
Cлайд 12
 Химические свойства фенола Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы бензольного ядра
Химические свойства фенола Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы бензольного ядра
Cлайд 13
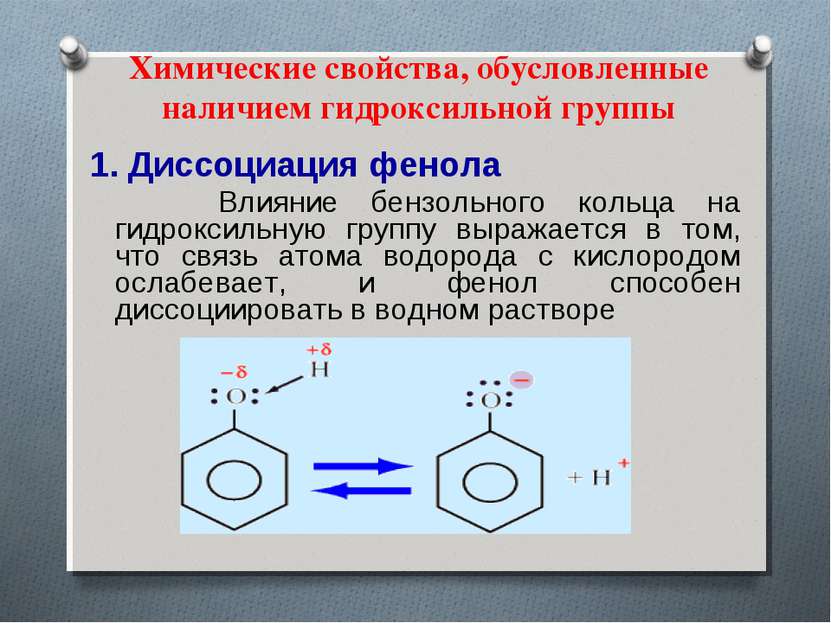
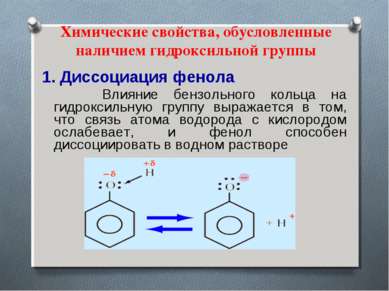 Химические свойства, обусловленные наличием гидроксильной группы 1. Диссоциация фенола Влияние бензольного кольца на гидроксильную группу выражается в том, что связь атома водорода с кислородом ослабевает, и фенол способен диссоциировать в водном растворе
Химические свойства, обусловленные наличием гидроксильной группы 1. Диссоциация фенола Влияние бензольного кольца на гидроксильную группу выражается в том, что связь атома водорода с кислородом ослабевает, и фенол способен диссоциировать в водном растворе
Cлайд 14
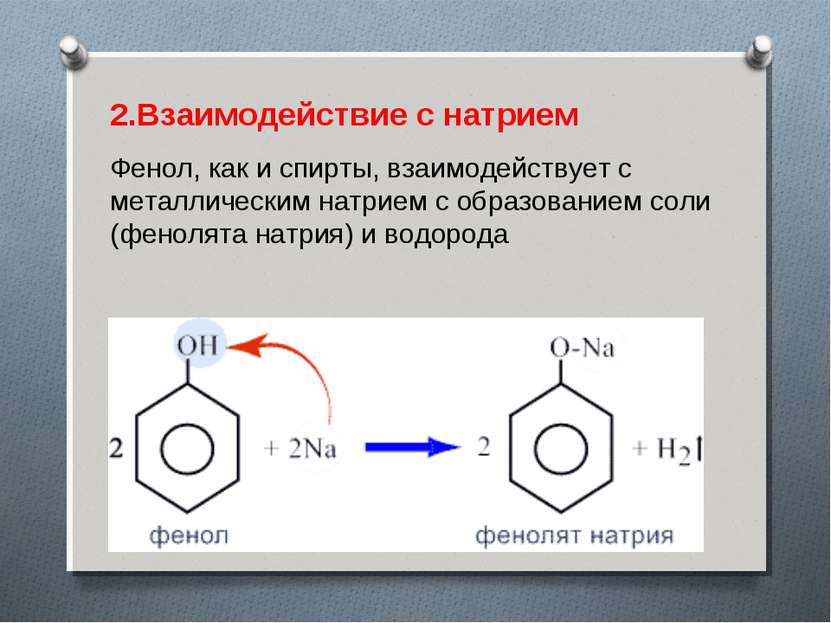
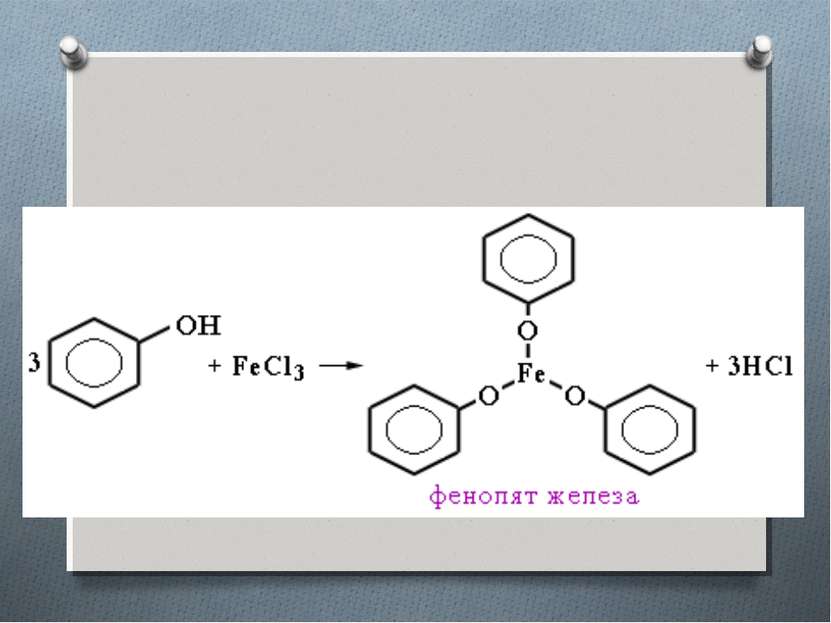
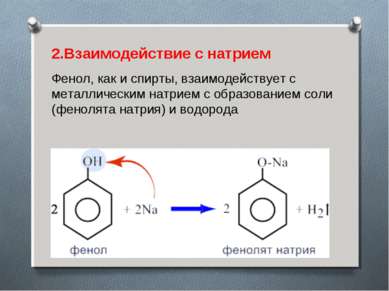 2.Взаимодействие с натрием Фенол, как и спирты, взаимодействует с металлическим натрием с образованием соли (фенолята натрия) и водорода
2.Взаимодействие с натрием Фенол, как и спирты, взаимодействует с металлическим натрием с образованием соли (фенолята натрия) и водорода
Cлайд 15
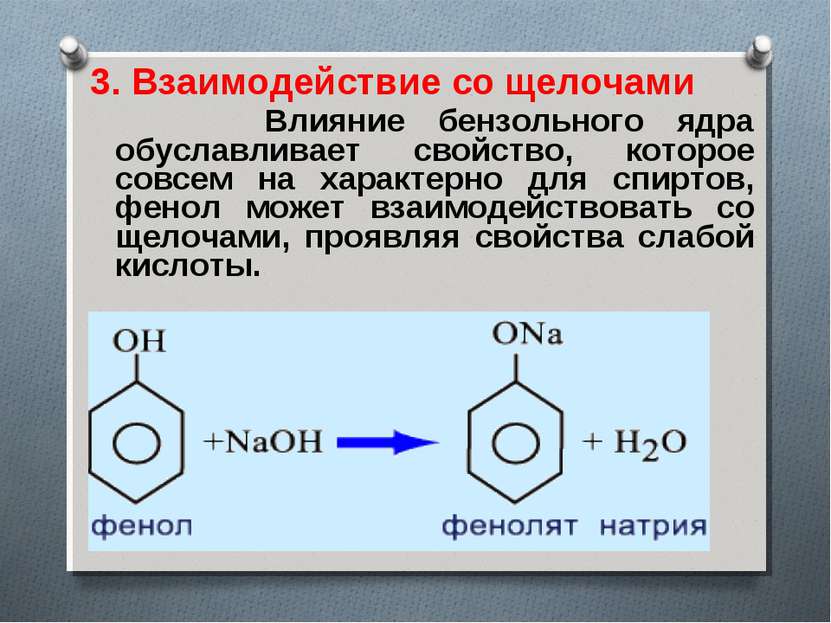
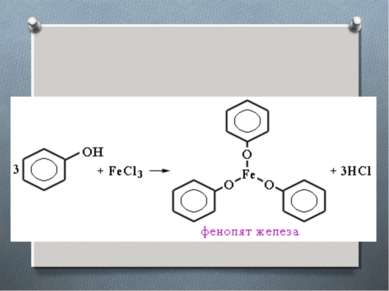
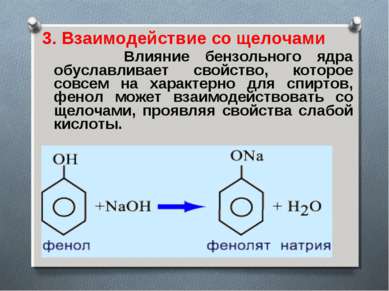 3. Взаимодействие со щелочами Влияние бензольного ядра обуславливает свойство, которое совсем на характерно для спиртов, фенол может взаимодействовать со щелочами, проявляя свойства слабой кислоты.
3. Взаимодействие со щелочами Влияние бензольного ядра обуславливает свойство, которое совсем на характерно для спиртов, фенол может взаимодействовать со щелочами, проявляя свойства слабой кислоты.
Cлайд 17
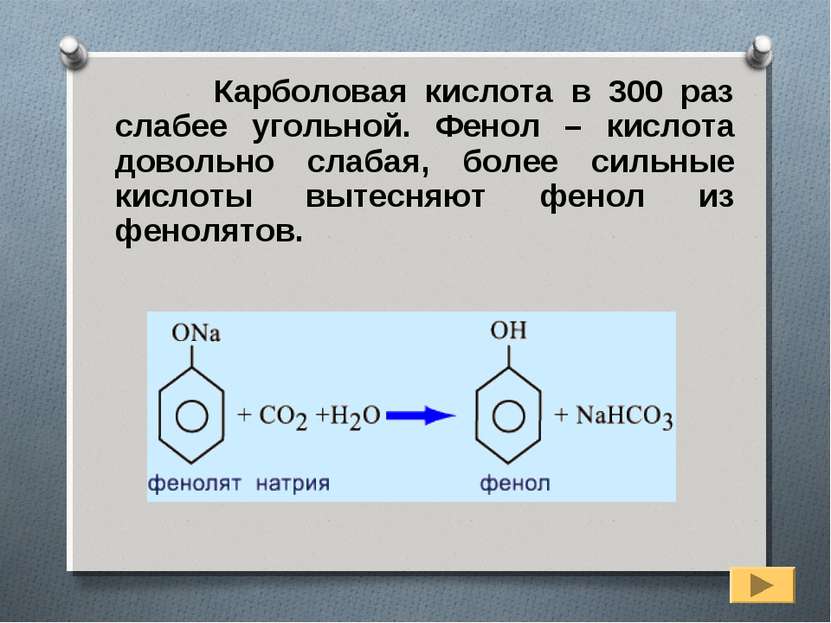
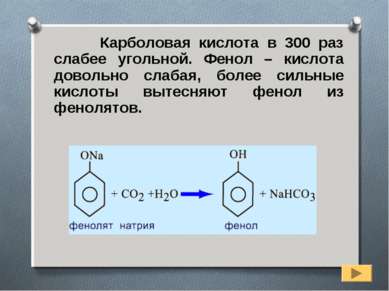 Карболовая кислота в 300 раз слабее угольной. Фенол – кислота довольно слабая, более сильные кислоты вытесняют фенол из фенолятов.
Карболовая кислота в 300 раз слабее угольной. Фенол – кислота довольно слабая, более сильные кислоты вытесняют фенол из фенолятов.
Cлайд 18
 Химические свойства, обусловленные наличием бензольного ядра Отличия от ароматических углеводородов: 1. Реакции окисления Фенол окисляется кислородом воздуха, приобретая фиолетовую окраску.
Химические свойства, обусловленные наличием бензольного ядра Отличия от ароматических углеводородов: 1. Реакции окисления Фенол окисляется кислородом воздуха, приобретая фиолетовую окраску.
Cлайд 19
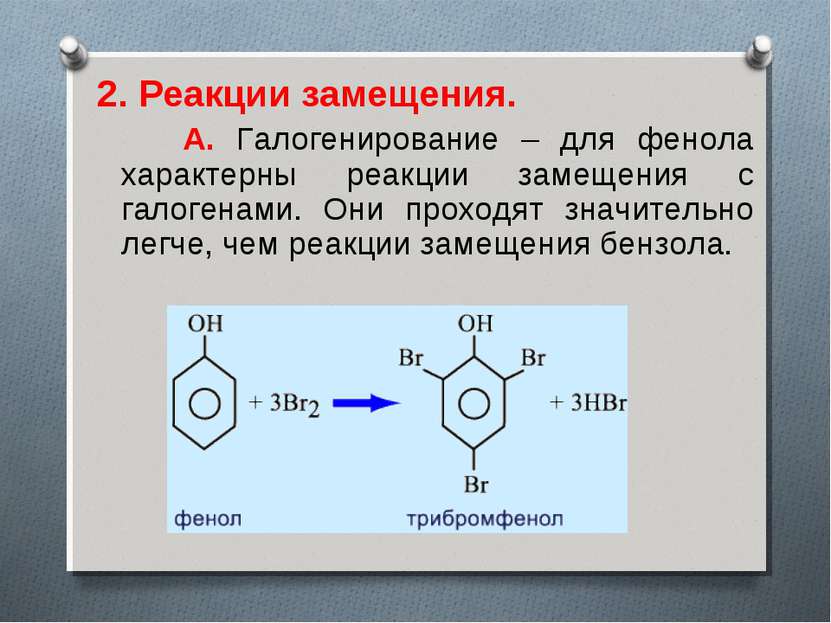
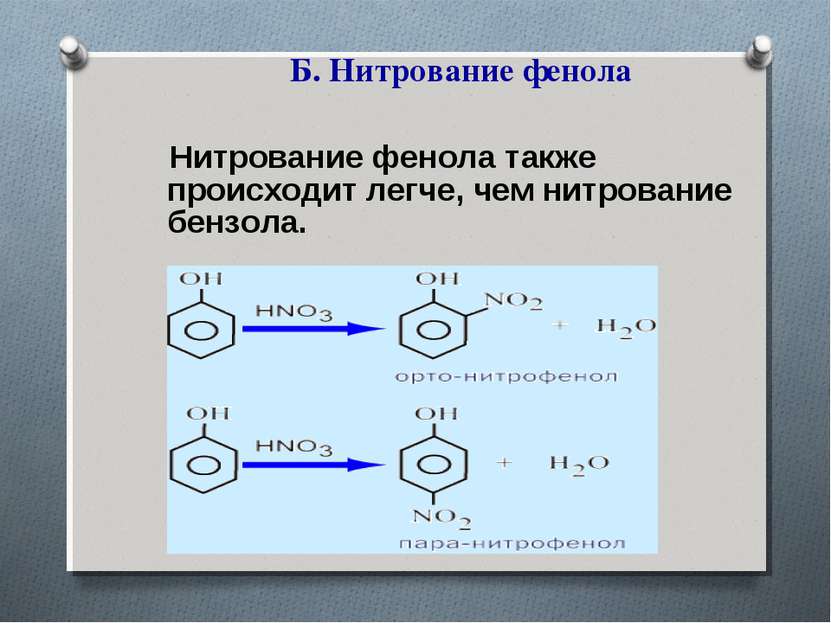
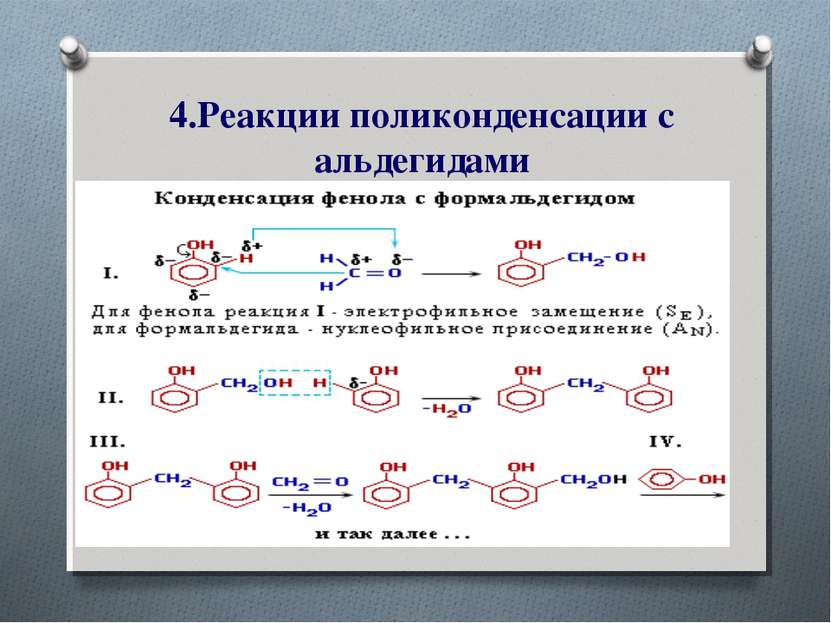
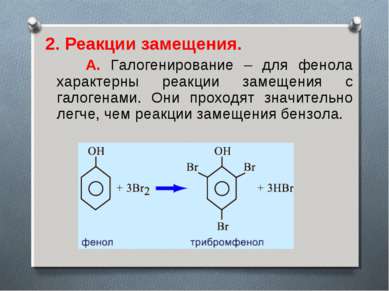 2. Реакции замещения. А. Галогенирование – для фенола характерны реакции замещения с галогенами. Они проходят значительно легче, чем реакции замещения бензола.
2. Реакции замещения. А. Галогенирование – для фенола характерны реакции замещения с галогенами. Они проходят значительно легче, чем реакции замещения бензола.
Cлайд 22
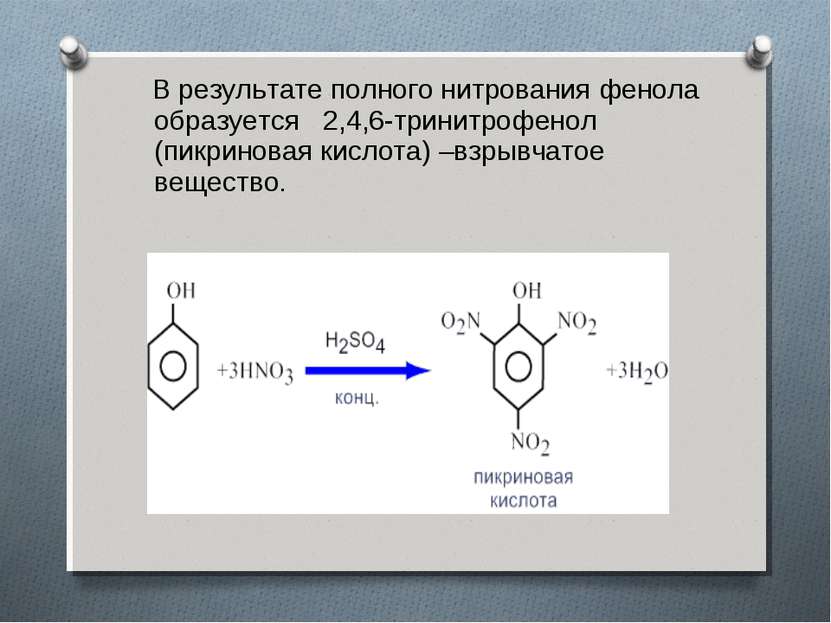
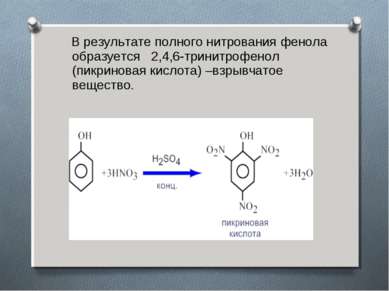 В результате полного нитрования фенола образуется 2,4,6-тринитрофенол (пикриновая кислота) –взрывчатое вещество.
В результате полного нитрования фенола образуется 2,4,6-тринитрофенол (пикриновая кислота) –взрывчатое вещество.
Cлайд 23
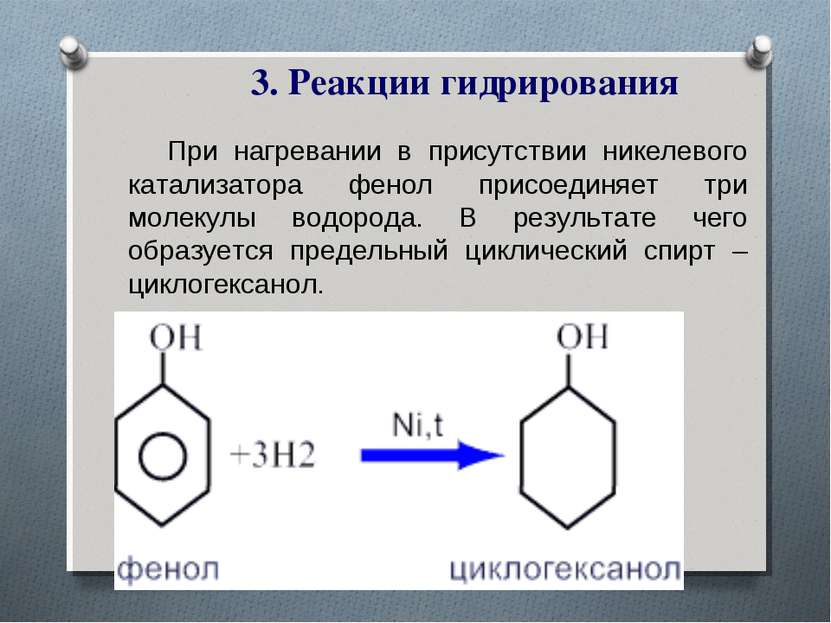
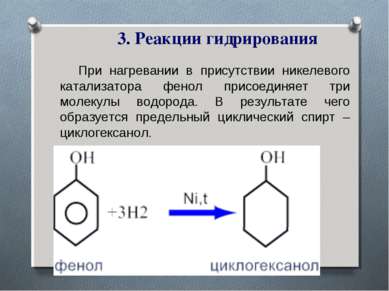 3. Реакции гидрирования При нагревании в присутствии никелевого катализатора фенол присоединяет три молекулы водорода. В результате чего образуется предельный циклический спирт – циклогексанол.
3. Реакции гидрирования При нагревании в присутствии никелевого катализатора фенол присоединяет три молекулы водорода. В результате чего образуется предельный циклический спирт – циклогексанол.