X
Код презентации скопируйте его
Как устроен мир
Скачать эту презентациюПрезентация на тему Как устроен мир
Скачать эту презентациюCлайд 2
 Немного истории Понятие об атомах зародилось еще в Древней Греции. Теория была столь же проста сколь и категорична: невозможно беспредельно делить на части что бы то ни было. Наступит момент, когда частицы уже не поддадутся дальнейшему делению. Их-то мы теперь и называем атомами, от греческого «атомос» - «неделимый».
Немного истории Понятие об атомах зародилось еще в Древней Греции. Теория была столь же проста сколь и категорична: невозможно беспредельно делить на части что бы то ни было. Наступит момент, когда частицы уже не поддадутся дальнейшему делению. Их-то мы теперь и называем атомами, от греческого «атомос» - «неделимый».
Cлайд 3
 Разные точки зрения Первое изложение этой теории относится примерно к 400 г. До н.э. и принадлежит двум греческим философам Левкиппу и Демокриту. Их занимал вопрос о её делимости на всё более мелкие частицы - конечен ли этот процесс или бесконечен. Если деление можно продолжать как угодно долго, значит, материя непрерывна, и ее структура принципиально не меняется при любом «увеличении».
Разные точки зрения Первое изложение этой теории относится примерно к 400 г. До н.э. и принадлежит двум греческим философам Левкиппу и Демокриту. Их занимал вопрос о её делимости на всё более мелкие частицы - конечен ли этот процесс или бесконечен. Если деление можно продолжать как угодно долго, значит, материя непрерывна, и ее структура принципиально не меняется при любом «увеличении».
Cлайд 4
 Если же деление нельзя продолжать бесконечно, рано поздно мы дойдём до мельчайшей частички, которую Демокрит назвал атомом, что в переводе и означает «неделимый». Четыре первоначала Аристотеля. Аристотель Некоторые философы, включая и самого знаменитого – Аристотеля (384 – 322 гг. до н.э.), оспаривали идею о неделимых частицах. Их точка зрения заключалась в том, что все состоит из четырех элементов: земли, огня, воздуха и воды, которые и определяют такие свойства веществ, как сухость, тепло, холод и влажность.
Если же деление нельзя продолжать бесконечно, рано поздно мы дойдём до мельчайшей частички, которую Демокрит назвал атомом, что в переводе и означает «неделимый». Четыре первоначала Аристотеля. Аристотель Некоторые философы, включая и самого знаменитого – Аристотеля (384 – 322 гг. до н.э.), оспаривали идею о неделимых частицах. Их точка зрения заключалась в том, что все состоит из четырех элементов: земли, огня, воздуха и воды, которые и определяют такие свойства веществ, как сухость, тепло, холод и влажность.
Cлайд 5
 Британский химик Роберт Бойль (1627 – 1691) выдвинул предположение, что материя состоит их неких первичных частиц, которые, соединяясь вместе, образуют и более крупные частицы – корпускулы. Британский химик Джон Дальтон (1766 – 1844) впервые ввел термин «атом», излагая свою атомистическую теорию в 1807 году. Его теория означала новую ступень в науке. Вот ее основные положения: Вся материя состоит из мельчайших частиц, называемых атомами. Атомы не создаются вновь, не разрушаются и не делятся. Атомы одного и того же элемента совершенно одинаковы. Химические реакции – это результат перегруппировки атомов. Атомы способны соединяться, образуя более крупные частицы сложных веществ. Впоследствии Дальтон предположил, что атом в принципе может быть разделен на еще более мелкие частицы.
Британский химик Роберт Бойль (1627 – 1691) выдвинул предположение, что материя состоит их неких первичных частиц, которые, соединяясь вместе, образуют и более крупные частицы – корпускулы. Британский химик Джон Дальтон (1766 – 1844) впервые ввел термин «атом», излагая свою атомистическую теорию в 1807 году. Его теория означала новую ступень в науке. Вот ее основные положения: Вся материя состоит из мельчайших частиц, называемых атомами. Атомы не создаются вновь, не разрушаются и не делятся. Атомы одного и того же элемента совершенно одинаковы. Химические реакции – это результат перегруппировки атомов. Атомы способны соединяться, образуя более крупные частицы сложных веществ. Впоследствии Дальтон предположил, что атом в принципе может быть разделен на еще более мелкие частицы.
Cлайд 6
 Модели атомов «пудинг с изюмом» - предложил на грани ХIХ и ХХ веков английский ученый Дж. Дж. Томсон (1856 – 1940). В этой модели отрицательно заряженные зерна были погружены в некую твердую субстанцию. Эрнест Резерфорд (1871 – 1937) предложил модель, в которой отрицательно заряженные частицы – электроны –вращаются вокруг положительно заряженного ядра. Эту модель усовершенствовал датский физик Нильс Бор (1885 – 1962), предложивший, что электроны движутся по вполне определенным орбитам.
Модели атомов «пудинг с изюмом» - предложил на грани ХIХ и ХХ веков английский ученый Дж. Дж. Томсон (1856 – 1940). В этой модели отрицательно заряженные зерна были погружены в некую твердую субстанцию. Эрнест Резерфорд (1871 – 1937) предложил модель, в которой отрицательно заряженные частицы – электроны –вращаются вокруг положительно заряженного ядра. Эту модель усовершенствовал датский физик Нильс Бор (1885 – 1962), предложивший, что электроны движутся по вполне определенным орбитам.
Cлайд 7
 В 1932 году английский физик Джеймс Чедвик (1891 – 1974) создал новую модель. Хоть она и походила на предыдущие, но была более точной в отношении ядра атома, которое теперь предполагалось состоящим из частиц, называемых протонами и нейтронами. Современные ученые пользуются моделью электронных облаков. Каждое такое облако – часть пространства, где нахождение электрона наиболее вероятно.
В 1932 году английский физик Джеймс Чедвик (1891 – 1974) создал новую модель. Хоть она и походила на предыдущие, но была более точной в отношении ядра атома, которое теперь предполагалось состоящим из частиц, называемых протонами и нейтронами. Современные ученые пользуются моделью электронных облаков. Каждое такое облако – часть пространства, где нахождение электрона наиболее вероятно.
Cлайд 8
 Соединение атомов Ковалентные соединения: при образовании ковалентных соединений атомы различных элементов делятся друг с другом своими электронами. Обычно так бывает с различными неметаллами. Обобществление электронов связывает атомы вместе: образуется новая молекула. Пример ковалентного соединения – вода. Ионные соединения: получаются когда атом металла отдает электроны атому неметалла. Атом металла становится катионом, а атом неметалла – анионом. Оба они удерживаются вместе взаимным притяжением своих противоположных зарядов. Хлорид натрия (поваренная соль) – пример ионного соединения.
Соединение атомов Ковалентные соединения: при образовании ковалентных соединений атомы различных элементов делятся друг с другом своими электронами. Обычно так бывает с различными неметаллами. Обобществление электронов связывает атомы вместе: образуется новая молекула. Пример ковалентного соединения – вода. Ионные соединения: получаются когда атом металла отдает электроны атому неметалла. Атом металла становится катионом, а атом неметалла – анионом. Оба они удерживаются вместе взаимным притяжением своих противоположных зарядов. Хлорид натрия (поваренная соль) – пример ионного соединения.
Cлайд 9
 Такая разная материя Твердые тела, жидкости и газы – это различные агрегатные состояния вещества. Вещество не обязано всегда находиться в одном и том же состоянии. Состояние молекул, образующих вещество может измениться под действием температуры.
Такая разная материя Твердые тела, жидкости и газы – это различные агрегатные состояния вещества. Вещество не обязано всегда находиться в одном и том же состоянии. Состояние молекул, образующих вещество может измениться под действием температуры.
Cлайд 10
 Газообразное состояние вещества Газы не имеют собственной формы и объёма и, как правило, смешиваются друг с другом в любых соотношениях (если, конечно, между ними не идёт химическая реакция). Эти свойства газов обусловлены тем, что молекулы в них находятся далеко друг от друга. «газ» - «хаос» (греч.)
Газообразное состояние вещества Газы не имеют собственной формы и объёма и, как правило, смешиваются друг с другом в любых соотношениях (если, конечно, между ними не идёт химическая реакция). Эти свойства газов обусловлены тем, что молекулы в них находятся далеко друг от друга. «газ» - «хаос» (греч.)
Cлайд 11
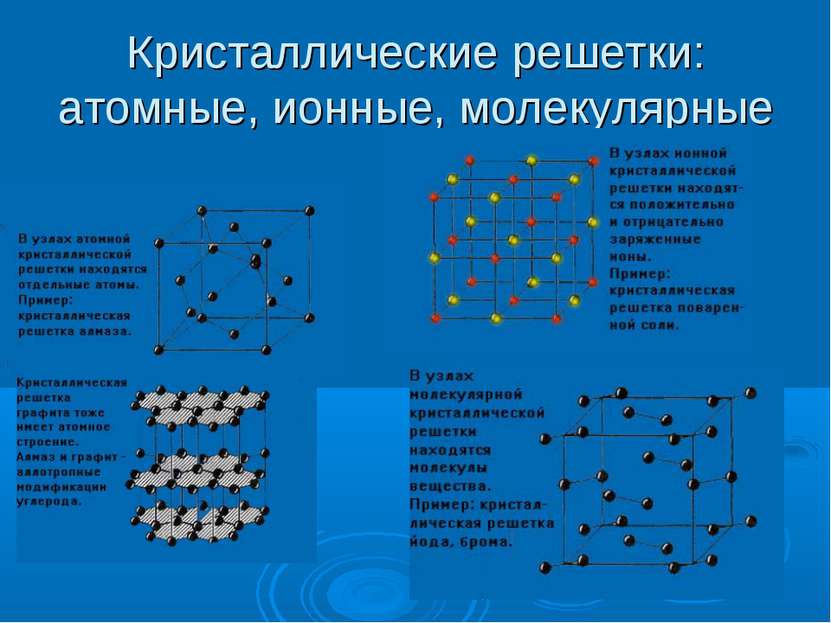
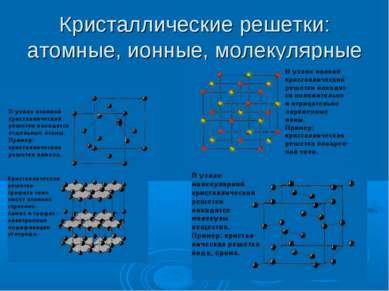
 Конденсированное состояние вещества К конденсированным системам относятся жидкости и твердые тела. В жидкостях и твердых телах молекулы расположены ближе друг к другу, поэтому их плотность больше плотности газов. Основное отличие твердого состояния от жидкого состоит в том, что в твердом веществе его атомы, молекулы или ионы находятся постоянно в узлах кристаллической решетки и лишь испытывают тепловые колебания, а в жидкости они беспорядочно движутся, скользят относительно друг друга, чем обусловлено основное свойство жидкости – текучесть, т.е. способность принимать форму того сосуда, в котором она находится.
Конденсированное состояние вещества К конденсированным системам относятся жидкости и твердые тела. В жидкостях и твердых телах молекулы расположены ближе друг к другу, поэтому их плотность больше плотности газов. Основное отличие твердого состояния от жидкого состоит в том, что в твердом веществе его атомы, молекулы или ионы находятся постоянно в узлах кристаллической решетки и лишь испытывают тепловые колебания, а в жидкости они беспорядочно движутся, скользят относительно друг друга, чем обусловлено основное свойство жидкости – текучесть, т.е. способность принимать форму того сосуда, в котором она находится.