X
Код презентации скопируйте его
Аминокислоты
Скачать эту презентациюПрезентация на тему Аминокислоты
Скачать эту презентациюCлайд 2
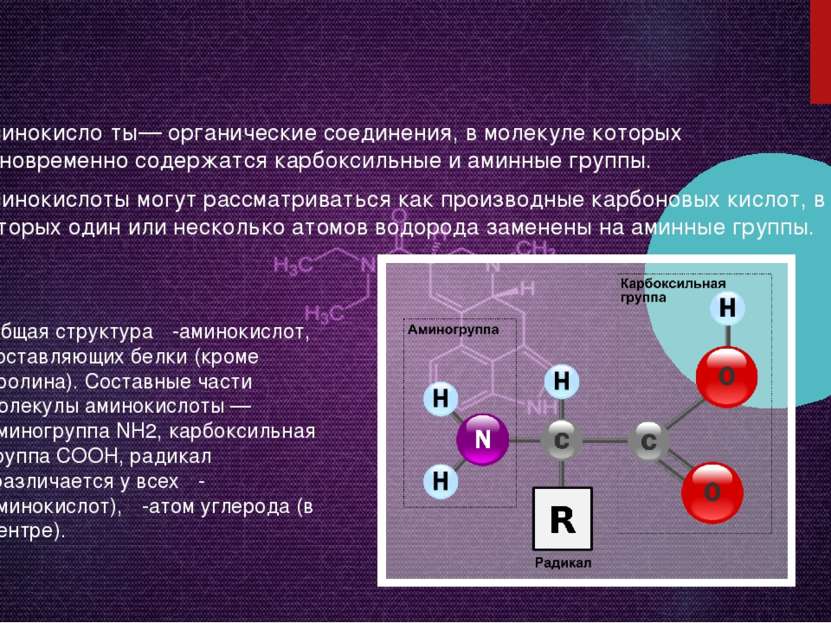
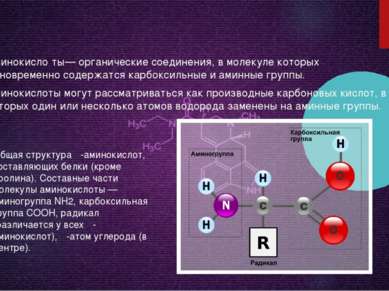 Аминокисло ты— органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы. Общая структура α-аминокислот, составляющих белки (кроме пролина). Составные части молекулы аминокислоты — аминогруппа NH2, карбоксильная группа COOH, радикал (различается у всех α-аминокислот), α-атом углерода (в центре).
Аминокисло ты— органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминные группы. Общая структура α-аминокислот, составляющих белки (кроме пролина). Составные части молекулы аминокислоты — аминогруппа NH2, карбоксильная группа COOH, радикал (различается у всех α-аминокислот), α-атом углерода (в центре).
Cлайд 3
 Физические свойства Аминокислоты кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. α-аминокислоты являются амфотерными электролитами.
Физические свойства Аминокислоты кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной. α-аминокислоты являются амфотерными электролитами.
Cлайд 4
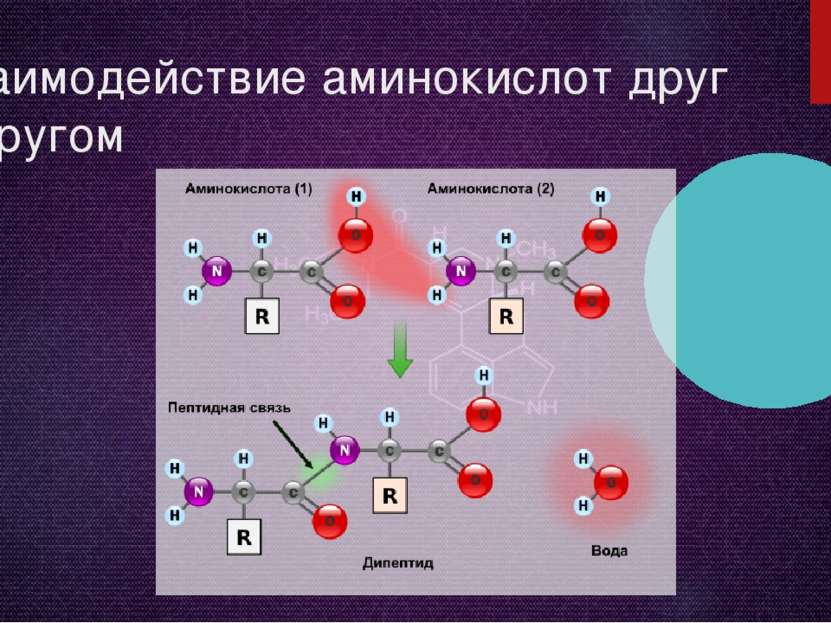
 Общие химические свойства Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами: NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина) NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина) Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей. NH2 —CH2COOH N+H3 —CH2COO- Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Общие химические свойства Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами: NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина) NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина) Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей. NH2 —CH2COOH N+H3 —CH2COO- Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Cлайд 5
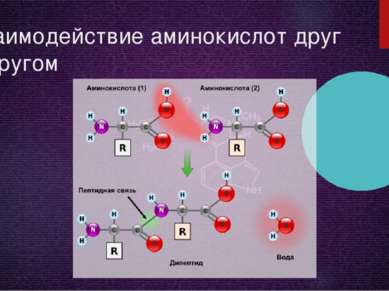
 NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина) Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона. Реакция образования пептидов: HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина) Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона. Реакция образования пептидов: HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Cлайд 7
 Получение Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций: CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2 —CH2COOH + NH4Cl
Получение Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций: CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3 → NH2 —CH2COOH + NH4Cl
Cлайд 8
 Применение Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта. Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глютаминовой кислоты
Применение Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта. Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глютаминовой кислоты