X
Код презентации скопируйте его
Химические свойства алкенов. Получение
Скачать эту презентациюПрезентация на тему Химические свойства алкенов. Получение
Скачать эту презентациюCлайд 2
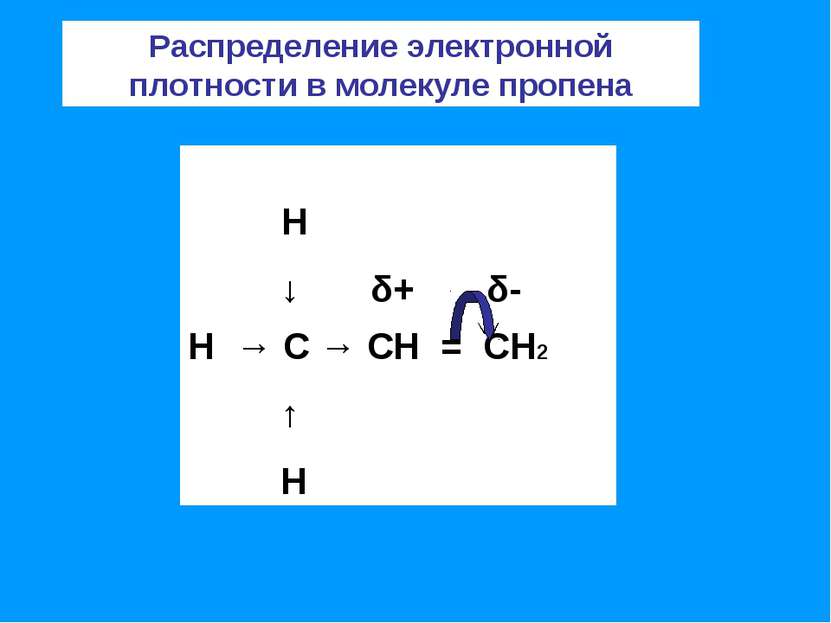
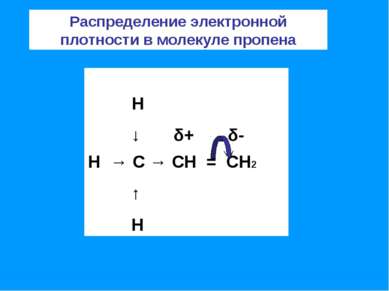
 Прогноз реакционной способности алкенов – наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения алкенов; – двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер; – двойная связь состоит из одной σ-связи, которая практически не поляризуется и одной π-связи, которая достаточно легко поляризуется.
Прогноз реакционной способности алкенов – наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их в насыщенные возможно только в результате реакций присоединения, что является основной чертой химического поведения алкенов; – двойная связь представляет собой значительную концентрацию электронной плотности, поэтому реакции присоединения носят электрофильный характер; – двойная связь состоит из одной σ-связи, которая практически не поляризуется и одной π-связи, которая достаточно легко поляризуется.
Cлайд 3
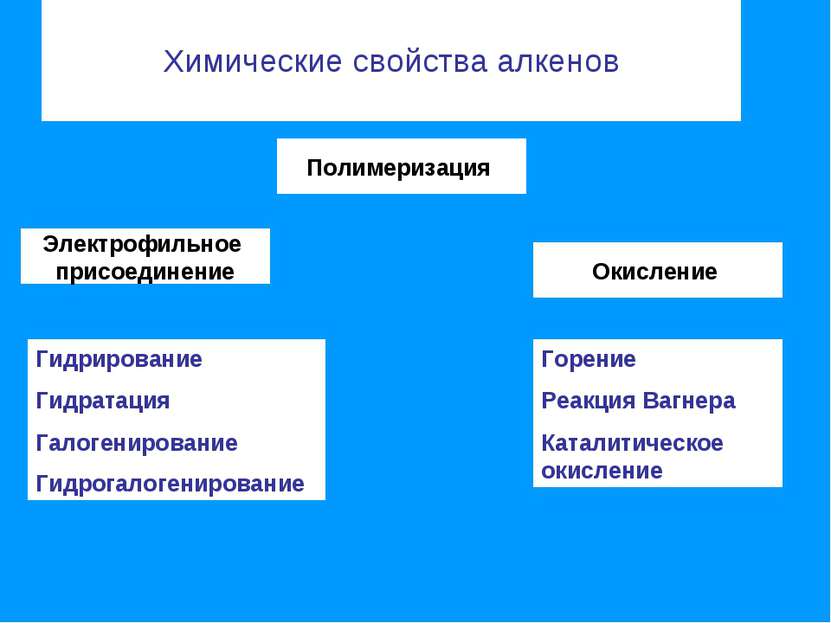
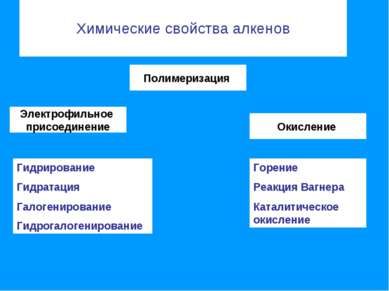 Химические свойства алкенов Электрофильное присоединение Полимеризация Окисление Гидрирование Гидратация Галогенирование Гидрогалогенирование Горение Реакция Вагнера Каталитическое окисление
Химические свойства алкенов Электрофильное присоединение Полимеризация Окисление Гидрирование Гидратация Галогенирование Гидрогалогенирование Горение Реакция Вагнера Каталитическое окисление
Cлайд 4
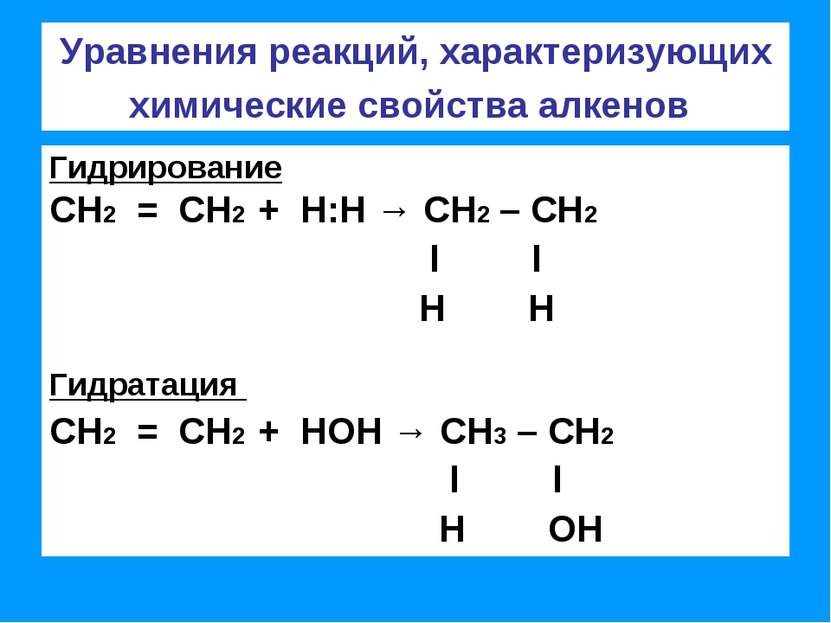
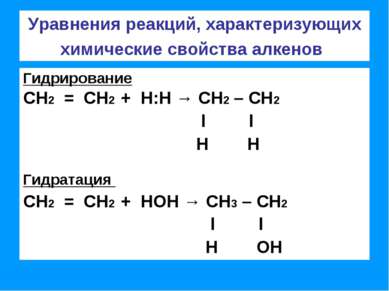 Уравнения реакций, характеризующих химические свойства алкенов Гидрирование СН2 = СН2 + Н:Н → СН2 – СН2 l l Н Н Гидратация СН2 = СН2 + НОН → СН3 – СН2 l l Н ОН
Уравнения реакций, характеризующих химические свойства алкенов Гидрирование СН2 = СН2 + Н:Н → СН2 – СН2 l l Н Н Гидратация СН2 = СН2 + НОН → СН3 – СН2 l l Н ОН
Cлайд 5
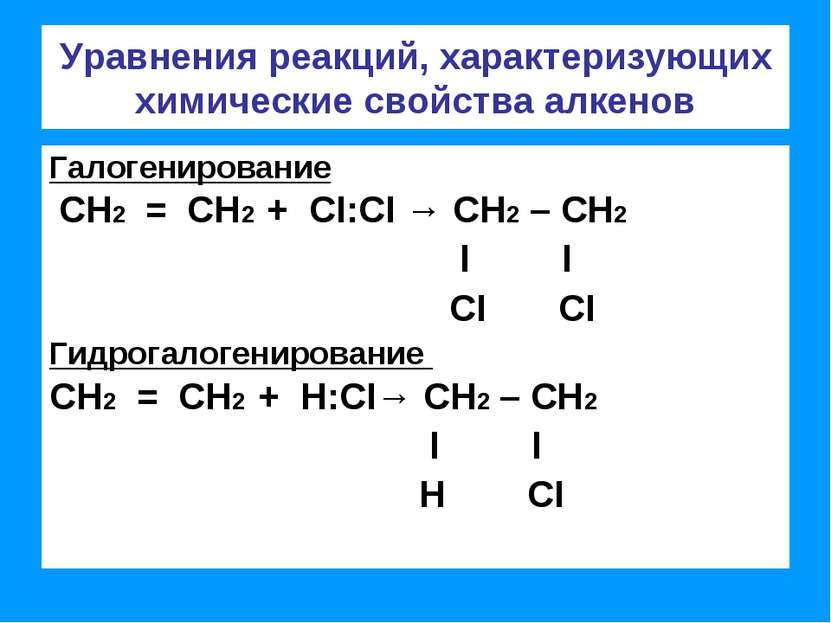
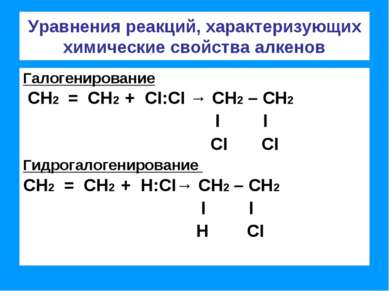 Уравнения реакций, характеризующих химические свойства алкенов Галогенирование СН2 = СН2 + CI:CI → СН2 – СН2 l l CI CI Гидрогалогенирование СН2 = СН2 + Н:CI→ СН2 – СН2 l l Н CI
Уравнения реакций, характеризующих химические свойства алкенов Галогенирование СН2 = СН2 + CI:CI → СН2 – СН2 l l CI CI Гидрогалогенирование СН2 = СН2 + Н:CI→ СН2 – СН2 l l Н CI
Cлайд 6
 Качественная реакция на непредельные углеводороды (в т.ч. алкены) СН2 = СН2 + Br2 → СН2 – СН2 l l Br Br Бромная вода, имеющая желтую окраску обесцвечивается
Качественная реакция на непредельные углеводороды (в т.ч. алкены) СН2 = СН2 + Br2 → СН2 – СН2 l l Br Br Бромная вода, имеющая желтую окраску обесцвечивается
Cлайд 7
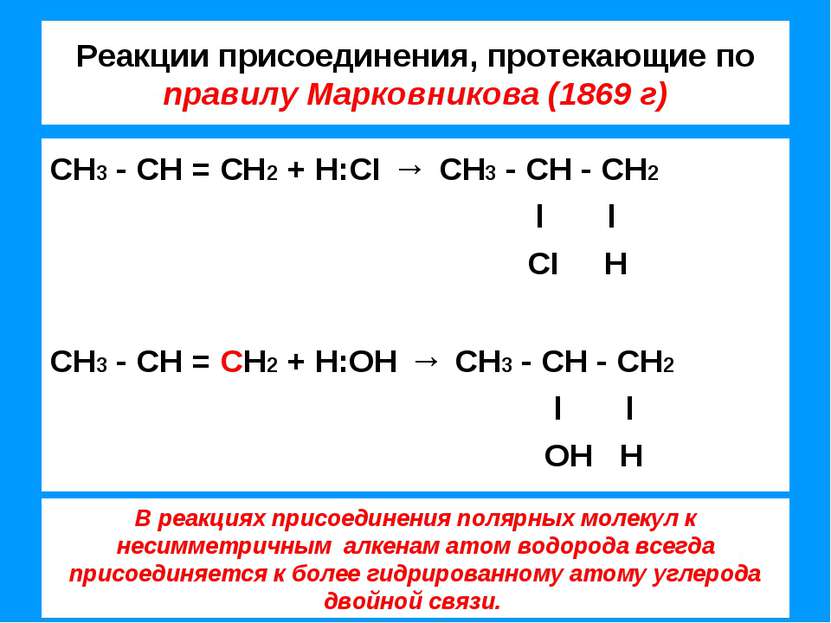
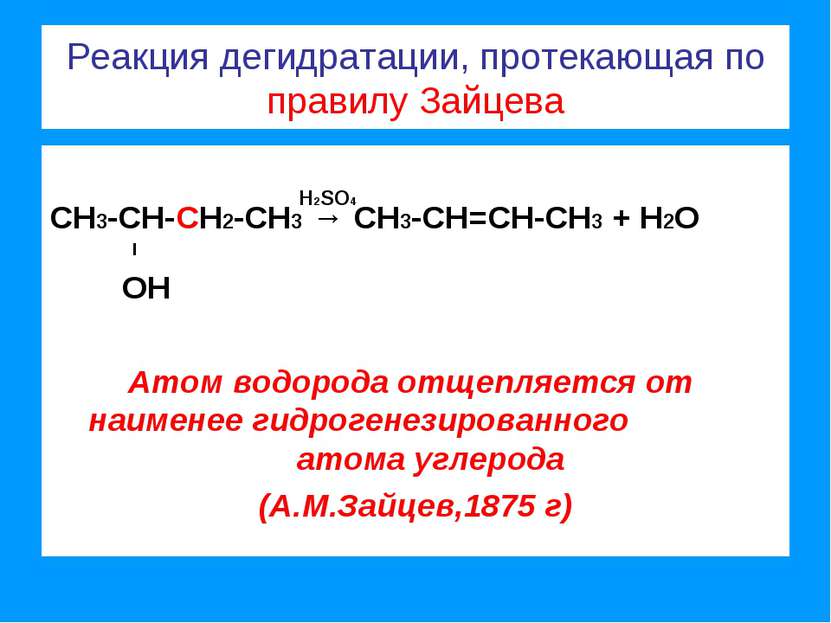
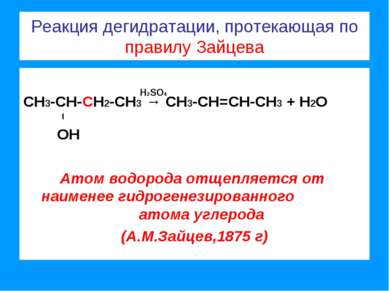
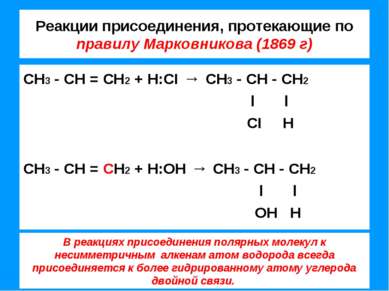 Реакции присоединения, протекающие по правилу Марковникова (1869 г) СН3 - СН = СН2 + Н:CI → СН3 - СН - СН2 l l CI Н СН3 - СН = СН2 + Н:ОН → СН3 - СН - СН2 l l ОН Н В реакциях присоединения полярных молекул к несимметричным алкенам атом водорода всегда присоединяется к более гидрированному атому углерода двойной связи.
Реакции присоединения, протекающие по правилу Марковникова (1869 г) СН3 - СН = СН2 + Н:CI → СН3 - СН - СН2 l l CI Н СН3 - СН = СН2 + Н:ОН → СН3 - СН - СН2 l l ОН Н В реакциях присоединения полярных молекул к несимметричным алкенам атом водорода всегда присоединяется к более гидрированному атому углерода двойной связи.
Cлайд 9
 Уравнения реакций, характеризующих химические свойства алкенов Окисление Реакция Вагнера 3СН2 = СН2 + 4Н2О + 2KMnO4 = = 3СН2OH - СН2OH +2MnO2 + 2KOH Качественная реакция на кратную связь – обесцвечивание водного раствора перманганата калия (открыта Е.Е.Вагнером в 1888 г)
Уравнения реакций, характеризующих химические свойства алкенов Окисление Реакция Вагнера 3СН2 = СН2 + 4Н2О + 2KMnO4 = = 3СН2OH - СН2OH +2MnO2 + 2KOH Качественная реакция на кратную связь – обесцвечивание водного раствора перманганата калия (открыта Е.Е.Вагнером в 1888 г)
Cлайд 10
 Уравнения реакций, характеризующих химические свойства алкенов Каталитическое окисление В присутствии хлоридов меди и палладия: 2СН2 = СН2 + О2 → 2 СН3 – СОН 2. В присутствии серебра, при t 150-350 С 2СН2 = СН2 + О2 → 2 СН2 – СН2 О o
Уравнения реакций, характеризующих химические свойства алкенов Каталитическое окисление В присутствии хлоридов меди и палладия: 2СН2 = СН2 + О2 → 2 СН3 – СОН 2. В присутствии серебра, при t 150-350 С 2СН2 = СН2 + О2 → 2 СН2 – СН2 О o
Cлайд 11
 Уравнения реакций, характеризующих химические свойства алкенов Реакция полимеризации n(СН2 = СН2) → (- СН2 – СН2 -)n кat,t,p этилен полиэтилен мономер структурное звено полимера
Уравнения реакций, характеризующих химические свойства алкенов Реакция полимеризации n(СН2 = СН2) → (- СН2 – СН2 -)n кat,t,p этилен полиэтилен мономер структурное звено полимера
Cлайд 12
 Получение алкенов Промышленные способы 1. Крекинг алканов С8Н18 → С4Н8 + С4Н10 2. Дегидрирование алканов СН3-СН2-СН2-СН3 → СН3-СН=СН-СН3 + Н2 t t
Получение алкенов Промышленные способы 1. Крекинг алканов С8Н18 → С4Н8 + С4Н10 2. Дегидрирование алканов СН3-СН2-СН2-СН3 → СН3-СН=СН-СН3 + Н2 t t