X
Код презентации скопируйте его
Галогены
Скачать эту презентациюПрезентация на тему Галогены
Скачать эту презентациюCлайд 1
 Сафиканов А.Ф. Выполнил: учитель химии первой квалификационной категории Сафиканов Ахат Файзрахманович МБОУ «Школа-интернат №1 среднего (полного) общего образования» городского округа город Стерлитамак Республики Башкортостан * Сафиканов А.Ф.
Сафиканов А.Ф. Выполнил: учитель химии первой квалификационной категории Сафиканов Ахат Файзрахманович МБОУ «Школа-интернат №1 среднего (полного) общего образования» городского округа город Стерлитамак Республики Башкортостан * Сафиканов А.Ф.
Cлайд 2
 Сафиканов А.Ф. 1. История открытия галогенов 2. Положение в Периодической системе 3. Химические свойства 4. Применение 5.Проверка знаний Главная Галогены 6.Домашнее задание. Итоги урока. * Сафиканов А.Ф.
Сафиканов А.Ф. 1. История открытия галогенов 2. Положение в Периодической системе 3. Химические свойства 4. Применение 5.Проверка знаний Главная Галогены 6.Домашнее задание. Итоги урока. * Сафиканов А.Ф.
Cлайд 4
 В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины. Сафиканов А.Ф. История открытия фтора Анри Муассан (1852 – 1907) * Сафиканов А.Ф.
В 1886 году французский химик А. Муассан, используя электролиз жидкого фтороводорода, охлажденного до температуры –23°C (в жидкости должно содержаться немного фторида калия, который обеспечивает ее электропроводимость), смог на аноде получить первую порцию нового, газа. В первых опытах для получения фтора Муассан использовал очень дорогой электролизер, изготовленный из платины и иридия. При этом каждый грамм полученного фтора «съедал» до 6 г платины. Сафиканов А.Ф. История открытия фтора Анри Муассан (1852 – 1907) * Сафиканов А.Ф.
Cлайд 5
 В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал "дефлогистированной соляной кислотой". В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый). В 1812 году Гей-Люсеок дал газу название хлор. Сафиканов А.Ф. История открытия хлора Карл Вильгельм Шееле (1742 – 1786) * Сафиканов А.Ф.
В 1774 году шведский ученый К. Шееле открыл хлор, который принял за сложное вещество и назвал "дефлогистированной соляной кислотой". В 1807 году английский химик Гемфри Дэви получил тот же газ. Он пришел к выводу, что получил новый элемент и назвал его "хлорин" (от "хлорос" - желто-зеленый). В 1812 году Гей-Люсеок дал газу название хлор. Сафиканов А.Ф. История открытия хлора Карл Вильгельм Шееле (1742 – 1786) * Сафиканов А.Ф.
Cлайд 6
 В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал - "мурид" (от латинского слова muria, означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный"). История открытия брома Антуан Жером Балар (1802 – 1876) Сафиканов А.Ф. * Сафиканов А.Ф.
В 1825 году французский химик А.Ж.Балар при изучении маточных рассолов выделил темно-бурую жидкость, который он назвал - "мурид" (от латинского слова muria, означающего "рассол"). Комиссия Академии, проверив это сообщение, подтвердила открытие Балара и предложила назвать элемент бромом (от "бромос", с греческого "зловонный"). История открытия брома Антуан Жером Балар (1802 – 1876) Сафиканов А.Ф. * Сафиканов А.Ф.
Cлайд 7
 В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне. В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров). Сафиканов А.Ф. История открытия йода Бернар Куртуа (1777 – 1838 ) * Сафиканов А.Ф.
В 1811 году французский химик Бернар Куртуа открыл иод путём перегонки маточных растворов от своего азотнокислого кальция с серной кислотой Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне. В 1813 году Ж.-Л.Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" - "фиолетовый" (по цвету паров). Сафиканов А.Ф. История открытия йода Бернар Куртуа (1777 – 1838 ) * Сафиканов А.Ф.
Cлайд 8
 В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат был получен искусственно в 1940 г открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли) . Для синтеза изотопа 211At они облучали висмут альфа-частицами. В 1943-1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата. Сафиканов А.Ф. История открытия астата * Сафиканов А.Ф.
В 1869 г Д.И.Мендеелеев предсказал его существование и возможность открытия в будущем (как «эка-иод»). Впервые астат был получен искусственно в 1940 г открыт Д.Корсоном, К.Маккензи и Э.Сегре (Калифорнийский университет в Беркли) . Для синтеза изотопа 211At они облучали висмут альфа-частицами. В 1943-1946 годах изотопы астата были обнаружены в составе природных радиоактивных рядов. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата. Сафиканов А.Ф. История открытия астата * Сафиканов А.Ф.
Cлайд 9
 Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 10 F фтор 9 18.9984 Br Бром 35 79.904 I Иод 53 126.904 Cl Хлор 17 35,453 At Астат 85 210 9 8 Галогены * Сафиканов А.Ф.
Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 10 F фтор 9 18.9984 Br Бром 35 79.904 I Иод 53 126.904 Cl Хлор 17 35,453 At Астат 85 210 9 8 Галогены * Сафиканов А.Ф.
Cлайд 10
 Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Фтор/Fluorum (F) Внешний вид простого вещества Бледно-жёлтый газ. Очень ядовит. Электронная коефигуранция [He] 2s2 2p5 ЭО (по Полингу) 3,98 Степень окисления −1 Плотность (при −189 °C)1,108 г/см ³ Температура плавления 53,53К Температура кипения 85,01 К Сафиканов А.Ф.
Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Фтор/Fluorum (F) Внешний вид простого вещества Бледно-жёлтый газ. Очень ядовит. Электронная коефигуранция [He] 2s2 2p5 ЭО (по Полингу) 3,98 Степень окисления −1 Плотность (при −189 °C)1,108 г/см ³ Температура плавления 53,53К Температура кипения 85,01 К Сафиканов А.Ф.
Cлайд 11
 Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Хлор / Chlorum (Cl) Внешний вид простого вещества Газ жёлто-зеленого цвета с резким запахом. Ядовит. Электронная коефигуранция [Ne] 3s2 3p5 ЭО (по Полингу) 3.16 Степень окисления 7, 6, 5, 4, 3, 1, −1 Плотность (при −33.6 °C)1,56 г/см ³ Температура плавления 172.2 К Температура кипения 238.6 К Сафиканов А.Ф.
Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Хлор / Chlorum (Cl) Внешний вид простого вещества Газ жёлто-зеленого цвета с резким запахом. Ядовит. Электронная коефигуранция [Ne] 3s2 3p5 ЭО (по Полингу) 3.16 Степень окисления 7, 6, 5, 4, 3, 1, −1 Плотность (при −33.6 °C)1,56 г/см ³ Температура плавления 172.2 К Температура кипения 238.6 К Сафиканов А.Ф.
Cлайд 12
 Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Бром / Bromum (Br) Внешний вид простого вещества красно-бурая жидкость с сильным неприятным запахом Электронная конфигуранция [Ar] 3d10 4s2 4p5 ЭО (по Полингу) 2,96 Степень окисления 7, 5, 3, 1, -1 Плотность 3,12 г/см³ Температура плавления 265,9 К Температура кипения 331,9 К Сафиканов А.Ф.
Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Бром / Bromum (Br) Внешний вид простого вещества красно-бурая жидкость с сильным неприятным запахом Электронная конфигуранция [Ar] 3d10 4s2 4p5 ЭО (по Полингу) 2,96 Степень окисления 7, 5, 3, 1, -1 Плотность 3,12 г/см³ Температура плавления 265,9 К Температура кипения 331,9 К Сафиканов А.Ф.
Cлайд 13
 Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Ио д / Iodum (I) Внешний вид простого вещества Черно-фиолетовые кристаллы с металлическим блеском Электронная конфигуранция [Kr] 4d10 5s2 5p5 ЭО (по Полингу) 2,66 Степень окисления 7, 5, 3, 1, -1 Плотность 4,93г/см³ Температура плавления 386,7 К Температура кипения 457,5 К Сафиканов А.Ф.
Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Ио д / Iodum (I) Внешний вид простого вещества Черно-фиолетовые кристаллы с металлическим блеском Электронная конфигуранция [Kr] 4d10 5s2 5p5 ЭО (по Полингу) 2,66 Степень окисления 7, 5, 3, 1, -1 Плотность 4,93г/см³ Температура плавления 386,7 К Температура кипения 457,5 К Сафиканов А.Ф.
Cлайд 14
 Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Аста т / Astatium (At) Внешний вид простого вещества Нестабильные чёрно-синие кристаллы Электронная конфигуранция [Xe] 4f14 5d10 6s2 6p5 ЭО (по Полингу) 2,2 Степень окисления 7, 5, 3, 1, −1 Плотность n/a г/см Температура плавления 517 К Температура кипения 582 К Сафиканов А.Ф.
Сафиканов А.Ф. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II I III VII VI V IV 2 1 3 4 5 6 7 9 8 10 * Аста т / Astatium (At) Внешний вид простого вещества Нестабильные чёрно-синие кристаллы Электронная конфигуранция [Xe] 4f14 5d10 6s2 6p5 ЭО (по Полингу) 2,2 Степень окисления 7, 5, 3, 1, −1 Плотность n/a г/см Температура плавления 517 К Температура кипения 582 К Сафиканов А.Ф.
Cлайд 15
 Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt. С простыми веществами: С металлами С неметаллами Na + F2 → H2 + F2 → Mo + F2 → Xe + F2 → Со сложными веществами: H2O + F2 → KCl + F2 → KBr + F2 → KI + F2 → Сафиканов А.Ф. Проверить * Сафиканов А.Ф.
Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt. С простыми веществами: С металлами С неметаллами Na + F2 → H2 + F2 → Mo + F2 → Xe + F2 → Со сложными веществами: H2O + F2 → KCl + F2 → KBr + F2 → KI + F2 → Сафиканов А.Ф. Проверить * Сафиканов А.Ф.
Cлайд 16
 Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt. С простыми веществами: С металлами С неметаллами 2Na + F2 → 2NaF H2 + F2 → 2HF Mo + 3F2 → MoF6 Xe + 2F2 → XeF4 Со сложными веществами: 2H2O + F2 → 4HF + O2 2KCl + F2 → Cl2 + 2NaF 2KBr + F2 → Br2 + 2КF 2KI + F2 → I2 + 2КF Сафиканов А.Ф. * Сафиканов А.Ф.
Химические свойства 45 F2 -наиболее реакционноспособен , реакции идут на холоду, при нагревании – даже с участием Au, Pt. С простыми веществами: С металлами С неметаллами 2Na + F2 → 2NaF H2 + F2 → 2HF Mo + 3F2 → MoF6 Xe + 2F2 → XeF4 Со сложными веществами: 2H2O + F2 → 4HF + O2 2KCl + F2 → Cl2 + 2NaF 2KBr + F2 → Br2 + 2КF 2KI + F2 → I2 + 2КF Сафиканов А.Ф. * Сафиканов А.Ф.
Cлайд 17
 Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами: С металлами С неметаллами Fe + Cl2 → H2 + Cl2 → Cu + Cl2 → P + Cl2 → Со сложными веществами: H2O + Cl2 → NaOH + Cl2 → KBr + Cl2 → KI + Cl2 → Сафиканов А.Ф. Проверить Горение железа в хлоре * Сафиканов А.Ф.
Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами: С металлами С неметаллами Fe + Cl2 → H2 + Cl2 → Cu + Cl2 → P + Cl2 → Со сложными веществами: H2O + Cl2 → NaOH + Cl2 → KBr + Cl2 → KI + Cl2 → Сафиканов А.Ф. Проверить Горение железа в хлоре * Сафиканов А.Ф.
Cлайд 18
 Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами: С металлами С неметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 → 2HCl (tº, hυ) Cu + Cl2 → Cu Cl2 2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2) Со сложными веществами: H2O + Cl2 → HCl+HClO хлорная вода 2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода 2KBr + Cl2 → Br2 + 2КCl 2KI + Cl2 → I2 + 2КCl Сафиканов А.Ф. *
Химические свойства Cl2 - сильно реакционноспособен (искл. C, O2, N2 и некот. др.) С простыми веществами: С металлами С неметаллами 2Fe + 3Cl2 → 2FeCl3 H2 + Cl2 → 2HCl (tº, hυ) Cu + Cl2 → Cu Cl2 2P + 5Cl2 → 2PCl5 ( tº, в изб. Сl2) Со сложными веществами: H2O + Cl2 → HCl+HClO хлорная вода 2NaOH + Cl2 → NaOCl + NaCl + H2O жавелевая вода 2KBr + Cl2 → Br2 + 2КCl 2KI + Cl2 → I2 + 2КCl Сафиканов А.Ф. *
Cлайд 19
 Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами Al + Br2 → H2 + Br2 → Cu + Br2 → P + Br2 → Со сложными веществами: Br2 + H2O → KI + Br2 → Сафиканов А.Ф. Проверить * Сафиканов А.Ф.
Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами Al + Br2 → H2 + Br2 → Cu + Br2 → P + Br2 → Со сложными веществами: Br2 + H2O → KI + Br2 → Сафиканов А.Ф. Проверить * Сафиканов А.Ф.
Cлайд 20
 Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами 2Al + 3Br2 → 2AlBr3 H2 + Br2 → 2HCl Cu + Br2 → Cu Br2 2P + 5Br2 → 2PBr5 Со сложными веществами: Br2 + H2O → HBr + HBrO бромная вода 2KI + Br2 → I2 + 2КCl Сафиканов А.Ф. * Сафиканов А.Ф.
Химические свойства Br2 - реакционноспособен С простыми веществами: С металлами С неметаллами 2Al + 3Br2 → 2AlBr3 H2 + Br2 → 2HCl Cu + Br2 → Cu Br2 2P + 5Br2 → 2PBr5 Со сложными веществами: Br2 + H2O → HBr + HBrO бромная вода 2KI + Br2 → I2 + 2КCl Сафиканов А.Ф. * Сафиканов А.Ф.
Cлайд 21
 Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg + I2 → H2 + I2 → Al + I2 → P + Br2 → Со сложными веществами: I2 + H2O → I2 + р-р крахмала → Сафиканов А.Ф. Проверить Действие крахмала на йод * Сафиканов А.Ф.
Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg + I2 → H2 + I2 → Al + I2 → P + Br2 → Со сложными веществами: I2 + H2O → I2 + р-р крахмала → Сафиканов А.Ф. Проверить Действие крахмала на йод * Сафиканов А.Ф.
Cлайд 22
 Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg + I2 → HgI2 H2 + I2 → 2HCl (tº) 2Al + 3I2 → 2AlI3 2P + 3Br2 → 2PI3 Со сложными веществами: I2 + H2O → HI + HIO I2 + р-р крахмала → темно-синее окрашивание Сафиканов А.Ф. *
Химические свойства I2 - химически наименее активен С простыми веществами: С металлами С неметаллами Hg + I2 → HgI2 H2 + I2 → 2HCl (tº) 2Al + 3I2 → 2AlI3 2P + 3Br2 → 2PI3 Со сложными веществами: I2 + H2O → HI + HIO I2 + р-р крахмала → темно-синее окрашивание Сафиканов А.Ф. *
Cлайд 23
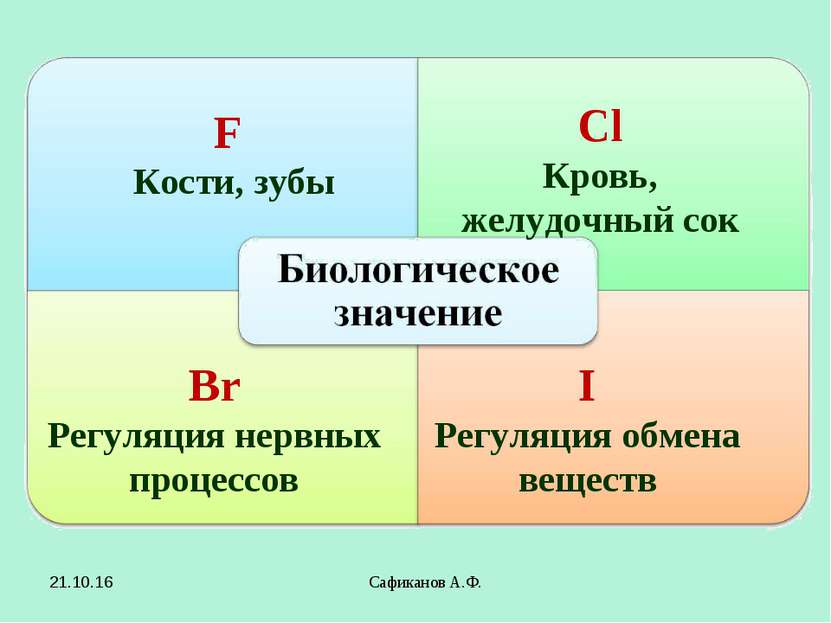
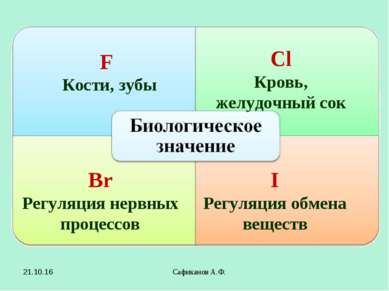 Сафиканов А.Ф. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ * Сафиканов А.Ф.
Сафиканов А.Ф. F Кости, зубы Сl Кровь, желудочный сок Br Регуляция нервных процессов I Регуляция обмена веществ * Сафиканов А.Ф.
Cлайд 24
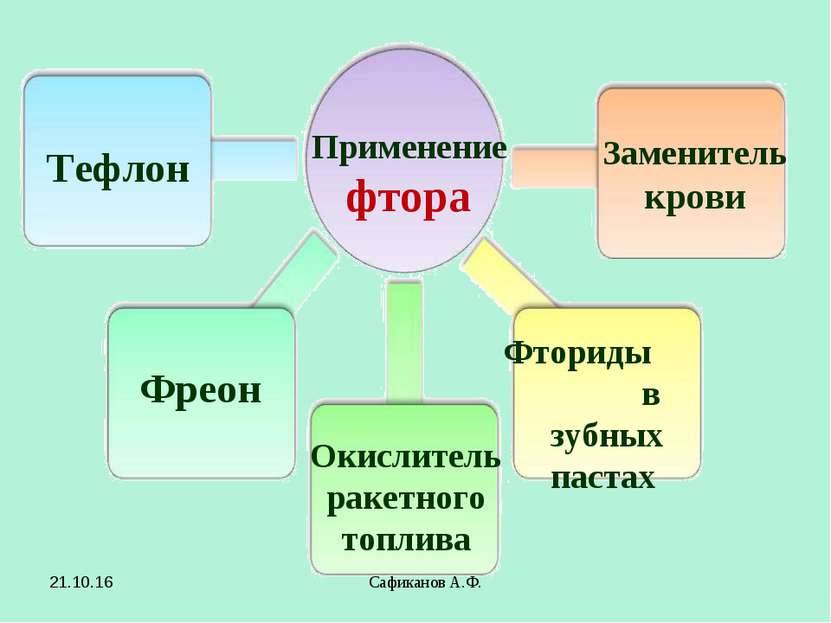
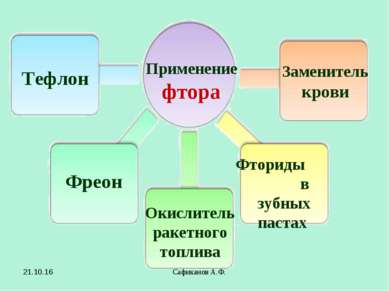 Сафиканов А.Ф. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах * Сафиканов А.Ф.
Сафиканов А.Ф. Применение фтора Тефлон Фреон Окислитель ракетного топлива Заменитель крови Фториды в зубных пастах * Сафиканов А.Ф.
Cлайд 25
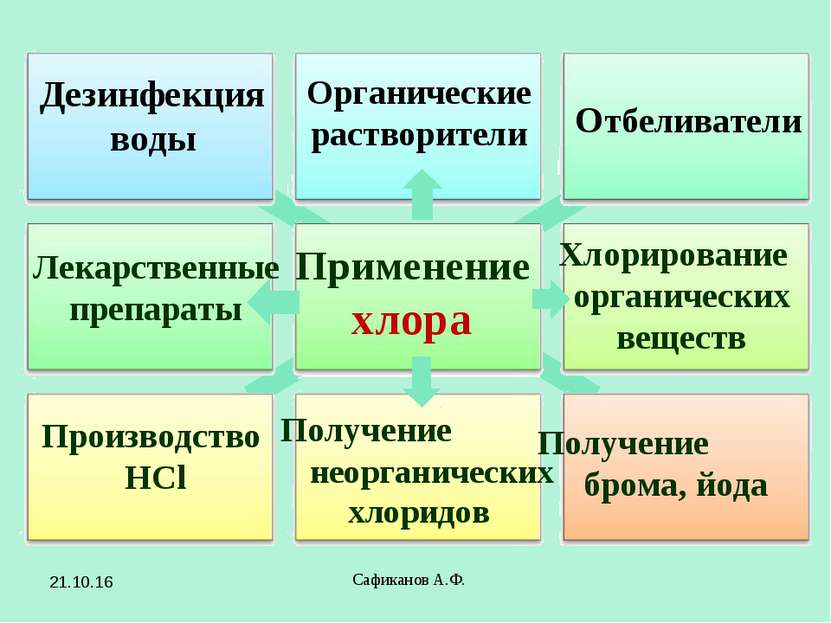
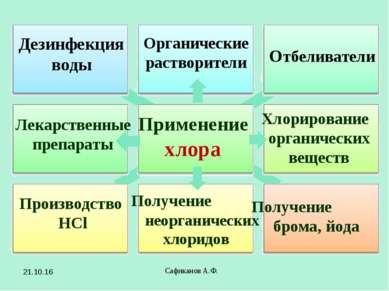 Сафиканов А.Ф. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических веществ Получение неорганических хлоридов * Сафиканов А.Ф.
Сафиканов А.Ф. Применение хлора Отбеливатели Производство HCl Получение брома, йода Дезинфекция воды Органические растворители Лекарственные препараты Хлорирование органических веществ Получение неорганических хлоридов * Сафиканов А.Ф.
Cлайд 26
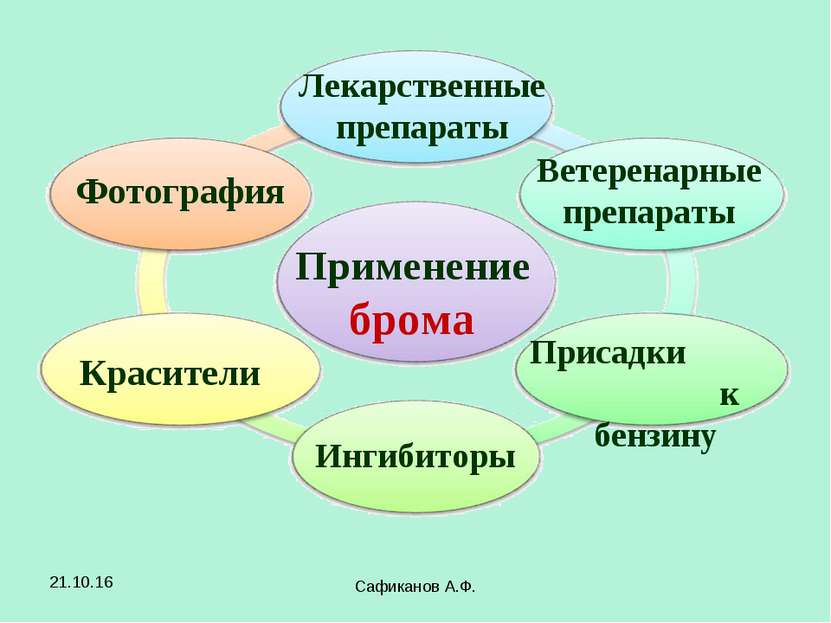
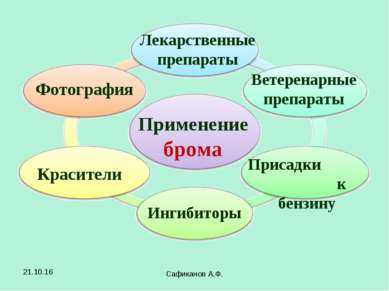 Сафиканов А.Ф. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину * Сафиканов А.Ф.
Сафиканов А.Ф. Применение брома Лекарственные препараты Красители Фотография Ветеренарные препараты Ингибиторы Присадки к бензину * Сафиканов А.Ф.
Cлайд 27
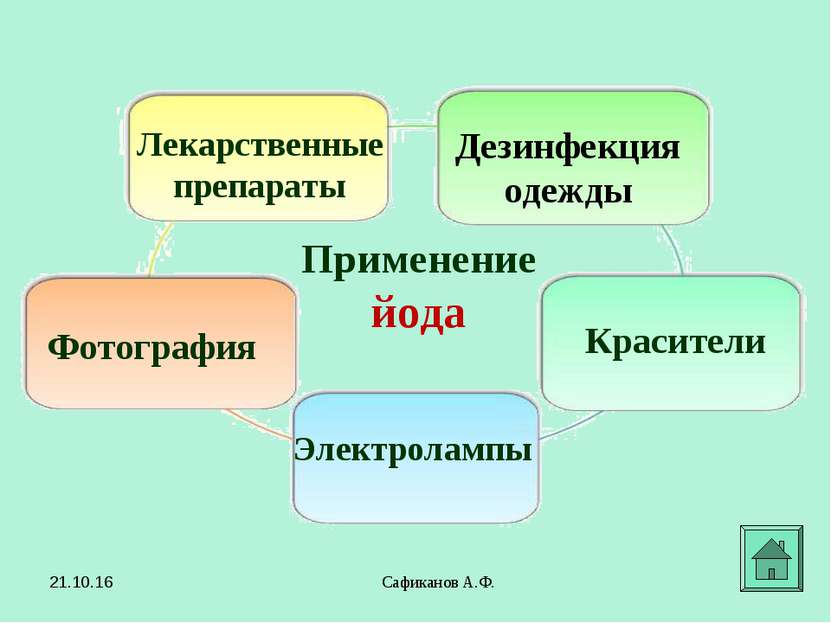
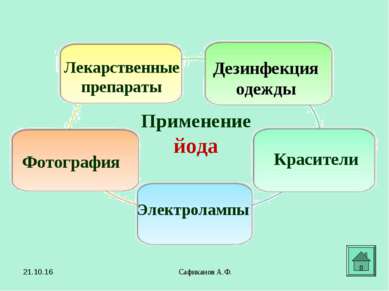 Сафиканов А.Ф. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы * Сафиканов А.Ф.
Сафиканов А.Ф. Применение йода Лекарственные препараты Фотография Красители Дезинфекция одежды Электролампы * Сафиканов А.Ф.
Cлайд 28
 Физические свойства галогенов Заполни пропуски Фтор - , в воде , так как интенсивно с ней взаимодействует. Хлор - , раствор хлора в воде практически бесцветен - . Бром - . Йод - с с металлическим блеском. Кристаллический йод легко - переходит из твердого в газообразное состояние. Астат похож на , но имеет более ярко выраженный металлический характер. Все галогены обладают запахом, вдыхание их вызывает сильнейшее раздражение дыхательных путей и тяжелые . Сафиканов А.Ф. черно-фиолетовые кристаллы не растворим светло-желтый газ хлорная вода желто-зеленый газ бурая жидкость йод резким отравления * Сафиканов А.Ф.
Физические свойства галогенов Заполни пропуски Фтор - , в воде , так как интенсивно с ней взаимодействует. Хлор - , раствор хлора в воде практически бесцветен - . Бром - . Йод - с с металлическим блеском. Кристаллический йод легко - переходит из твердого в газообразное состояние. Астат похож на , но имеет более ярко выраженный металлический характер. Все галогены обладают запахом, вдыхание их вызывает сильнейшее раздражение дыхательных путей и тяжелые . Сафиканов А.Ф. черно-фиолетовые кристаллы не растворим светло-желтый газ хлорная вода желто-зеленый газ бурая жидкость йод резким отравления * Сафиканов А.Ф.
Cлайд 29
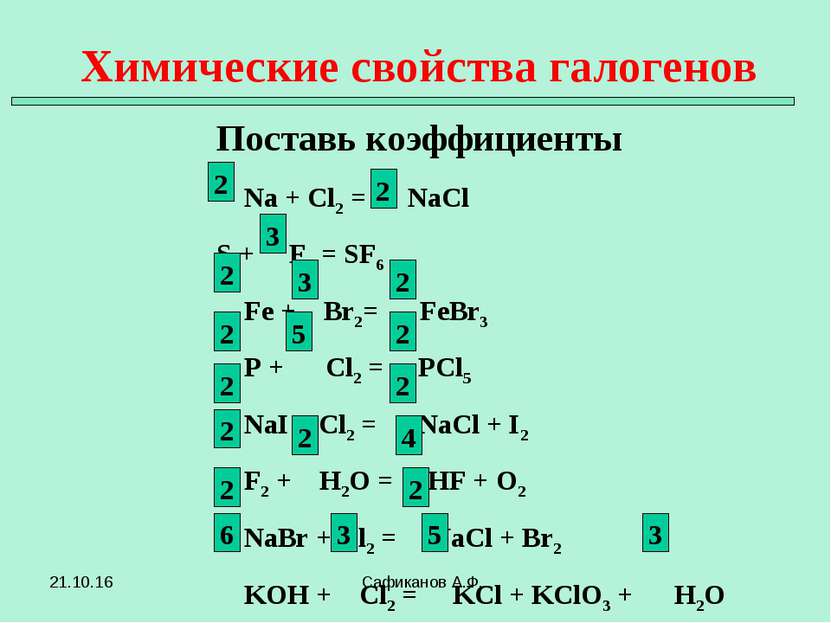
 Химические свойства галогенов Поставь коэффициенты Сафиканов А.Ф. Na + Cl2 = NaCl S + F2 = SF6 Fe + Br2= FeBr3 P + Cl2 = PCl5 NaI + Cl2 = NaCl + I2 F2 + H2O = HF + O2 NaBr + Cl2 = NaCl + Br2 KOH + Cl2 = KCl + KClO3 + H2O 2 2 2 4 2 3 5 3 2 2 2 2 2 2 3 2 3 5 2 6 * Сафиканов А.Ф.
Химические свойства галогенов Поставь коэффициенты Сафиканов А.Ф. Na + Cl2 = NaCl S + F2 = SF6 Fe + Br2= FeBr3 P + Cl2 = PCl5 NaI + Cl2 = NaCl + I2 F2 + H2O = HF + O2 NaBr + Cl2 = NaCl + Br2 KOH + Cl2 = KCl + KClO3 + H2O 2 2 2 4 2 3 5 3 2 2 2 2 2 2 3 2 3 5 2 6 * Сафиканов А.Ф.
Cлайд 30
 Химические свойства галогенов Найди соответствие между исходными веществами и продуктами реакций Сафиканов А.Ф. Xe + 2F2 = H2 + F2 = 2Au + 3Cl2 = 2NaCl + 2H2 O = 2NaI + Cl2 = 2H2 O + 2F2 = 2NaOH + H2 +Cl2 2NaCl + I2 XeF4 4 HF + O2 2HF 2AuCl3 * Сафиканов А.Ф.
Химические свойства галогенов Найди соответствие между исходными веществами и продуктами реакций Сафиканов А.Ф. Xe + 2F2 = H2 + F2 = 2Au + 3Cl2 = 2NaCl + 2H2 O = 2NaI + Cl2 = 2H2 O + 2F2 = 2NaOH + H2 +Cl2 2NaCl + I2 XeF4 4 HF + O2 2HF 2AuCl3 * Сафиканов А.Ф.
Cлайд 31
 Сафиканов А.Ф. § 17, упр.5, 8 стр 63. Дополнительно: ссылка на сайт учителя химии Сафиканова А.Ф. http://int-46.ucoz.ru/load/13-1-0-155 , где размещен комплект интерактивных заданий на закрепление и проверку знаний по теме «Галогены» в программе Hot Potatoes. Домашнее задание * Сафиканов А.Ф.
Сафиканов А.Ф. § 17, упр.5, 8 стр 63. Дополнительно: ссылка на сайт учителя химии Сафиканова А.Ф. http://int-46.ucoz.ru/load/13-1-0-155 , где размещен комплект интерактивных заданий на закрепление и проверку знаний по теме «Галогены» в программе Hot Potatoes. Домашнее задание * Сафиканов А.Ф.
Cлайд 33
 Сафиканов А.Ф. «Химия-9», О.С.Габриелян, М, Дрофа,2005г, стр 78-90 «Химия в действии», М.Фримантл, М, «Мир»,1991г, стр 269-286. «Неорганическая химия в таблицах»,Н.В.Манцевич, Минск, Современная школа,2008г, стр 275-280 http://www.chem100.ru/ http://rrc.dgu.ru/res/n-t.ru/ri/ps/index.htm http://www.periodictable.ru/ http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=35 http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=23 http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=72 http://ru.wikipedia.org/wiki/%D0%A4%D1%80%D1%8D%D0%B4_%D0%90%D0%BB%D0%BB%D0%B8%D1%81%D0%BE%D0%BD Использованная литература, интернет-ресурсы * Сафиканов А.Ф.
Сафиканов А.Ф. «Химия-9», О.С.Габриелян, М, Дрофа,2005г, стр 78-90 «Химия в действии», М.Фримантл, М, «Мир»,1991г, стр 269-286. «Неорганическая химия в таблицах»,Н.В.Манцевич, Минск, Современная школа,2008г, стр 275-280 http://www.chem100.ru/ http://rrc.dgu.ru/res/n-t.ru/ri/ps/index.htm http://www.periodictable.ru/ http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=35 http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=23 http://sevchem.info/?go=galeri&act=show_photo&idr=17&id_f=72 http://ru.wikipedia.org/wiki/%D0%A4%D1%80%D1%8D%D0%B4_%D0%90%D0%BB%D0%BB%D0%B8%D1%81%D0%BE%D0%BD Использованная литература, интернет-ресурсы * Сафиканов А.Ф.