X
Код презентации скопируйте его
Процессы в растворах электролитическая диссоциация
Скачать эту презентациюПрезентация на тему Процессы в растворах электролитическая диссоциация
Скачать эту презентациюCлайд 1
 Процессы в растворах: электролитическая диссоциация (ЭД) Презентация подготовлена учителем биологии и химии МОУ СОШ д.Городище Немского района Кировской области Кассихиной Татьяной Александровной
Процессы в растворах: электролитическая диссоциация (ЭД) Презентация подготовлена учителем биологии и химии МОУ СОШ д.Городище Немского района Кировской области Кассихиной Татьяной Александровной
Cлайд 2
 Вещества Электролиты - вещества, растворы и расплавы которых не проводят электрический ток. Неэлектролиты - вещества, растворы и расплавы которых не проводят электрический ток.
Вещества Электролиты - вещества, растворы и расплавы которых не проводят электрический ток. Неэлектролиты - вещества, растворы и расплавы которых не проводят электрический ток.
Cлайд 3
 Неэлектролиты вещества, которые содержат ковалентные неполярные или малополярные связи. Эти связи не распадаются на ионы. газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Неэлектролиты вещества, которые содержат ковалентные неполярные или малополярные связи. Эти связи не распадаются на ионы. газы, твердые вещества (неметаллы), органические соединения (сахароза, бензин, спирт).
Cлайд 4
 Электролиты Вещества, которые содержат ионные и ковалентные полярные связи. Эти связи легко распадаются на ионы. Неорганические кислоты, основания, соли.
Электролиты Вещества, которые содержат ионные и ковалентные полярные связи. Эти связи легко распадаются на ионы. Неорганические кислоты, основания, соли.
Cлайд 5
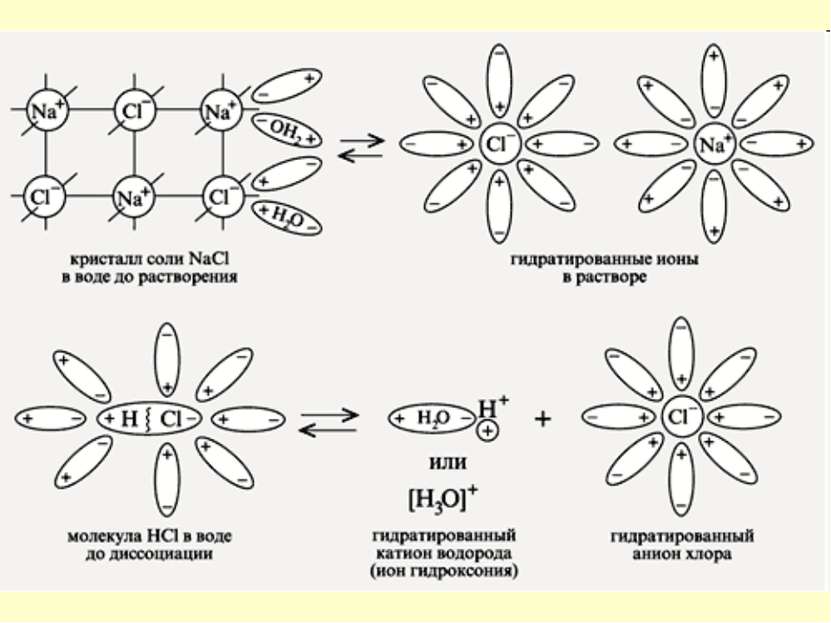
 Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении
Cлайд 7
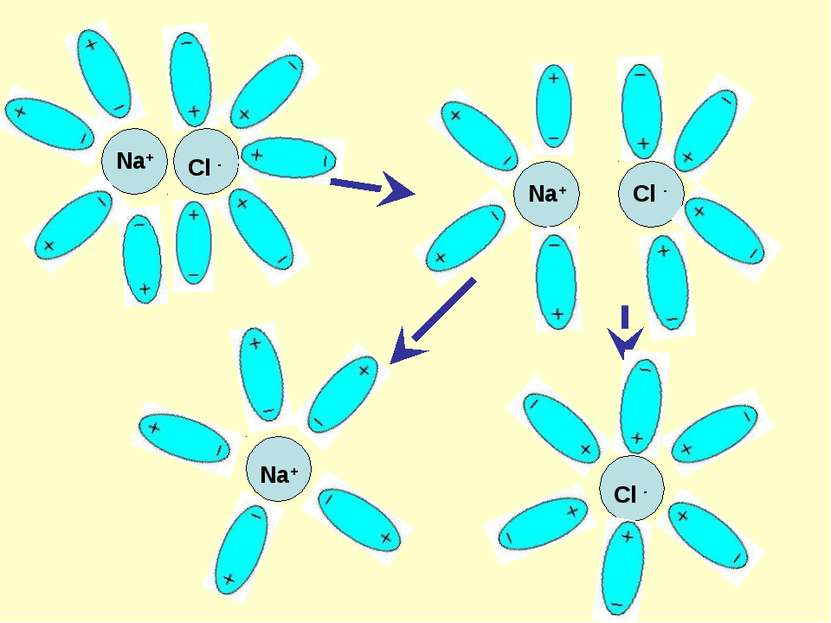
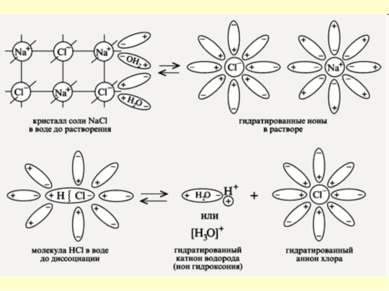
 Механизм ЭД ионных веществ Ориентация диполей воды вокруг кристаллов соли. Образование между молекулами воды и ионами кристаллов слабых связей. Разрушение кристаллической решетки и образование гидратированных ионов.
Механизм ЭД ионных веществ Ориентация диполей воды вокруг кристаллов соли. Образование между молекулами воды и ионами кристаллов слабых связей. Разрушение кристаллической решетки и образование гидратированных ионов.
Cлайд 9
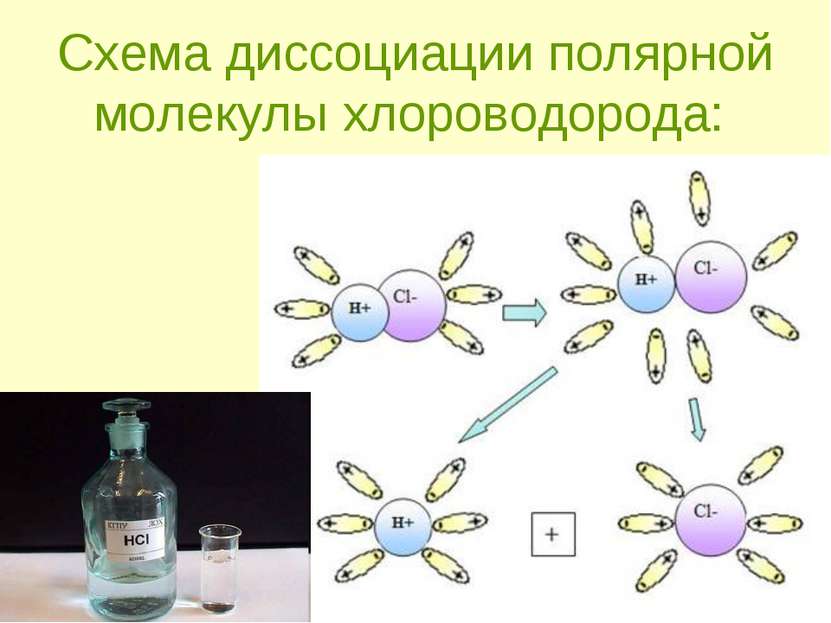
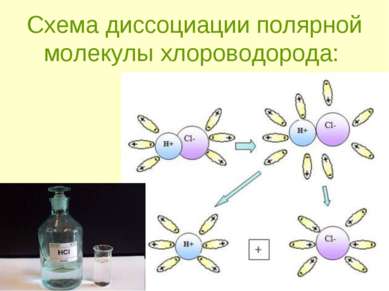
 Механизм ЭД полярных веществ ориентация диполей воды вокруг полярной молекулы. еще большая поляризация полярной молекулы и превращение полярной связи ее в ионную. образование свободных гидратирован-ных ионов.
Механизм ЭД полярных веществ ориентация диполей воды вокруг полярной молекулы. еще большая поляризация полярной молекулы и превращение полярной связи ее в ионную. образование свободных гидратирован-ных ионов.
Cлайд 11
 Электролиты Сильные - при растворении в воде практически полностью распадаются на ионы. Слабые частично распадаются на ионы. Их растворы содержат ионы и нераспавшиеся молекулы, поэтому концентрация ионов мала.
Электролиты Сильные - при растворении в воде практически полностью распадаются на ионы. Слабые частично распадаются на ионы. Их растворы содержат ионы и нераспавшиеся молекулы, поэтому концентрация ионов мала.
Cлайд 12
 Сильные электролиты вещества с ионными или сильно полярными связями. все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания: LiOH, NaOH, KOH, RbOH, CsOH, Вa(OH)2, Sr(OH)2, Сa(OH)2.
Сильные электролиты вещества с ионными или сильно полярными связями. все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4,HNO3) и сильные основания: LiOH, NaOH, KOH, RbOH, CsOH, Вa(OH)2, Sr(OH)2, Сa(OH)2.
Cлайд 13
 Слабые электролиты вещества с неполярными и малополярными связями: 1) почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2) некоторые неорганические кислоты (H2CO3, H2S и др.); 3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Ca(OH)2; Al(OH)3; NH4OH);
Слабые электролиты вещества с неполярными и малополярными связями: 1) почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2) некоторые неорганические кислоты (H2CO3, H2S и др.); 3) почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Ca(OH)2; Al(OH)3; NH4OH);
Cлайд 14
 Степень диссоциации Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
Степень диссоциации Степень диссоциации (α) - отношение числа распавшихся на ионы молекул (n) к общему числу растворенных молекул (N):
Cлайд 15
 Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов. CaCl2 = Ca2+ + 2Cl- KAl(SO4)2 = K+ + Al3+ + 2SO42- HNO3 = H+ + NO3- Ba(OH)2 = Ba2+ + 2OH-
Электролитическая диссоциация веществ, идущая с образованием свободных ионов объясняет электрическую проводимость растворов. CaCl2 = Ca2+ + 2Cl- KAl(SO4)2 = K+ + Al3+ + 2SO42- HNO3 = H+ + NO3- Ba(OH)2 = Ba2+ + 2OH-
Cлайд 16
 Диссоциация кислот осуществляется ступенчато. На каждой ступени отщепляется один ион водорода. H Cl = H+ + Cl - - H2SO4 = H+ + HSO4- (I ступень) HSO4- = H+ + SO42- (II ступень) Кислоты - при диссоциации образуют катионы водорода и анионы кислотного остатка.
Диссоциация кислот осуществляется ступенчато. На каждой ступени отщепляется один ион водорода. H Cl = H+ + Cl - - H2SO4 = H+ + HSO4- (I ступень) HSO4- = H+ + SO42- (II ступень) Кислоты - при диссоциации образуют катионы водорода и анионы кислотного остатка.
Cлайд 17
 Диссоциация оснований Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2 = Сa2+ + 2OH- Основания - при диссоциации образуют катионы металла и анионы - гидроксид-ионы.
Диссоциация оснований Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2 = Сa2+ + 2OH- Основания - при диссоциации образуют катионы металла и анионы - гидроксид-ионы.
Cлайд 18
 Диссоциация солей Средние соли – соли, состоящие из атомов металла и кислотного остатка, диссоциируют в одну ступень: CaCl2 = Ca2+ + 2Cl- KBr = K+ + Br- NaCl = Na+ + Cl-
Диссоциация солей Средние соли – соли, состоящие из атомов металла и кислотного остатка, диссоциируют в одну ступень: CaCl2 = Ca2+ + 2Cl- KBr = K+ + Br- NaCl = Na+ + Cl-
Cлайд 19
 Диссоциация солей Кислые соли – соли, в состав молекул которых кроме атомов металла входят атомы водорода, распадаются ступенчато. Сначала отрываются все атомы металла, а затем атомы водорода по- одному. KHCO3 = K+ + HCO3− HCO3− = H+ + CO32-
Диссоциация солей Кислые соли – соли, в состав молекул которых кроме атомов металла входят атомы водорода, распадаются ступенчато. Сначала отрываются все атомы металла, а затем атомы водорода по- одному. KHCO3 = K+ + HCO3− HCO3− = H+ + CO32-
Cлайд 20
 Шведский ученый Сванте Аррениус(1859-1927) В 1887 году создал теорию ЭД. В 1903году был удостоен Нобелевской премии "За чрезвычайные заслуги в развитии химии".
Шведский ученый Сванте Аррениус(1859-1927) В 1887 году создал теорию ЭД. В 1903году был удостоен Нобелевской премии "За чрезвычайные заслуги в развитии химии".
Cлайд 22
 Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы.
Русские химики И.А.Каблуков и В.А.Кистяковский применили к объяснению электролитической диссоциации химическую теорию растворов Д.И.Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы.
Cлайд 23
 Основные положения теории ЭД 1. Электролиты в водной среде (и в расплавленном состоянии) распадаются на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Основные положения теории ЭД 1. Электролиты в водной среде (и в расплавленном состоянии) распадаются на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Cлайд 25
 Основные положения теории ЭД 2. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду.
Основные положения теории ЭД 2. Беспорядочное движение ионов в растворе под действием электрического поля становится направленным: положительно заряженные ионы (катионы) движутся к электроду с отрицательным зарядом (катоду), а анионы – к аноду.
Cлайд 26
 Основные положения теории ЭД 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. NaCl Na+ + Cl-
Основные положения теории ЭД 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости. NaCl Na+ + Cl-
Cлайд 27
 4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N). Основные положения теории ЭД
4. Степень электролитической диссоциации (a) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N). Основные положения теории ЭД
Cлайд 28
 Основные положения теории ЭД 5. Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированы.
Основные положения теории ЭД 5. Свойства ионов резко отличаются от свойств нейтральных атомов составляющих их элементов. Ионы в водных растворах гидратированы.
Cлайд 29
 Источники информации: http://slovari.yandex.ru/ http://www.lyceum8.ru/himiya/4.htm http://900igr.net/fotografii/khimija/Dissotsiatsija/010-Mekhanizm-dissotsiatsii-veschestv.html http://him.1september.ru/2003/34/7.htm http://900igr.net/kartinki/khimija/Povarennaja-sol/059-K-r-i-s-t-a-l-l-y-g-a-l-i-t-a.html
Источники информации: http://slovari.yandex.ru/ http://www.lyceum8.ru/himiya/4.htm http://900igr.net/fotografii/khimija/Dissotsiatsija/010-Mekhanizm-dissotsiatsii-veschestv.html http://him.1september.ru/2003/34/7.htm http://900igr.net/kartinki/khimija/Povarennaja-sol/059-K-r-i-s-t-a-l-l-y-g-a-l-i-t-a.html