X
Код презентации скопируйте его
Соединения хрома в заданиях ЕГЭ уровня С
Скачать эту презентациюПрезентация на тему Соединения хрома в заданиях ЕГЭ уровня С
Скачать эту презентациюCлайд 1
 Соединения хрома в заданиях ЕГЭ уровня «С» Цель занятия: углубление и систематизация знаний по данной теме для подготовки к ЕГЭ
Соединения хрома в заданиях ЕГЭ уровня «С» Цель занятия: углубление и систематизация знаний по данной теме для подготовки к ЕГЭ
Cлайд 2
 «Мыслящий ум не чувствует себя счастливым, пока не удастся связать воедино разрозненные факты, им наблюдаемые» Д. Хевеши
«Мыслящий ум не чувствует себя счастливым, пока не удастся связать воедино разрозненные факты, им наблюдаемые» Д. Хевеши
Cлайд 4
 Зависимость свойств соединений хрома от степени окисления. Заполните таблицу. Степень окисления +2 +3 +6 Оксид СrО Сr2О3 СrО3 Характер оксида Гидроксид Характер гидроксида Изменениесвойств соединений
Зависимость свойств соединений хрома от степени окисления. Заполните таблицу. Степень окисления +2 +3 +6 Оксид СrО Сr2О3 СrО3 Характер оксида Гидроксид Характер гидроксида Изменениесвойств соединений
Cлайд 5
 Зависимость свойств соединений хрома от степени окисления. Степень окисления +2 +3 +6 Оксид СrО Сr2О3 СrО3 Характер оксида основной амфотерный кислотный Гидроксид Сr(ОН)2 Сr(ОН)3– Н3СrО3 Н2СrО4 Н2Сr2О7 Характер гидроксида основной амфотерный кислотный → ослабление основных свойств и усиление кислотных→
Зависимость свойств соединений хрома от степени окисления. Степень окисления +2 +3 +6 Оксид СrО Сr2О3 СrО3 Характер оксида основной амфотерный кислотный Гидроксид Сr(ОН)2 Сr(ОН)3– Н3СrО3 Н2СrО4 Н2Сr2О7 Характер гидроксида основной амфотерный кислотный → ослабление основных свойств и усиление кислотных→
Cлайд 6
 Дихромат и хромат - окислители K2Cr2O7 (кислая и нейтральная среда), K2Cr O 4 (щелочная среда) + восстановители всегда получается …..? кислая среда нейтральная среда щелочная среда ? в растворе …?. ? в расплаве …?.
Дихромат и хромат - окислители K2Cr2O7 (кислая и нейтральная среда), K2Cr O 4 (щелочная среда) + восстановители всегда получается …..? кислая среда нейтральная среда щелочная среда ? в растворе …?. ? в расплаве …?.
Cлайд 7
 K2Cr2O7 (кислая и нейтральная среда), K2Cr O 4 (щелочная среда) + восстановители всегда получается Cr+3 кислая среда нейтральная среда щелочная среда Соли тех кислот, которые участвуют в в растворе реакции: в расплаве Дихромат и хромат - окислители
K2Cr2O7 (кислая и нейтральная среда), K2Cr O 4 (щелочная среда) + восстановители всегда получается Cr+3 кислая среда нейтральная среда щелочная среда Соли тех кислот, которые участвуют в в растворе реакции: в расплаве Дихромат и хромат - окислители
Cлайд 8
 Изменение степени окисления Cr+3 . Cr+3 + очень сильные окислители ( всегда независимо от среды!) образуются соединения ? + очень сильные окислители: KNO3. ( в щелочном растворе),кислородсодержащие соли хлора (в щелочном расплаве) Щелочная среда: Образуется ? Cr(OH)3, соли + очень сильные окислители: в кислой среде ( HNO3) Кислая среда: Образуется ? Cr2O3Сr(OH)3 соли, гидроксокомп лексы
Изменение степени окисления Cr+3 . Cr+3 + очень сильные окислители ( всегда независимо от среды!) образуются соединения ? + очень сильные окислители: KNO3. ( в щелочном растворе),кислородсодержащие соли хлора (в щелочном расплаве) Щелочная среда: Образуется ? Cr(OH)3, соли + очень сильные окислители: в кислой среде ( HNO3) Кислая среда: Образуется ? Cr2O3Сr(OH)3 соли, гидроксокомп лексы
Cлайд 9
 Cr+3 + очень сильные окислители Cr+6 ( всегда независимо от среды!) + очень сильные окислители: KNO3. ( в щелочном растворе),кислородсодержащие соли хлора (в щелочном расплаве) Щелочная среда: Образуется хромат K2CrO4 Cr(OH)3, соли + очень сильные окислители: в кислой среде ( HNO3) Кислая среда: Образуется дихромат K2Cr2O 7 Изменение степени окисления Cr+3 Cr2O3Сr(OH)3 соли, гидроксокомп лексы
Cr+3 + очень сильные окислители Cr+6 ( всегда независимо от среды!) + очень сильные окислители: KNO3. ( в щелочном растворе),кислородсодержащие соли хлора (в щелочном расплаве) Щелочная среда: Образуется хромат K2CrO4 Cr(OH)3, соли + очень сильные окислители: в кислой среде ( HNO3) Кислая среда: Образуется дихромат K2Cr2O 7 Изменение степени окисления Cr+3 Cr2O3Сr(OH)3 соли, гидроксокомп лексы
Cлайд 10
 Дихроматы получаются при действии на хроматы ….? Na2CrO4 + ?= Na2Cr2O7 + ?+ ? Возможен и обратный переход при добавлении …. ? к растворам дихроматов Na2Cr2O7 + …? = Na2CrO4 + ? Превращение солей хрома
Дихроматы получаются при действии на хроматы ….? Na2CrO4 + ?= Na2Cr2O7 + ?+ ? Возможен и обратный переход при добавлении …. ? к растворам дихроматов Na2Cr2O7 + …? = Na2CrO4 + ? Превращение солей хрома
Cлайд 11
 Превращение солей хрома Дихроматы получаются при действии на хроматы кислот 2 Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + Н2О Возможен и обратный переход при добавлении щелочей к растворам дихроматов Na2Cr2O7 + 2NaOH = 2Na2CrO4 + Н2О Равновесие в системе хромат-дихромат можно представить следующими уравнениями: 2СrО42- + 2Н+ = Сr2О72- + Н2О Сr2О72- + 2ОН- = 2 CrO 42- + Н2О
Превращение солей хрома Дихроматы получаются при действии на хроматы кислот 2 Na2CrO4 + H2SO4 = Na2Cr2O7 + Na2SO4 + Н2О Возможен и обратный переход при добавлении щелочей к растворам дихроматов Na2Cr2O7 + 2NaOH = 2Na2CrO4 + Н2О Равновесие в системе хромат-дихромат можно представить следующими уравнениями: 2СrО42- + 2Н+ = Сr2О72- + Н2О Сr2О72- + 2ОН- = 2 CrO 42- + Н2О
Cлайд 13
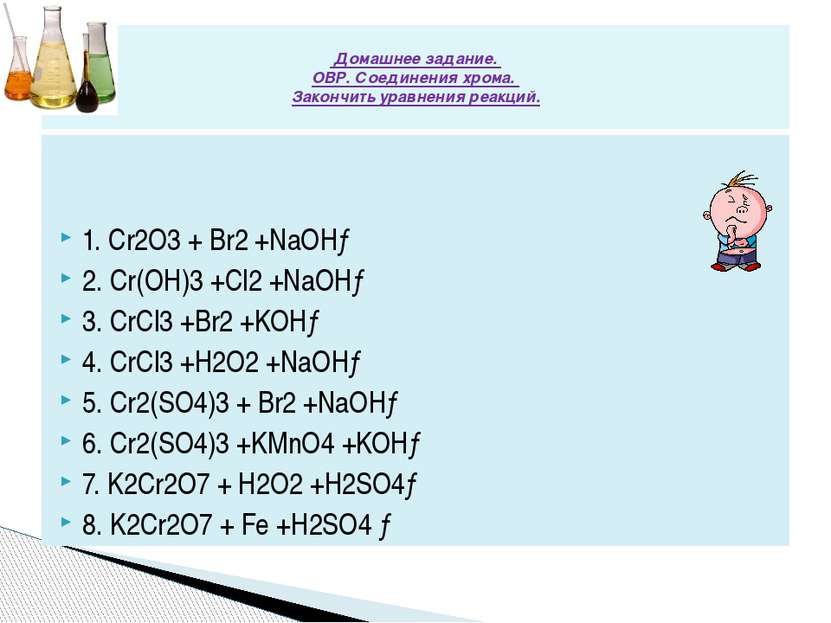
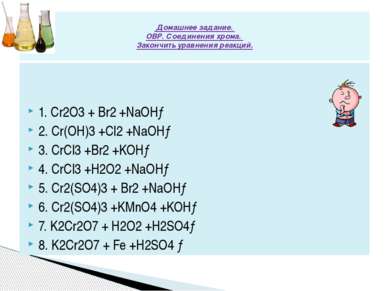
 Сr2(SO4)3 + KMnO4 + … = K2CrO4 + … K2SO4 + H2O К2Сr2О7 +Н2S + … = …+ Сr2(SО4)3 + …+ …. K2Cr2O7 + SO2 +… = K2SO4 +… + H2SO4 KCrO2 + Br2 +… =Na2CrO4 + KBr +… + H2O Cr(OH)3 + Ag2O + NaOH = Ag + ? +.. ? С1 Используя метод электронного баланса, составьте уравнения реакций , определите окислитель и восстановитель.
Сr2(SO4)3 + KMnO4 + … = K2CrO4 + … K2SO4 + H2O К2Сr2О7 +Н2S + … = …+ Сr2(SО4)3 + …+ …. K2Cr2O7 + SO2 +… = K2SO4 +… + H2SO4 KCrO2 + Br2 +… =Na2CrO4 + KBr +… + H2O Cr(OH)3 + Ag2O + NaOH = Ag + ? +.. ? С1 Используя метод электронного баланса, составьте уравнения реакций , определите окислитель и восстановитель.
Cлайд 14
 Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях: Na3 [Сг(OH)6] + Вг2 + NaOH →Na2CrO4 + HBr + Н2О Na2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O Работа экспертов :
Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях: Na3 [Сг(OH)6] + Вг2 + NaOH →Na2CrO4 + HBr + Н2О Na2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O Работа экспертов :
Cлайд 15
 Работа экспертов : Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях: Na3 [Сг(OH)6] + Вг2 + NaOH →Na2CrO4 + HBr + Н2О Na2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O
Работа экспертов : Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях: Na3 [Сг(OH)6] + Вг2 + NaOH →Na2CrO4 + HBr + Н2О Na2SO3 + К2Сг2О7 + H2SO4 →Na2SO4+Cr2(SO4)3 + КOH + H2O K2Cr2O7 + H2O2 +H2SO4→ Cr2(SO4)3+ КOH + O2 + H2O
Cлайд 16
 не может получиться такое вещество, которое вступает во взаимодействие со средой! а) в …среде не может получиться оксид металла, основание, аммиак; б) в …..среде не получится кислота или кислотный оксид; в) оксид или тем более металл, бурно реагирующие с водой, не образуются в …. растворе. Неверные с химической точки зрения продукты:
не может получиться такое вещество, которое вступает во взаимодействие со средой! а) в …среде не может получиться оксид металла, основание, аммиак; б) в …..среде не получится кислота или кислотный оксид; в) оксид или тем более металл, бурно реагирующие с водой, не образуются в …. растворе. Неверные с химической точки зрения продукты:
Cлайд 17
 не может получиться такое вещество, которое вступает во взаимодействие со средой! а) в кислой среде не может получиться оксид металла, основание, аммиак; б) в щелочной среде не получится кислота или кислотный оксид; в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе. Неверные с химической точки зрения продукты:
не может получиться такое вещество, которое вступает во взаимодействие со средой! а) в кислой среде не может получиться оксид металла, основание, аммиак; б) в щелочной среде не получится кислота или кислотный оксид; в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе. Неверные с химической точки зрения продукты:
Cлайд 18
 Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным. составьте уравнения 4-х реакций Практическая часть С2
Серо-зелёный порошок оксида хрома (III) сплавили с избытком щёлочи, полученное вещество растворили в воде, при этом получился тёмно-зелёный раствор. К полученному щелочному раствору прибавили пероксид водорода. Получился раствор желтого цвета, который при добавлении серной кислоты приобретает оранжевый цвет. При пропускании сероводорода через полученный подкисленный оранжевый раствор он мутнеет и вновь становится зелёным. составьте уравнения 4-х реакций Практическая часть С2